Reacción de Friedel-Crafts
Las reacciones de Friedel-Crafts son un tipo de reacción de sustitución electrófila aromática en las que en un compuesto aromático uno de los átomos de hidrógeno es sustituido por un alquilo —conocida como alquilación de Friedel-Crafts— o por un grupo acilo —acilación de Friedel-Crafts—. Fueron descubiertas el año 1879 por el químico francés Charles Friedel y por el químico estadounidense James M. Crafts.
Alquilación de Friedel-Crafts
[editar]En el caso más simple, implica la reacción entre un haluro de alquilo y una molécula de benceno en presencia de un ácido de Lewis como catalizador. Los productos son alquilbenceno y haluro de hidrógeno.

El orden de reactividad aumenta con la polarización del enlace C-X, siguiendo pues el orden RI < RBr < RCl < RF. Habitualmente se usan como catalizadores haluros de aluminio (AlX3) o de hierro (FeX3).

Con haluros primarios (RCH2X) la reacción empieza con la formación del aducto entre el halógeno del haloalcano y el ácido de Lewis: [R-X-AlX3]. Esto provoca la aparición de una carga positiva parcial (δ+) sobre el carbono adyacente al halógeno, lo que hace que sea más electrófilo.
En el caso de haluros secundarios (R2CHX) y terciarios (R3CX) se llegan a formar como intermedios sus carbocationes, junto con el anión AlX4-.
A continuación una vez generado el electrófilo este ataca al anillo aromático, seguido de perdida del protón (H+), en forma de HX, y recuperación del catalizador AlX3, según el mecanismo general de una sustitución electrófila aromática.
Inconvenientes de la alquilación de Friedel-Crafts
[editar]- Polisustitución, más de un grupo alquilo se une al anillo aromático. Esto se debe a que el alquilo activa el anillo aromático y lo vuelve más nucleófilo que el reactivo de partida.
- Transposición, un carbocatión primario se convierte en secundario o terciario por desplazamiento de hidrógeno o alquilo, dada la mayor estabilidad de los carbocationes en el sentido primario < secundario < terciario. Por tanto el carbocatión intermedio sufre transposiciones que implican la obtención de productos no deseados.
Esto limita su utilidad sintética.
Acilación de Friedel-Crafts
[editar]En el caso más simple, la reacción entre un haluro de acilo y una molécula de benceno en presencia de un ácido de Lewis como catalizador, habitualmente AlX3. Los productos son acilbenceno (o fenilcetona) y haluro de hidrógeno.
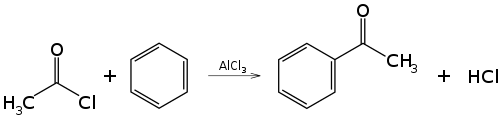

La reacción tiene lugar a través de la formación del catión acilio, (R-CO+), como intermedio. Este se genera cuando se forma un aducto entre el halógeno del haluro de acilo y el ácido de Lewis AlX3, el cual puede disociarse originando pequeñas cantidades del catión acilio, que es electrófilo.
A continuación el carbono del grupo acilio ataca el anillo aromático, seguido de perdida de protón (H+), según el mecanismo general de una sustitución electrófila aromática.
Dado que el grupo acilo es desactivante, el producto es menos reactivo que el compuesto de partida y por tanto no sufre más sustituciones. Además su capacidad aceptora de electrones se ve acentuada por la formación de un aducto entre el ácido de Lewis AlX3 y el átomo de oxígeno del grupo carbonilo. Esto obliga a usar más de un equivalente de catalizador. Se requiere un tratamiento acuoso final para liberar el producto del complejo con el haluro de aluminio.
Aplicación y variaciones
[editar]Esta reacción ha sido ampliamente estudiada y modificada:
- La Reacción de Gattermann-Koch puede ser utilizada para sintetizar benzaldehído a partir de benceno.
- La reacción de Gatterman consta de reacciones de arenos con ácido cianhídrico.
- La Reacción de Houben-Hoesch efectúa acilaciones con nitrilos.
- Cuando se utiliza el catalizador de Friedel y Crafts sobre un fenol, se produce el O-acilfenol. Cuando se somete a calentamiento se lleva a cabo la acilación del anillo mediante la transposición de Fries. Para formilar el anillo aromático de un fenol se utilizan las reacciones de Vilsmeier-Haack y de Reimer-Tiemann.
- En la reacción de Scholl dos arenos se condensan directamente.
- En la reacción de reacción de Zincke-Suhl el p-cresol se alquila a una ciclohexadienona con tetraclorometano.
- En la Síntesis de Bogert-Cook (1933) un 1-β-feniletilciclohexanol es deshidratado para dar el alqueno correspondiente. Con el catalizador de Friedel y Crafts, se forma el derivado octahidrogenado del fenantreno.[1]
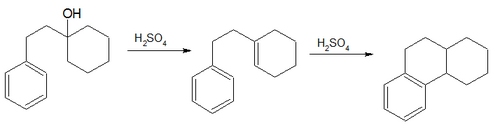
- En la Síntesis de Darzens-Nenitzescu (1910, 1936)[2] se lleva a cabo la acilación de ciclohexeno con cloruro de acetilo para producir metilciclohexenilcetona.

- En la Acilación reductiva de Nenitzescu (1936)[3] un hidrocarburo saturado se utiliza como sustrato para preparar la metilciclohexilcetona mediante una acilación reductiva.
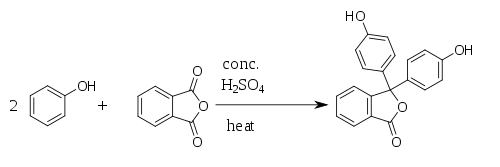
Síntesis de fenolftaleína y otros colorantes
[editar]La reacción de Friedel y Crafts ha sido utilizada en la síntesis de varios colorantes derivados del triarilmetane y del xanteno.[4] La reacción del anhídrido ftálico con fenol en presencia de cloruro de zinc produce la fenolftaleína. Esta reacción fue descubierta en 1871 por Adolf von Baeyer:
Reacciones de Haworth
[editar]La Reacción de Haworth es un método para la síntesis de tetralona.[5][6] Aquí, el benceno reacciona con anhídrido succínico; el producto intermediario es reducido y sometido a una segunda acilación de Friedel y Crafts intramolecular, generando así un segundo ciclo. (Véase también: [1]).
En una reacción relacionada, el fenantreno es sintetizado a partir de naftaleno y anhídrido succínico siguiendo el mismo procedimiento en una serie de pasos:
Prueba de Friedel-Crafts para arenos
[editar]La reacción de cloroformo con compuestos aromáticos empleando un catalizador de cloruro de aluminio da como resultado triarilmetanos, los cuales presentan colores brillantes. Es una prueba de identificación de arenos.
Referencias
[editar]- ↑ This reaction with phosphorus pentoxide: J. v. d. Kamp and E. Mosettig (1936). «Trans- And Cis-As-Octahydrophenanthrene». J. Am. Chem. Soc. 58 (6): 1062-1063. doi:10.1021/ja01297a514.
- ↑ Darzens-Nenitzescu Synthesis of Ketones
- ↑ [http://www.drugfuture.com/OrganicNameReactions/onr277.htm Nenitzescu Reductive Acylation
- ↑ McCullagh, James V.; Daggett, Kelly A. (2007). «Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions». J. Chem. Educ. 84: 1799.
- ↑ Robert Downs Haworth (1932). «Syntheses of alkylphenanthrenes. Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes». J. Chem. Soc.: 1125. doi:10.1039/JR9320001125.
- ↑ Name Reactions: A Collection of Detailed Reaction Mechanisms By Jie Jack Li Published 2003 Springer ISBN 3-540-40203-9
Bibliografía
[editar]- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.



