Piperidina
| Piperidina | ||
|---|---|---|
 | ||
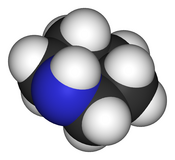 | ||
| Nombre IUPAC | ||
| Piperidina | ||
| General | ||
| Otros nombres |
Hexahidropiridina Azaciclohexano Ciclopentimina Hexazano Azinano | |
| Fórmula semidesarrollada | CH2(CH2)4NH | |
| Fórmula molecular | C5H11N | |
| Identificadores | ||
| Número CAS | 110-89-4[1] | |
| Número RTECS | TM3500000 | |
| ChEBI | 18049 | |
| ChEMBL | CHEMBL15487 | |
| ChemSpider | 7791 | |
| PubChem | 8082 | |
| UNII | 67I85E138Y | |
| KEGG | C01746 | |
|
C1CCNCC1
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro o amarillo pálido. | |
| Olor | Amoniacal, a pimienta o pescado. | |
| Densidad | 862 kg/m³; 0,862 g/cm³ | |
| Masa molar | 8515 g/mol | |
| Punto de fusión | −11 °C (262 K) | |
| Punto de ebullición | 105 °C (378 K) | |
| Presión de vapor | 28,3 ± 0,2 mmHg | |
| Índice de refracción (nD) | 1,4525 | |
| Propiedades químicas | ||
| Acidez | 11,28 pKa | |
| Solubilidad en agua | 250 g/L | |
| log P | 0,84 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 275,15 K (2 °C) | |
| NFPA 704 |
3
3
3
| |
| Compuestos relacionados | ||
| aminas heterocíclicas |
Pirrolidina Piperazina Nanofina Azepano Azocano Azecano | |
| piperidinas | 4-(1-pirrolidinil)-piperidina | |
| heterociclos con azufre |
Tiazolidina Tiomorfolina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La piperidina es un compuesto orgánico de fórmula molecular C5H11N, cuya estructura química corresponde a una amina heterocíclica saturada de seis miembros. Fue descrita por vez primera en 1850 por el químico escocés Thomas Anderson y luego, de forma independiente, por el francés Auguste Cahours en 1852, quien le dio nombre.[2] El término «piperidina» proviene de la palabra Piper, género de plantas magnoliopsidas que incluye a la pimienta.[3][4]
Características físicas y químicas
[editar]A temperatura ambiente, la piperidina es un líquido fumante incoloro o de color amarillo pálido. Desprende un característico olor a amoníaco, pimienta o pescado, definido también como nauseabundo.[5] Su sabor ha sido descrito como «a pimienta ardiente».[6] Tiene su punto de ebullición a 105 °C y su punto de fusión a -11 °C. Menos denso que el agua (ρ = 0,862 g/cm³), es soluble en etanol, éter, acetona, benceno y cloroformo. Su solubilidad en agua —cifra estimada— es de 250 g/L. El valor del logaritmo de su coeficiente de reparto, logP = 0,84, indica una solubilidad mayor en disolventes apolares que en disolventes polares. Su vapor es tres veces más denso que el aire.[6][7]
La piperidina es una base débil (pKa = 11,28).[6] Por ello, neutraliza ácidos en reacciones exotérmicas formando sales y agua. Al combinarse con agentes reductores fuertes como hidruros, puede generar hidrógeno gaseoso.[8]
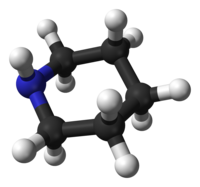
Conformación
[editar]La piperidina adopta diversas conformaciones espaciales, en concreto una conformación de silla similar a la que presenta el ciclohexano. Pero a diferencia de este, la piperidina tiene dos conformaciones de silla distinguibles: una con el enlace N–H en posición axial, y la otra en posición ecuatorial. Tras cierta controversia a mediados del siglo XX, se concluyó que la conformación ecuatorial es más estable (por 0,72 kcal/mol) en fase gaseosa.[9] Dicha conformación parece también ser la más estable en disoluciones de piperidina en solventes apolares, si bien en solventes polares la conformación preferida puede ser la contraria.[10]
Los dos confórmeros se interconvierten rápidamente a través de la denominada inversión del nitrógeno (oscilación del átomo de nitrógeno de uno al otro lado del plano formado por los grupos a los que está unido); la energía libre estimada para este proceso es de 6,1 kcal/mol, sustancialmente más baja que los 10,4 kcal/mol necesarios para la inversión del anillo (oscilación más global que si bien conserva la forma del anillo, hace cambiar las posiciones espaciales entre átomos).[11] En el caso de la 1-metilpiperidina, la conformación ecuatorial es la preferida por 3,16 kcal/mol,[9] energía mucho mayor que en el caso del metilciclohexano (1,74 kcal/mol).
 |
 |
Fuentes de piperidina y de sus derivados
[editar]La piperidina ha sido obtenida a partir de la pimienta negra,[12] de las variedades naturales Psilocaulon absimile N.E.Br (Aizoaceae)[13] y Petrosimonia monandra.[14]
Asimismo, la estructura de la piperidina está presente en numerosos alcaloides naturales como la piperina —que da a la pimienta negra su sabor picante—, la toxina de las hormigas coloradas Solenopsis invicta,[15] el análogo de la nicotina conocido como anabasina —del arbusto Nicotiana glauca—, la lobelina de Lobelia inflata o el alcaloide tóxico cicutina procedente del género de plantas Conium.
Síntesis
[editar]A nivel industrial, la piperidina es producida por hidrogenación de la piridina, normalmente catalizada por disulfuro de molibdeno:[16]
- C5H5N + 3 H2 → C5H10NH
La piridina también puede ser reducida a piperidina por sodio en etanol en una reducción de Birch modificada,[17] o utilizando como catalizador nanopartículas de rutenio sobre óxido de magnesio.[18]
Otra vía de síntesis consiste en una deshidrogenación de 5-amino-1-pentanol utilizando complejos de osmio y rutenio como catalizadores.[19] También se puede obtener piperidina a partir de la ciclación de cadaverina a 180 °C en presencia de un catalizador de rutenio en difenil éter.[20]
Usos
[editar]La piperidina se emplea como disolvente y como base. Lo mismo sucede con algunos de sus derivados, como la N-formilpiperidina, disolvente aprótico con mayor solubilidad para hidrocarburos que otros disolventes del grupo de las amidas, y la 2,2,6,6-tetrametilpiperidina, base muy útil debido a su baja nucleofilia y alta solubilidad en disolventes orgánicos.
Otra importante aplicación industrial de la piperidina es en la producción de dipiperidinil ditiuram tetrasulfuro, utilizado como acelerador en la vulcanización del caucho.[16]
La piperidina y sus derivados son muy empleados en la síntesis de productos farmacéuticos. La estructura de la piperidina se encuentra en compuestos como paroxetina, risperidona, metilfenidato, raloxifeno, minoxidil, tioridazina, haloperidol, droperidol, mesoridazina, petidina, melperona, los agentes psicoquímicos Ditran-B (JB-329), N-metil-3-piperidil benzilato (JB-336) y muchos otros.
La piperidina, como amina secundaria, se emplea para convertir cetonas en enaminas, o como base en la condensación de Knoevenagel.[21] Las enaminas así elaboradas pueden usarse en reacciones de alquilación de enaminas de Stork.[22] Asimismo, la piperidina es ampliamente utilizada en reacciones químicas de degradación, como la secuenciación de ADN y la posterior escisión de algunos nucleótidos específicamente modificados.
Por otra parte, esta cicloamina aparece, como sustancia precursora, en la Tabla II de la Convención de las Naciones Unidas Contra el Tráfico Ilícito de Drogas Narcóticas y Sustancias Psicotrópicas, debido a su uso en los años 70 en la industria clandestina de la fenciclidina (compuesto también conocido como «polvo de ángel»).[23]
Precauciones
[editar]La piperidina es un compuesto inflamable que al arder desprende óxidos de nitrógeno tóxicos. Su punto de inflamabilidad es 3 °C. Las mezclas del vapor de esta amina con el aire son explosivas a temperatura ambiente. Es un fuerte irritante que puede provocar daños permanentes después de una exposición corta incluso en pequeñas cantidades. Su ingestión puede implicar cambios tanto reversibles e irreversibles. Dosis de 30-60 mg/kg pueden ocasionar síntomas en el organismo humano.[6]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Véase:
- Edgar W. Warnhoff (1998) "When piperidine was a structural problem," Bulletin of the History of Chemistry, 22 : 29-34. University of Illinois
- Thomas Anderson (1850) "Vorläufiger Bericht über die Wirkung der Salpetersäure auf organische Alkalien", Annalen der Chemie und Pharmacie, 75 : 80-83 (p. 82).
- Auguste Cahours (1852) "Recherches sur un nouvel alcali dérivé de la pipérine", Comptes rendus, 34 : 481-484. Cahours la denominó piperidina (p. 483): "L'alcali nouveau dérivé de la piperine, que je désignerai sous le nom de piperidine..."
- (Nota: Ambos obtuvieron la piperidina haciendo reaccionar piperina con ácido nítrico.)
- ↑ Alexander Senning (2006). Elsevier's Dictionary of Chemoetymology. Amsterdam: Elsevier. ISBN 0444522395.
- ↑ Piperidine (ChEBI)
- ↑ Frank Johnson Welcher (1947). Organic Analytical Reagents. D. Van Nostrand. pp. 149.
- ↑ a b c d Piperidina (PubChem)
- ↑ Piperidine (ChemSpider)
- ↑ 1-Oxa-4-azacyclohexane (Chemical Book)
- ↑ a b Luis Carballeira, Ignacio Pérez-Juste (1998). «Influence of calculation level and effect of methylation on axial/equatorial equilibria in piperidines». Journal of Computational Chemistry 19 (8): 961-976. doi:10.1002/(SICI)1096-987X(199806)19:8<961::AID-JCC14>3.0.CO;2-A.
- ↑ Ian D. Blackburne, Alan R. Katritzky, Yoshito Takeuchi (1975). «Conformation of piperidine and of derivatives with additional ring hetero atoms». Acc. Chem. Res. 8 (9): 300-306. doi:10.1021/ar50093a003.
- ↑ F.A.L. Anet, Issa Yavari (1977). «Nitrogen inversion in piperidine». J. Am. Chem. Soc. 99 (8): 2794-2796. doi:10.1021/ja00450a064.
- ↑ Spaeth and Englaender, Ber.1935,68, 2218; cf. Pictet and Pictet, Helv. Chim. Acta, 1927, 10, 593
- ↑ Rimington, S. Afr. J. Sci, 1934, 31, 184
- ↑ Juraschewski and Stepanov, J. Gen. Chem., U.R.S.S., 1939, 9, 1687
- ↑ Arbiser JL, Kau T, Konar M et al. (2007). «Solenopsin, the alkaloidal component of the fire ant (Solenopsis invicta), is a naturally occurring inhibitor of phosphatidylinositol-3-kinase signaling and angiogenesis». Blood 109 (2): 560-5. PMID 16990598. doi:10.1182/blood-2006-06-029934.
- ↑ a b Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke “Amines, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH. doi 10.1002/14356007.a02_001
- ↑ C. S. Marvel and W. A. Lazier (1941). "Benzoyl Piperidine". Org. Synth.; Coll. Vol. 1: 99.
- ↑ Minfeng Fang, Roberto A. Sánchez-Delgado (2014). «Ruthenium nanoparticles supported on magnesium oxide: A versatile and recyclable dual-site catalyst for hydrogenation of mono- and poly-cyclic arenes, N-heteroaromatics, and S-heteroaromatics». Journal of Catalysis 311: 357-368. Consultado el 12 de junio de 2016.
- ↑ Marcello Bertoli; Aldjia Choualeb; Alan J. Lough; Brandon Moore; Denis Spasyuk; Dmitry G. Gusev (2011). «Osmium and Ruthenium Catalysts for Dehydrogenation of Alcohols». Organometallics 30 (13): 357-368. Consultado el 12 de junio de 2016.
- ↑ Bui-The-Khai; Concilio, Carlo; Porzi, Gianni (1981). «Cyclization of .alpha.,.omega. aliphatic diamines and conversion of primary amines to symmetrical tertiary amines by a homogeneous ruthenium catalyst». The Journal of Organic Chemistry 46 (8): 1759-1760. Consultado el 12 de junio de 2016.
- ↑ Vinayak V. Kane and Maitland Jones Jr (1990). "Spiro[5.7]trideca-1,4-dien-3-one". Org. Synth.; Coll. Vol. 7: 473.
- ↑ Michael B. Smith; Jerry March (2001). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5th edición). Wiley-Interscience. ISBN 0-471-58589-0.
- ↑ List of Precursors and Chemicals Frequently Used in the Illicit Manufacture of Narcotic Drugs and Psychotropic Substances Under International Control, International Narcotics Control Board

