2-Mercaptoetanol
| 2-Mercaptoetanol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-Hidroxi-1-etanotiol | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular | C2H6OS | |
| Identificadores | ||
| Número CAS | 60-24-2[1] | |
| Número RTECS | KL5600000 | |
| ChEBI | 41218 | |
| ChEMBL | CHEMBL254951 | |
| ChemSpider | 1512 | |
| DrugBank | DB03345 | |
| PubChem | 1567 | |
| UNII | 14R9K67URN | |
| KEGG | C00928 | |
|
SCCO
| ||
| Propiedades físicas | ||
| Densidad | 1114 kg/m³; 1,114 g/cm³ | |
| Masa molar | 78,13 g/mol | |
| Punto de fusión | 173 K (−100 °C) | |
| Punto de ebullición | 430 K (157 °C) | |
| Índice de refracción (nD) | 1,4996 | |
| Peligrosidad | ||
| SGA |
   | |
| Punto de inflamabilidad | 341 K (68 °C) | |
| NFPA 704 |
2
3
1
| |
| Frases H | H301, H310, H315, H317, H318, H330, H410 | |
| Frases P | P260, P273, P280, P284, P301+310, P302+350 | |
| Límites de explosividad | 18% | |
| Riesgos | ||
| LD50 | 244 mg/kg (ratas, oral) | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Etilenglicol Etano-1,2-ditiol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El 2-mercaptoetanol (también conocido como β-mercaptoetanol, BME, 2BME o β-met) es un compuesto químico con la fórmula HOCH2CH2SH. Es un híbrido entre el etilenglicol, HOCH2CH2OH, y el 1,2-etanoditiol, HSCH2CH2SH. El ME o βME, como comúnmente se abrevia, se emplea profusamente en el laboratorio para reducir los puentes disulfuro y puede actuar como antioxidante biológico, reciclando radicales hidroxilo (entre otros) Se emplea ampliamente debido a que el grupo hidroxilo le confiere buena solubilidad en agua, a la vez que disminuye la volatilidad. Debido a su reducida presión de vapor, su olor, aunque desagradable, es menos molesto que el de otros tioles relacionados.
Preparación
[editar]El β-ME se puede preparar por la acción de sulfuro de hidrógeno sobre óxido de etileno:[2]
Reacciones
[editar]El 2-Mercaptoetanol reacciona con aldehídos y cetonas para dar los correspondientes oxatiolanos. Esto hace útil al 2-mercaptoetanol como grupo protector.[3]
Aplicaciones
[editar]Desnaturalización de proteínas
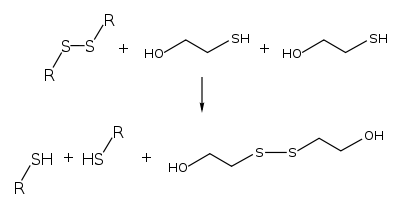
[editar]Algunas proteínas pueden ser desnaturalizadas por el 2-mercaptoetanol por medio de su habilidad para separar puentes disulfuro:
Por medio de la ruptura de los puentes S-S, la estructura terciaria así como la estructura cuaternaria de algunas proteínas se pueden ver disruptas.[4] Si una proteína consta de varias cadenas polipeptídicas distintas unidas mediante puentes disulfuro, la acción del 2-mercaptoetanol separará las cadenas polipeptídicas distintas. Por ello, el 2-mercaptoetanol se emplea profusamente para analizar el estado de oligomerización de las proteínas.
El 2-mercaptoetanol se puede reemplazar por ditiotreitol (DTT) o el menos oloroso tris(2-carboxietil)fosfina (TCEP) en aplicaciones biológicas.
Desnaturalización de ribonucleasas
[editar]El 2-mercaptoetanol se emplea en algunos protocolos de aislamiento de RNA para eliminar ribonucleasas liberadas durante la lisis celular. Ello se debe a que las ribonucleasas son proteínas estabilizadas mediante numerosos puentes disulfuro. La acción del 2-mercaptoetanol desnaturaliza irreversiblemente estas moléculas, lo cual previene la digestión del RNA durante el procedimiento.[5]
Seguridad
[editar]El 2-mercaptoetanol se considera un veneno "severo", causando irritación en las vías nasales y el tracto respiratorio al ser inhalado, vómitos y dolor de estómago al ser ingerido, y absorción potencialmente fatal al entrar en contacto con la piel.[6]
Referencias
[editar]- ↑ Número CAS
- ↑ Knight, J. J. "2-Mercaptoethanol" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ «1,3-Dithiolanes, 1,3-Dithianes». Organic Chemistry Portal.
- ↑ «2-Mercaptoethanol». Chemicalland21.com. Archivado desde el original el 5 de octubre de 2006.
- ↑ Nelson, David R.; Lehninger, Albert L; Cox, Michael (2005). Lehninger principles of biochemistry. Nueva York: W.H. Freeman. pp. 148. ISBN 0-7167-4339-6.
- ↑ «Material Safety Data Sheet». ScienceLab.com. Archivado desde el original el 7 de noviembre de 2009. Consultado el 1 de mayo de 2009.