Conductos galactóforos
| Conductos galactóforos | ||
|---|---|---|
 Esquema de la glándula mamaria: 1. Caja torácica 2. Músculo pectoral mayor 3. Lóbulos 4. Pezón 5. Areola mamaria 6. Conducto galactóforo 7. Tejido adiposo 8. Piel | ||
| Nombre y clasificación | ||
| Latín |
[TA]: ductus lactiferi; tubulus lactiferi | |
| TA | A16.0.02.010 | |
| Gray | pág.1268 | |
|
| ||
Un conducto mamario (también conocido como conducto galactóforo y, en latín, ductus lactiferi) es uno de los numerosos conductos que transportan leche desde los lóbulos mamarios al pezón.
La glándula mamaria consta de dos elementos fundamentales:
- Los acinos glandulares, donde se encuentran las células productoras de leche
- Los ductos, conjunto de estructuras arboriformes o ramificadas, tubulares y huecas, cuyas luces confluyen progresivamente en canalículos más y más gruesos hasta terminar en uno de los doce a dieciocho galactóforos. Los galactóforos son dilataciones ductales a modo de reservorios situados inmediatamente por detrás del pezón
Formación
[editar]El desarrollo de las ramificaciones (morfogénesis) de los conductos galactóforos, necesita de la formación de grandes superficies epiteliales, que logra el aumento del volumen del órgano limitado que es la mama.
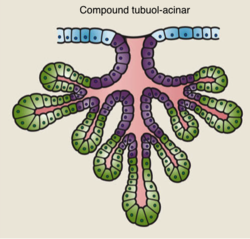
La morfogénesis comienza en el embrión, pero la mayoría de las bifurcaciones de ramas y el alargamiento de los conductos tienen lugar durante la pubertad. La morfogénesis del epitelio es impulsada por yemas terminales (TEB). Estas son estructuras en forma de bulbo, que contienen epitelio estratificado, que prolifera e invade el estroma que lo circunda.
Los procesos que conducen a la morfogénesis del epitelio, que son la proliferación, la migración, la intercalación, la diferenciación y la muerte de las células epiteliales, están regulados tanto por programas genéticos internos como por señales externas. Las señalizaciones son sistémicas (endócrinas, hormonas) y señalizaciones del microambiente local específico (paracrinas) de la mama.[1]
Dentro de los epitelios cuya ramificación se determina tanto por las acciones predecibles del proceso, como por elementos aleatorios (estocástica), la glándula mamaria es el paradigma tisular ideal.
Microaquitectura
[editar]En el ratón hembra, los conductos epiteliales están rodeados por fibroblastos (FB) periductales, formando una vaina rica en colágeno y fibroblastos, que separa los conductos del estroma rico en tejido adiposo.[2]
En la hembra humana, el epitelio está encerrado en dos tipos de estroma histológicamente distintos. Un estroma laxo y más celular denominado estroma intralobulillar, formado principalmente por fibroblastos, está en estrecho contacto con el epitelio dentro de las unidades ductales lobulillares terminales (TDLU). Las TDLU están además incrustadas en un estroma interlobulillar más compacto, que es más rico en colágeno y separa las TDLU del tejido adiposo.
Ultraestructura
[editar]Los fibroblastos (FB) son la principal fuente de la matriz extracelular (ECM en inglés) y por tanto los causantes de su remodelación. Los FB son actores centrales de múltiples vías de señalización paracrina. Por tanto, los fibroblastos son reguladores cruciales del desarrollo de los conductos.[2]
El desarrollo de la glándula mamaria depende de interacciones recíprocas epitelio-mesenquimales/estromales permanentes. Estas interacciones implican señalización paracrina, remodelación de la ECM y mecanodetección y están mediadas por múltiples vías de señalización. Los fibroblastos mamarios desempeñan funciones clave en todas estas modalidades de señalización.
Véase también
[editar]Referencias
[editar]- ↑ Sumbal J.; Fre S.; Sumbalova Koledova Z. (2024). «Fibroblast-induced mammary epithelial branching depends on fibroblast contractility.». PLoS Biology (Public Library of Science) 22 (21): e3002093. doi:10.1371/journal.pbio.3002093. Consultado el 20 de febrero de 2024.

- ↑ a b Sumbal J.; Belisova D.; Koledova Z. «Fibroblasts: The grey eminence of mammary gland development». Seminars in Cell & Developmental Biology 114 (June 2021): 134-142. doi:10.1016/j.semcdb.2020.10.012. Consultado el 21 de febrero de 2024.
