Deposición química de vapor

La Deposición Química de Vapor o CVD (de sus siglas en inglés Chemical Vapor Deposition) es un proceso químico utilizado para producir productos de alta pureza y de alto rendimiento de materiales sólidos. El proceso se utiliza a menudo en la industria de semiconductores para producir películas delgadas. En un proceso CVD estándar el sustrato (oblea) se expone a uno o más precursores volátiles, que reaccionan o se descomponen en la superficie del sustrato para producir el depósito deseado. Con frecuencia, también se producen subproductos volátiles, que son eliminados por medio de un flujo de gas que pasa a través de la cámara de reacción.
Los procesos de microfabricación CVD se emplean ampliamente para depositar materiales en diversas formas, incluyendo: monocristalino, policristalino, amorfo, y epitaxial. Estos materiales incluyen: silicio, fibra de carbono, nanofibras de carbono, filamentos, nanotubos de carbono, SiO2, silicio-germanio, tungsteno, carburo de silicio, nitruro de silicio, oxinitruro de silicio, nitruro de titanio, y diversos dieléctricos de alta permitividad eléctrica. El proceso de CVD se utiliza también para producir diamantes sintéticos.
Procesos
[editar]
Existen numerosos procesos, dependiendo del campo de aplicación. Estos procesos se diferencian en el medio por el que se inician las reacciones químicas (por ejemplo, proceso de activación) y las condiciones del proceso.
- Clasificada por la presión de funcionamiento:
- A presión atmosférica ECV (APCVD) - procesos de CVD a presión atmosférica.
- CVD de baja presión (LPCVD) -. procesos CVD a presiones subatmosféricas[1] presiones reducidas tienden a reducir reacciones no deseados en fase gaseosa y mejorar la uniformidad de la película sobre la oblea. Los procesos CVD más modernos son bien LPCVD o UHVCVD.
- Ultra vacío, CVD (UHVCVD) - los procesos CVD a una presión muy baja, por lo general por debajo de 10-6 Pa (~ 10-8 torr ). Tenga en cuenta que en otros campos, la división inferior entre el alto y ultra alto vacío, es a menudo 10-7 Pa.
- Clasificada por las características físicas de vapor:
- Aerosol CVD asistida (AACVD) - Un procedimiento de CVD en la que los precursores son transportados al sustrato por medio de un aerosol líquido/gas, que puede ser generado por ultrasonidos. Esta técnica es adecuada para su uso con precursores no volátiles.
- Inyección directa de líquido CVD (DLICVD) - Un procedimiento de CVD en la que los precursores se encuentran en forma líquida (líquido o sólido disuelto en un disolvente conveniente). Las soluciones líquidas se inyectan en la cámara de vaporización mediante inyectores (por lo general inyectores de automóviles). A continuación, los vapores precursores son transportados al sustrato como en clásico procedimiento de CVD. Esta técnica es adecuada para su uso en precursores líquidos o sólidos. Altas tasas de crecimiento se puede alcanzar con esta técnica.
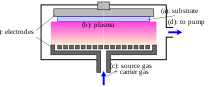
- Métodos con Plasma (véase también el procesamiento de plasma ):
- Microondas asistida por plasma CVD (MPCVD)
- Mejorada por plasma CVD (PECVD) - procesos que utilizan CVD de plasma. para mejorar la tasa de reacción química de los precursores[2] procesamiento PECVD permite la deposición a temperaturas más bajas, lo cual es a menudo crítico en la fabricación de semiconductores.
- Remoto mejorada por plasma CVD (RPECVD) - Similar a PECVD excepto que el sustrato (oblea) no está directamente en la región de descarga de plasma. La separación de la oblea de la región del plasma permite procesar menores temperaturas hasta la temperatura ambiente.
- ECV de capa Atómica ( ALCVD ) - Depósitos de las capas sucesivas de diferentes sustancias para producir capas, cristalinas películas. Ver epitaxia de capas atómicas.
- Deposición de combustión de vapor químico (CCVD) - propietaria nGimat de combustión química proceso de deposición de vapor es un ambiente abierto, basado en la técnica de llama para el depósito de alta calidad las películas delgadas y los nanomateriales.
- CVD de alambre caliente (HWCVD) - también conocida como CVD catalizador (Cat-CVD) o CVD de filamento caliente (HFCVD). Utiliza un filamento caliente para descomponer químicamente los gases primarios.[3]
- Deposición de vapor mediante procesos químicos organometálicos (MOCVD) - procesos CVD basado en precursores organometálicos.
- Híbrido físico-deposición de vapor químico (HPCVD) - procesos de deposición de vapor que involucran tanto la descomposición química del gas precursor como la vaporización de una fuente sólida.
- Rápido CVD térmico (RTCVD) - procesos de CVD que utilizan lámparas de calefacción u otros métodos para calentar rápidamente el sustrato de la oblea. Calentar sólo el sustrato en lugar de las paredes de gas o cámara ayuda a reducir las reacciones en fase de gas no deseadas que pueden conducir a la formación de partículas.
- Vapor de epitaxia en fase (VPE)
- Deposición de vapor asistida por eyección electroestática (ESAVD)
Usos
[editar]Circuitos integrados
[editar]Varios procesos CVD se utilizan en los circuitos integrados (ICs). Materiales específicos se depositan mejor en condiciones específicas.
Polisilicio
[editar]El silicio policristalino se deposita a partir de silano (SiH4), según la siguiente reacción:
- SiH4 → Si + 2 H2
Esta reacción se realiza generalmente en sistemas de LPCVD, ya sea con materia prima pura silano, o una solución de silano con 70-80% de nitrógeno. Las temperaturas entre 600 y 650 °C y presiones entre 25 y 150 Pa producir una tasa de crecimiento entre 10 y 20 nm por minuto. Un proceso alternativo utiliza un basado en soluciones de hidrógeno. El hidrógeno reduce la tasa de crecimiento, pero la temperatura se eleva a 850 o incluso 1050 °C para compensar.
El polisilicio puede crecer directamente con dopaje, si se añaden gases tales como fosfina, arsina o diborano a la cámara de CVD. El diborano aumenta la tasa de crecimiento, pero la arsina y la fosfina lo reducen.
Dióxido de silicio
[editar]El dióxido de silicio (normalmente llamado simplemente "óxido" en la industria de semiconductores) se pueden depositar por varios procesos diferentes. Los gases de origen más comunes incluyen silano y oxígeno, diclorosilano (SiCl2 H2 ) y óxido nitroso (N2O), o tetraetilortosilicato (TEOS; Si (OC2H5)4 ). Las reacciones son las siguientes:
- SiH4 + O2 → SiO2 + 2 H2
- SiCl2H2 + 2 N2O → SiO2 + 2 N2 + 2 HCl
- Si (OC2H5 )4 → SiO2 + subproductos
La elección de la fuente de gas depende la estabilidad térmica del substrato, por ejemplo, de aluminio es sensible a la temperatura elevada. Depósitos silano entre 300 y 500 °C, diclorosilano alrededor de los 900 °C, y TEOS entre 650 y 750 °C, resultando una capa de óxido de baja temperatura (LTO). Sin embargo, silano produce un óxido de menor calidad que los otros métodos (inferior resistencia dieléctrica, por ejemplo), y se deposita no conformemente. Cualquiera de estas reacciones pueden ser utilizados en LPCVD, pero la reacción de silano se realiza también en APCVD. ECV óxido invariablemente tiene menor calidad que el óxido térmico, pero la oxidación térmica sólo se puede utilizar en las primeras etapas de fabricación de CI.
Óxido también pueden cultivarse con impurezas (aleación o "dopaje"). Esto puede tener dos propósitos. Durante las etapas del proceso, además, que se producen a alta temperatura, las impurezas pueden difundirse desde el óxido de las capas adyacentes (especialmente silicio) y la doparlas. Los óxidos que contienen impurezas 5-15% en masa a menudo se utilizan con este propósito. Además, el dióxido de silicio aleado con pentóxido de fósforo ("P-vidrio") se puede utilizar para suavizar superficies irregulares. P-vidrio se ablanda y fluye a temperaturas superiores a 1000 °C. Este proceso requiere una concentración de fósforo de al menos 6%, pero concentraciones por encima de 8% puede corroer el aluminio. El fósforo se deposita a partir de gas de fosfina y oxígeno:
- 4 PH3 + 5 O2 → 2 P2 O5 + 6 H2
Los vidrios que contienen tanto boro como fósforo (vidrio de borofosfosilicato, BPSG) se someten a flujo viscoso a temperaturas más bajas; alrededor de 850 °C es alcanzable con los vidrios que contienen alrededor de 5% en peso de ambos componentes, pero la estabilidad en el aire puede ser difícil de lograr.El óxido de fósforo en altas concentraciones interactúa con la humedad ambiental para producir ácido fosfórico. Los cristales de BPO4 también puede precipitar a partir del vidrio que fluye en el enfriamiento; estos cristales no son fácilmente grabado en los plasmas estándar reactivos utilizados para los óxidos de patrón, y dará lugar a defectos en la fabricación de circuitos de circuito integrado.
Además de estas impurezas intencionales, óxido de CVD puede contener subproductos del proceso de deposición. TEOS produce un óxido relativamente puro, mientras que el silano introduce impurezas de hidrógeno, y el diclorosilano introduce cloro.
También se ha explorado la deposición a baja temperatura (350 a 500 °C) de dióxido de silicio y vidrios a partir de TEOS dopado con ozono en lugar de oxígeno. Los vidrios de ozono tienen una conformalidad excelente, pero tienden a ser higroscópicos - es decir, absorben agua del aire debido a la incorporación de silanol (Si-OH) en el cristal. La espectroscopia infrarroja y la tensión mecánica en función de la temperatura son valiosas herramientas para diagnosticar tales problemas.
Nitruro de silicio
[editar]El nitruro de silicio se utiliza a menudo como una barrera aislante y químicas en la fabricación de circuitos integrados. Las dos siguientes reacciones de fase gaseosa depositan nitruro:
- 3 SiH4 + 4 NH3 → Si3 N 4 + 12 H 2
- 3 SiCl2 H2 + 4 NH3 → Si3 N 4 + 6 HCl + 6 H 2
El nitruro de silicio depositado por LPCVD contiene hasta 8% de hidrógeno. También experimenta un fuerte estrés de tracción, que puede agrietarse películas más gruesas de 200 nm. Sin embargo, tiene mayor resistividad y resistencia dieléctrica que la mayoría de los aisladores comúnmente disponibles en microfabricación (10 16 Ω $ cm y 10 M V / cm, respectivamente).
Otras dos reacciones pueden utilizazse en el plasma para depositar SENOH:
- 2 SiH4 + N2 → 2 SiNH + 3 H2
- SiH4 + NH3 → SiNH + 3 H2
Estas películas tienen mucho menos estrés a la tracción, pero peores propiedades eléctricas (resistividad 106 1015 w · cm, y la fuerza dieléctrica 1 a 5 MV / cm).[4]
Metales
[editar]Algunos metales (significativamente el aluminio y el cobre ) rara vez, o nunca, se depositan mediante CVD. En 2010 no existía, un proceso CVD comercialmente viables para el cobre, a pesar de que se habían probado formiato de cobre, cobre (HFAC) 2, Cu (II) acetoacetato de etilo, y otros precursores. La deposición de cobre metálico se realiza principalmente por galvanoplastia, con el fin de reducir coste. El aluminio puede ser depositado a partir de tri- isobutil aluminio (TIBAL), tri etilo / aluminio de metilo (TEA, TMA), o hidruro de dimetilaluminio (DMAH), pero generalmente se prefieren los métodos de deposición física de vapor.
Sin embargo, los procesos de CVD se utilizan ampliamente con el molibdeno, tantalio, titanio, níquel, wolframio. Estos metales pueden formar útiles siliciuros cuando se depositan sobre el silicio. Mo, Ta y Ti se depositan por LPCVD, desde sus pentacloratos. Níquel, molibdeno y wolframio se pueden depositar a bajas temperaturas de sus precursores de carbonilo. En general, para un metal arbitrario M, la reacción es como sigue:
- 2 MCI5 + 5 H2 → 2 M + 10 HCl
La fuente habitual de wolframio es el hexafluoruro de wolframio, que puede ser depositado de dos formas:
- WF6 → W + 3 H2
- WF6 + 3 H2 → W + 6 HF
Diamantes
[editar]
Se puede emplear CVD para producir diamantes sintéticos mediante la creación de las circunstancias necesarias para que los átomos de carbono de un gas se asiente sobre un sustrato en forma cristalina.
El CVD de diamantes recibe una gran atención en las ciencias de materiales, puesto que permite muchas aplicaciones nuevas del diamante que se habían considerado demasiado difíciles de hacer económicamente. El crecimiento ECV del diamante se produce normalmente en condiciones de baja presión (1-27 kPa; 0.145-3.926 psi; 7.5-203 Torr ) e implica la alimentación de cantidades variables de gases en una cámara, energizando ellos y proporcionar condiciones para el crecimiento de diamantes sobre el sustrato. Los gases siempre incluyen una fuente de carbono, e incluyen también normalmente hidrógeno, aunque las cantidades utilizadas varían mucho dependiendo del tipo de diamante que se cultivan. Las fuentes de energía incluyen filamento caliente, microondas, y descargas de arco, entre otras. La fuente de energía está destinado a generar un plasma en el que los gases se descomponen y producen químicas más complejas. El proceso químico real del crecimiento del diamante está todavía bajo estudio y se complica por la muy amplia variedad de procesos de crecimientos de diamante utilizado.
Las ventajas de crecimiento del diamante mediante CVD incluyen la capacidad de hacer crecer diamantes en grandes áreas, la capacidad de crecer sobre un substrato, y el control sobre las propiedades del diamante producido. En el pasado, cuando se utilizaron técnicas de alta presión y alta temperatura (HPHT) para producir diamantes, los diamantes eran típicamente diamantes libres muy pequeñas permanentes de diferentes tamaños. Se han logrado áreas de crecimiento de diamante CVD de más de quince centímetros de diámetro y es probable zonas mucho más grandes en el futuro. La mejora de esta capacidad es clave para permitir varias aplicaciones importantes.
La capacidad de hacer crecer diamantes directamente sobre un sustrato es importante porque permite la adición de muchas de las cualidades del diamante a otros materiales. Dado que el diamante tiene la conductividad térmica más alta de cualquier material a granel, capas de diamante en la electrónica de calor de alta producción (tal como la óptica y transistores) permite que el diamante para ser utilizado como un disipador de calor.[5][6] Se forman películas de diamante en la válvula de anillos, herramientas de corte y otros objetos que se benefician de la dureza del diamante y su muy baja tasa de desgaste. En cada caso el crecimiento del diamante debe hacerse cuidadosamente para lograr la adhesión necesaria sobre el sustrato. La muy elevada resistencia del diamante al rayado, su conductividad térmica, combinada con un menor coeficiente de expansión térmica que el vidrio Pyrex, un coeficiente de fricción próximo al de teflón ( politetrafluoroetileno) y una fuerte lipofilia haría un revestimiento antiadherente casi ideal para utensilios de cocina si se pueden recubrir económicamente grande áreas de sustrato.
El atributo más importante del crecimiento ECV del diamante es la capacidad de controlar las propiedades del diamante producido. En el área de crecimiento de diamante de la palabra "diamante" se utiliza como una descripción de cualquier material compuesto principalmente de carbono enlazado SP3, y hay muchos tipos diferentes de diamante incluidos en esta. Mediante la regulación de la transformación parámetros, especialmente los gases introducidos, pero incluyendo también la presión se hace funcionar el sistema bajo, la temperatura del diamante, y el método de generación de plasma puede realizarse muchos materiales diferentes que pueden ser considerados diamante. Diamante de cristal único puede hacer que contiene diversos dopantes.[7] Pueden formarse diamantes policristalinos que consiste en tamaños de grano de varios nanómetros a varios micrómetros.[8][9] Algunos granos de diamante policristalino están rodeados de fina y no de diamantes de carbono, mientras que otros no lo son. Estos factores afectan a la dureza del diamante, suavidad, conductividad, propiedades ópticas y mucho más.
Enlaces externos
[editar]- Técnicas de deposición química en fase de vapor (CVD). Cristina Gómez-Aleixandre. Instituto de Ciencia de Materiales de Madrid. CSIC.
- Fundamentals of Chemical Vapor Deposition, por TimeDomain CVD, Inc. (en inglés)
- Traditional Coating Technologies (en inglés)
- Chemical vapor deposition with atmospheric plasma (en inglés)
- Daniel M. Dobkin: Fundamentals of Chemical Vapor Deposition. (en inglés)
- Markus Winterer: Chemical Vapor Deposition and Chemical Vapor Synthesis. Universität Duisburg Essen (en inglés, PDF; 6 MB)
Véase también
[editar]Notas
[editar]- ↑ Low Pressure Chemical Vapor Deposition – Crystec Technology Trading GmbH.
- ↑ Plasma Enhanced Chemical Vapor Deposition – Crystec Technology Trading GmbH.
- ↑ Schropp, R.E.I.; B. Stannowski, A.M. Brockhoff, P.A.T.T. van Veenendaal and J.K. Rath. «Hot wire CVD of heterogeneous and polycrystalline silicon semiconducting thin films for application in thin film transistors and solar cells». Materials Physics and Mechanics. pp. 73-82.
- ↑ S.M. Sze (2008). Semiconductor devices: physics and technology. Wiley-India. p. 384. ISBN 81-265-1681-X.
- ↑ Costello, M; Tossell, D; Reece, D; Brierley, C; Savage, J (1994). «Diamond protective coatings for optical components☆». Diamond and Related Materials 3 (8): 1137-1141. doi:10.1016/0925-9635(94)90108-2.
- ↑ Sun Lee, Woong; Yu, Jin (2005). «Comparative study of thermally conductive fillers in underfill for the electronic components». Diamond and Related Materials 14 (10): 1647-1653. doi:10.1016/j.diamond.2005.05.008.
- ↑ Isberg, J (2004). «Single crystal diamond for electronic applications». Diamond and Related Materials 13 (2): 320-324. doi:10.1016/j.diamond.2003.10.017.
- ↑ Costello, M; Tossell, D; Reece, D; Brierley, C; Savage, J (1994). «Diamond protective coatings for optical components☆». Diamond and Related Materials 3 (8): 1137-1141. doi:10.1016/0925-9635(94)90108-2.
- ↑ Krauss, A (2001). «Ultrananocrystalline diamond thin films for MEMS and moving mechanical assembly devices». Diamond and Related Materials 10 (11): 1952-1961. doi:10.1016/S0925-9635(01)00385-5.
Bibliografía
[editar]- Jaeger, Richard C. (2002). «Film Deposition». Introduction to Microelectronic Fabrication (2nd edición). Upper Saddle River: Prentice Hall. ISBN 0-201-44494-1.
- Smith, Donald (1995). Thin-Film Deposition: Principles and Practice. MacGraw-Hill. ISBN 0-07-058502-4.
- Dobkin and Zuraw (2003). Principles of Chemical Vapor Deposition. Kluwer. ISBN 1-4020-1248-9.
- C. F. Powell, J. H. Oxley, J. M. Blocher Jr., J. Klerer: Vapor Deposition. In: Journal of The Electrochemical Society. 113, Nr. 10, 1966, S. 266C–269C, doi:10.1149/1.2423765.
- K. L. Choy: Chemical vapour deposition of coatings. In: Progress in Materials Science. 48, Nr. 2, 2003, S. 57–170, doi:10.1016/S0079-6425(01)00009-3.
- Hugh O. Pierson: Handbook of chemical vapor depostion (CVD): principles, technology, and applications. William Andrew, 1999, ISBN 978-0-8155-1432-9.
- M. Allendorf: From bunsen to VLSI: 150 years of growth in chemical vapor deposition technology. In: The Electrochemical Society interface. 7, Nr. 1, 1998, S. 36–39 (PDF-Datei; 131 kB)
- K. Okada "Plasma-enhanced chemical vapor deposition of nanocrystalline diamond" Sci. Technol. Adv. Mater. 8 (2007) 624 free-download review
- T. Liu, D. Raabe and S. Zaefferer "A 3D tomographic EBSD analysis of a CVD diamond thin film" Sci. Technol. Adv. Mater. 9 (2008) 035013 free-download
- Christoph Wild "CVD Diamond Properties and useful Formula" CVD Diamond Booklet (2008) PDF free-download
