Configuración electrónica
En química, la configuración electrónica indica la forma en la cual los electrones se estructuran u organizan en un átomo, de acuerdo con el modelo de capas electrónicas, que expresa a las funciones de onda del sistema como un producto de orbitales antisimetrizado.[1][2] La configuración electrónica es importante porque determina las propiedades totales de combinación química de los átomos, y por lo tanto, su posición en la tabla periódica de los elementos.
Introducción
[editar]El orden de los electrones en los átomos está sujeta a las reglas de la mecánica cuántica. En particular la configuración electrónica viene dada por una combinación de estados cuánticos que son solución de la ecuación de Schrödinger para dicho átomo.
Una de las restricciones de la mecánica cuántica no explícitamente metida en la ecuación de Schrödinger es que cualquier conjunto de electrones en un mismo estado cuántico deben cumplir el principio de exclusión de Pauli por ser fermiones (partículas de espín semientero). Dicho principio implica que la función de onda total que describe dicho conjunto de electrones debe ser antisimétrica respecto del intercambio de dos electrones.[3] Por lo tanto, en el momento en que un estado cuántico es ocupado por un electrón, el siguiente electrón debe ocupar un estado cuántico diferente.
En los estados estacionarios de un átomo, la función de onda de un electrón en una aproximación no-relativista se obtiene como la función propia de la ecuación de Schrödinger , donde es el hamiltoniano monoelectrónico correspondiente. Para el caso relativista hay que recurrir a la ecuación de Dirac. Las funciones propias mono-electrónicas obtenidas como solución de cualquiera de estas dos ecuaciones se denominan orbitales atómicos, por analogía con la imagen clásica de electrones orbitando alrededor del núcleo. Estos orbitales, en su expresión más básica, se pueden enumerar mediante cuatro números cuánticos: n, l, ml y ms. Obviamente, el principio de exclusión de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales (porque entonces ocuparían el mismo orbital y eso está excluido por el principio).
De acuerdo con la mecánica cuántica, los electrones pueden pasar de un orbital atómico a otro ya sea emitiendo o absorbiendo un cuanto de energía, en forma de fotón. Esta transición de un orbital a otro con diferentes energías explican diversos fenómenos de emisión y absorción de radiación electromagnética por parte de los átomos.
Notación
[editar]Para describir las configuraciones electrónicas de átomos y moléculas se utiliza una notación estándar. En el caso de los átomos, la notación contiene la definición de los orbitales atómicos en la forma n l (ejemplos: 1s, 2p, 3d, 4f), indicándose el número de electrones asignado a cada orbital, o al conjunto de orbitales de la misma subcapa electrónica, por medio de un superíndice. Por ejemplo, el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1 . Para el fósforo (número atómico 15), tenemos: 1s2 2s2 2p6 3s2 3p3. Para átomos con muchos electrones, esta notación puede ser muy larga por lo que se utiliza una notación abreviada, que tiene en cuenta que las primeras subcapas son iguales a las de algún gas noble. Por ejemplo, el fósforo, difiere del argón y neón (1s2 2s2 2p6) únicamente por la presencia de la tercera capa. Así, la configuración electrónica del fósforo se puede escribir respecto de la del neón como: [Ne] 3s2 3p3. Esta notación es útil si tenemos en cuenta que la mayor parte de las propiedades químicas de los elementos vienen determinadas por las capas más externas.
El orden en el que se escriben los orbitales viene dado por la estabilidad relativa de los orbitales, escribiéndose primero aquellos que tienen menor energía orbital. Esto significa que, aunque sigue unas pautas generales, se pueden producir excepciones. La mayor parte de los átomos siguen el orden dado por la regla de Madelung. Así, de acuerdo con esta regla, la configuración electrónica del hierro se escribe como: [Ar] 4s2 3d6. Otra posible notación agrupa primero los orbitales con el mismo número cuántico n, de tal manera que la configuración del hierro se expresa como [Ar] 3d6 4s2 (agrupando el orbital 3d con los 3s y 3p que están implícitos en la configuración del argón).
El superíndice 1 de los orbitales ocupados por un único electrón no es obligatorio.[4] Es bastante común ver las letras de los orbitales escritas en letra itálica o cursiva. Sin embargo, la Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda utilizar letra normal, tal y como se realiza aquí.
Origen histórico
[editar]Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos se podía explicar mediante la estructura electrónica del átomo.[5] Su propuesta se basó en su propio modelo atómico de Bohr, en el cual las capas electrónicas eran órbitas electrónicas ubicadas a distancias fijas del núcleo atómico. Las configuraciones originales de Bohr hoy parecen extrañas para el químico: al azufre se le asignaba una configuración 2.4.4.6 en vez de 1s2 2s2 2p6 3s2 3p4. Un año después, E. C. Stoner incorporó el tercer número cuántico de la teoría de Sommerfeld a la descripción de las capas electrónicas, y predijo correctamente la estructura de capas del azufre como 2.8.6.[6] Sin embargo, ni el sistema de Bohr ni el de Stoner podían describir correctamente los cambios del espectro atómico en un campo magnético (efecto Zeeman).
Distribución electrónica
[editar]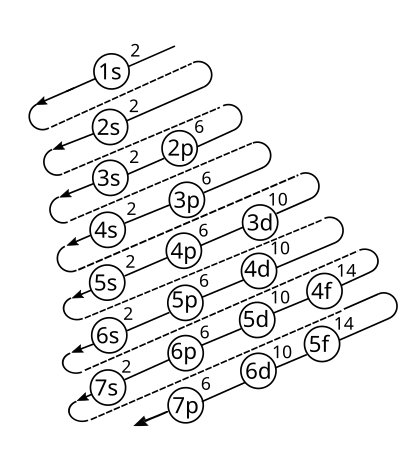
Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
Para comprender el diagrama de Moeller se utiliza la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
| k = 1 | 1s | |||
| l = 2 | 2s | 2p | ||
| m = 3 | 3s | 3p | 3d | |
| n = 4 | 4s | 4p | 4d | 4f |
| o = 5 | 5s | 5p | 5d | 5f |
| p = 6 | 6s | 6p | 6d | 6f |
| q = 7 | 7s | 7p | 7d | 7f |
Para encontrar la distribución electrónica, se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
| 1s | 2s | 2p 3s | 3p 4s | 3d 4p 5s | 4d 5p 6s | 4f 5d 6p 7s | 5f 6d 7p |
Este principio de construcción, o principio de Aufbau (del alemán Aufbau, 'construcción'), que fue una parte importante del concepto original de Bohr sobre la configuración electrónica, puede formularse como:[7] Cada orbital sólo puede ser ocupado por un máximo de dos electrones. Los orbitales se llenan en orden creciente de energía orbital: los de menor energía se llenan antes que los de mayor energía.
Entonces, es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de sus electrones. Un subnivel s se puede llenar con 1 o 2 electrones. Un subnivel p puede contener de 1 a 6 electrones; un subnivel d, de 1 a 10 electrones y un subnivel f, de 1 a 14 electrones. Los electrones se colocan primero en los subniveles de menor energía y cuando estos están completamente ocupados, se usa el siguiente subnivel con energía superior. Esto se puede representar por la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
| n = 1 | 2 | |||
| n = 2 | 2 | 6 | ||
| n = 3 | 2 | 6 | 10 | |
| n = 4 | 2 | 6 | 10 | 14 |
| n = 5 | 2 | 6 | 10 | 14 |
| n = 6 | 2 | 6 | 10 | |
| n = 7 | 2 | 6 |
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
| 1s2 | 2s2 | 2p6 3s2 | 3p6 4s2 | 3d10 4p6 5s2 | 4d10 5p6 6s2 | 4f14 5d10 6p6 7s2 | 5f14 6d10 7p6 |
Finalmente la configuración queda de la siguiente manera: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para determinar la configuración electrónica de un elemento, basta con calcular cuántos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando por los de menor energía, e ir llenando hasta que todos los electrones estén distribuidos. Un elemento químico tiene un electrón más que el elemento químico que lo precede (además de tener también el siguiente número atómico). El subnivel de energía aumenta de esta manera:
- Subnivel s, p, d o f: Aumenta el nivel de energía.
Sin embargo, existen excepciones, como ocurre en los elementos de transición (en los grupos del cromo y del cobre), en los que se promueve un electrón y se obtiene así una configuración fuera de lo común.
Estructura electrónica y tabla periódica de los elementos
[editar]Bloques de la tabla periódica de los elementos
[editar]La estructura de la tabla periódica de los elementos está íntimamente relacionada con la configuración electrónica de los átomos que la componen. Por ejemplo, todos los elementos del grupo 1 tienen una configuración electrónica representada por [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran semejanza en sus propiedades químicas. La capa electrónica más externa se denomina "capa de valencia" (en una primera aproximación) y determina las propiedades químicas. Conviene recordar que el hecho de que las propiedades químicas sean similares para los elementos de un grupo fue descubierto hace más de un siglo, antes incluso de aparecer la idea de configuración electrónica.[8] No está claro cómo explica la regla de Madelung (que más bien describe) la tabla periódica,[9] ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto. Por tanto las configuraciones electrónicas determinarán las propiedades de combinación química.
Principio de exclusión de Pauli
[editar]Esta regla dice que en un estado cuántico solo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2 y con proyecciones .
También que en una orientación deben caber dos electrones excepto cuando el número de electrones se ha acabado, por lo cual el orden que debe seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli, en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin. El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria. El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres. "Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos". Es sencillo derivar el principio de Pauli, basándonos en el artículo de partículas idénticas. Los fermiones de la misma especie forman sistemas con estados totalmente antisimétricos, lo que para el caso de dos partículas significa que:
mismo estado cuántico |ψ>, el estado del sistema completo es |ψψ>.
Regla del octeto
[editar]Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de espín +½ y otro de espín -½). Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece que el nivel electrónico se completa con 8 electrones, excepto el hidrógeno, que se completa con 2 electrones. Entonces, el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógeno (en el caso del agua, por ejemplo), cada uno de los cuales necesita 1 electrón (que recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno. De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima, cercana al 91%. Ejemplo de ello: 10Ne: 1s2, 2s2, 2p6 regla del octeto: 11Na:(Ne)10, 1s2, 2s2, 2p6, 3s1
Anomalías de configuración electrónica
[editar]Al desarrollar la configuración electrónica, encontramos una serie de excepciones. Por ejemplo, es más estable llenar dos medios orbitales que completar uno y dejar el otro a uno o dos electrones de estar completado a la mitad. Así, los metales del grupo 6 en vez de tener los orbitales externos completos y el orbital de un electrón de estar semi-completo, donarán un electrón del orbital , quedando ambos completos a la mitad: s1d5 en vez de s2d4. Igualmente, es más estable rellenar los orbitales d completamente, por lo que los elementos- del grupo 11 tenderán a adoptar la configuración s1d10 en vez de s2d9. Ejemplos de estas anomalías son:
Grupo VIB:
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 : es incorrecto.
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d5 : es correcto.
Grupo IB:
29Cu: 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s1 : es correcto.
ER: n + l
Donde:
n: nivel l: subnivel
Ejemplo:
4s: 4 + 0 : 4
3p: 3 + 1 : 4
4d: 4 + 2 : 6
5f: 5 + 3 : 8
6g: 6 + 4 : 10
7h: 7 + 5 : 12
Es importante mencionar que existen cambios en las configuraciones electrónicas de átomos restringidos espacialmente.
Orbital o REEMPE
[editar]En química se usa la expresión REEMPE para designar el valor esperado de un operador densidad de estados de dos electrones con . En otras palabras: la región donde existe mayor posibilidad de encontrar como máximo 2 electrones que se mueven en forma paralela y en sentidos contrarios. Su nombre proviene de Región de Espacio Energético de Manifestación Probabilística del Electrón.
Véase también
[editar]- Tabla periódica de los elementos
- Valencia (química)
- Electrón
- Número cuántico
- Orbital atómico
- Regla de Hund
- Principio de Aufbau
- Hibridación (química)
- Niels Bohr
- Linus Pauling
- Gases nobles
Referencias
[editar]- ↑ Unión Internacional de Química Pura y Aplicada. «configuration (electronic)». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Glosario de términos usados en fotoquímica, Universidad Autònoma de Barcelona, Servei de Publicacions, Bellaterra, 1999. pdf Archivado el 21 de septiembre de 2013 en Wayback Machine.
- ↑ Cohen-Tannoudji, Claude; Bernard Diu, Franck Laloë (1977). Quantum Mechanics. vol.1 (3.ª edición). París, Francia: Hermann. pp. 898. ISBN 0-471-16432-1.
- ↑ La forma completa de la notación de la configuración electrónica representa un producto matemático, de ahí que 3p1 sea igual que 3p.
- ↑ Niels Bohr (1923). «Über die Anwendung der Quantumtheorie auf den Atombau. I. Die Grundpostulate der Quantentheorie». Z. Phys. 13: 117.
- ↑ E.C. Stoner (1924). «The distribution of electrons among atomic levels». Phil. Mag. (6th Ser.) 48: 719-36.
- ↑ Unión Internacional de Química Pura y Aplicada. «aufbau principle». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ La semejanza en las propiedades químicas y la relación numérica existente entre el peso atómico del calcio, estroncio y bario fue indicada por Johann Wolfgang Döbereiner en 1817.
- ↑ Scerri, Eric R. (1998). «How Good Is the Quantum Mechanical Explanation of the Periodic System?». J. Chem. Ed. 75 (11): 1384-85. Ostrovsky, V. N. (2005). «On Recent Discussion Concerning Quantum Justification of the Periodic Table of the Elements». Foundations of Chemistry 7 (3): 235-39. ISSN 1386-4238. doi:10.1007/s10698-005-2141-y. Abstract.
Bibliografía
[editar]- de la Peña Auerbach, Luis Fernando (2006) [1979]. Introducción a la mecánica cuántica. Texto Científico Universitario (3ª edición). México: Fondo de Cultura Económica (publicado el 1991). ISBN 9786071601766.
- Galindo, A. y Pascual P.: Mecánica cuántica, Ed. Eudema, Barcelona, 1989, ISBN 84-7754-042-X.





