Estructura de Lewis

La estructura de Lewis,[1] también llamada diagrama de punto y raya diagonal, modelo de Lewis, diagrama de valencia, diagrama de Lewis o regla de octeto es una representación gráfica que muestra los pares de electrones en guiones o puntos de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.[2] Son representaciones bidimensionales sencillas de la conectividad de los átomos en las moléculas; así como de la posición de los electrones enlazantes y no enlazantes. En esta fórmula se muestran enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente indicando la ordenación de los átomos en el espacio.
Esta representación se usa para saber la cantidad de electrones de valencia que puedan existir en un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples los cuales se encuentran íntimamente relacionados con la geometría molecular.
En las estructuras de Lewis se arreglan los átomos de manera que tengan una configuración de gas noble (ocho electrones para los elementos del segundo período de la tabla periódica específicamente para los pertenecientes a los grupos principales y un par de electrones para el hidrógeno).[3][4] Muestran los diferentes átomos usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones no enlazantes o par solitario de electrones (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y deben colocarse siempre alrededor de los átomos a los que pertenece.
Este modelo fue propuesto por Gilbert Newton Lewis, quien lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
Moléculas
[editar]
Para representar las moléculas mediante diagrama de Lewis, se debe presentar un átomo central, en algunos casos el átomo central es el carbono debido a que es el elemento más electropositivo, luego este queda rodeado por los demás átomos que constituyen la molécula. En moléculas compuestas por varios átomos de un mismo elemento y un átomo de otro elemento distinto, este último se utiliza como el átomo central, lo cual se representa en el diagrama con 4 átomos de hidrógeno y uno de silicio. El átomo central en lo posible debe ser el menos electronegativo y el hidrógeno siempre será un átomo terminal.
En cualquier caso, los átomos suelen seguir las siguientes generalidades:[5]
- Se diferencian dos tipos de átomos, los centrales y los terminales. Los primeros se enlazan generalmente con varios del segundo grupo.
- Los átomos de hidrógeno, dada su configuración electrónica particular, actúan como átomos terminales siempre, ya que sólo pueden enlazarse a un átomo.
- Los elementos como el carbono son átomos centrales en la gran mayoría de los casos.
- El oxígeno actúa casi siempre como átomo terminal con excepciones como el caso del o en los grupos .
- Los halógenos generalmente son átomos terminales exceptuando algunos casos
- Generalmente los átomos menos electronegativos son los que hacen de átomos centrales y los más electronegativos hacen de átomos terminales.
En algunos casos es difícil determinar el átomo central, en general cuando todos los átomos de los elementos del compuesto aparecen más de una o dos veces.
Electrones de valencia
[editar]El número total de electrones representados en un diagrama de Lewis es igual a la suma de los electrones de valencia de cada átomo. La valencia que se toma como referencia y que se representa en el diagrama es la cantidad de electrones que se encuentran en el último nivel de energía de cada elemento al hacer su configuración electrónica.[6]
Cuando los electrones de valencia han sido determinados, deben ubicarse en el modelo a estructurar. Una vez que todos los pares solitarios han sido ubicados, los átomos, especialmente los centrales, pueden no cumplir con la regla del octeto. Los átomos entre sí deben quedar unidos por enlaces; un par de electrones forma un enlace entre dos átomos. Así como el par del enlace es compartido entre dos átomos, el átomo que originalmente tenía el par solitario sigue teniendo un octeto.
Fuera de los compuestos orgánicos, solo un porcentaje menor de los compuestos tiene un octeto de electrones en su última capa. Compuestos con más de ocho electrones en la representación de la estructura de Lewis de la última capa del átomo, son llamados hipervalentes, y son comunes en los elementos de los grupos 15 al 18, tales como el fósforo, azufre, yodo y xenón.
La teoría de Lewis se refiere principalmente al enlace covalente, el cual se forma por compartición de electrones pero también se puede aplicar a compuestos iónicos, en los cuales hay transferencia de electrones de un átomo a otro. Cuando se escribe la estructura de Lewis de un ion, la estructura entera se encierra entre corchetes, y la carga se escribe como un exponente en la esquina superior derecha, fuera de los corchetes. Primero se escribe el catión y luego el anión y a este último se le colocan los electrones como puntos que representan el octeto.[4]
La regla del octeto
[editar]
La regla del octeto, establece que los átomos se enlazan unos a otros en el intento de completar su capa de valencia (última capa de la configuración electrónica). La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, es decir, el átomo queda estable cuando presenta en su capa de valencia 8 electrones (Configuración de gas noble). Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar, perder o compartir electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia. Por ejemplo los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto, presentando enlaces simples y dobles.
Considerando que cada enlace covalente simple aporta dos electrones a cada átomo de la unión, al dibujar un diagrama o estructura de Lewis, hay que evitar asignar más de ocho electrones a cada átomo.
Excepciones a la regla del Octeto
[editar]El hidrógeno tiene un solo orbital en su capa de valencia lo que permite que puede aceptar como máximo dos electrones. Algunas veces se piensa que los átomos que forman cationes no siempre completan su octeto, y se utilizan como ejemplos de "excepciones" a dicha regla. Sin embargo, puesto que pierden los electrones de la capa externa, el nivel interno es el que queda "completo". Estos átomos, en vez de quedar con la configuración electrónica del siguiente gas noble, quedan con la configuración del gas noble anterior.
Por ejemplo, la configuración del sodio es 1s2 2s2 2p6 3s1, es decir [Ne] 3s1. Al perder su último electrón de valencia, queda con la configuración del Neón y así se puede explicar la existencia de la sal común (NaCl) la cual se forma porque el sodio pierde un electrón y queda con la estructura electrónica del Neón y el cloro cuya configuración electrónica es 1s2 2s2 2p6 3s23p5 es decir, [Ne] 3s23p5 al aceptar el electrón que cede el sodio queda con la configuración del gas argón 1s2 2s2 2p6 3s23p6.
Otro ejemplo es el Aluminio, cuya configuración es [Ne] 3s2 3p1 . Al quedar como Al3+, su configuración electrónica sería la del gas noble anterior, el neón. En este caso se puede explicar la existencia del tricloruro de aluminio AlCl3 .Como puede verse, en los dos compuestos citados se cumple la regla del octeto para cada especie, en la cual un átomo pierde electrones y el otro los acepta, generándose de esta manera enlaces iónicos. Para los compuestos covalentes como es el caso del metano el C comparte cuatro electrones uno con cada hidrógeno formándose cuatro enlaces covalentes.
Por otra parte, los átomos no metálicos a partir del tercer período (Fósforo y Azufre)[7] pueden formar "octetos expandidos" es decir, pueden contener más que ocho electrones en su capa de valencia, por lo general colocando los electrones extra en subniveles.
Carga formal
[editar]En términos de las estructuras de Lewis en general, la carga formal de un átomo puede ser calculada usando la siguiente fórmula, las definiciones no estándar asumidas para el margen de beneficio utilizaron:
- .
Donde:
- Cf es la carga formal.
- Nv representa el número de electrones de valencia en un átomo libre.
- Ue representa el número de electrones no enlazados.
- Bn representa el número total de electrones de enlace, esto dividido entre dos.
La carga formal del átomo es calculada como la diferencia de carga eléctrica entre los electrones de valencia de un átomo aislado y el número de electrones asignados a ese átomo en la estructura de Lewis. El total de las cargas formales en una molécula neutra debe ser igual a cero y la de un ion debe ser igual a la carga del ion.
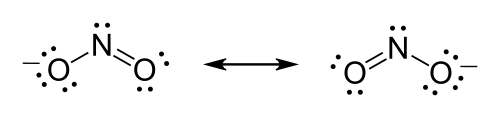
Ejemplo: Estructura de Lewis para el ion nitrito
[editar]La fórmula del ion nitrito es:
- Paso uno: Escoger el átomo central. Existe sólo un único átomo de nitrógeno, y es el átomo más electropositivo,[8] por lo que este se convertirá en nuestro átomo central.
- Paso dos: Contar los electrones de valencia. El nitrógeno posee 5 electrones de valencia; cada oxígeno posee 6, para un total de (6 × 2) + 5 = 17. El ion posee una carga de –1, lo que nos indica un electrón extra, por lo que el número total de electrones es de 18.
- Paso tres: Ubicar los pares electrónicos y cumplir la regla del octeto. Cada oxígeno debe ser enlazado al nitrógeno. Se buscan los electrones necesarios para el cumplimiento de la regla del octeto; como los tres átomos deben cumplir con dicha regla el número total sería 3 x 8= 24 electrones que se necesitan para cumplir con el octeto. De acuerdo a los cálculos anteriores el número de electrones enlazantes serían 24 - 18 = 6 que corresponden a tres pares, tal cual como se representa abajo.
- Paso cuatro: Electrones no enlazantes. Para ubicar los electrones no enlazantes simplemente se realiza una diferencia entre los electrones de valencia totales y los enlazantes: 18 - 6 = 12 electrones que corresponden a 6 pares, los cuales se ubican bajo la premisa del cumplimiento de la regla del octeto. (Ver figura). Ambos átomos de oxígeno poseen 8 electrones asignados a ellos. El átomo de nitrógeno posee 6 electrones asignados y un par no enlazante.
- Paso cinco: Carga formal. De acuerdo a la fórmula de carga formal: para el caso del N la carga formal sería cero, para el O que queda enlazado por un enlace simple sería (-1) y para el otro O sería cero, por lo que la carga formal total sería (-1). Por último se colocan los corchetes alrededor de cada estructura, y se escribe la carga ( - ) en el rincón superior derecho fuera de los corchetes. En este caso es posible dibujar dos estructuras en las cuales solo se han movido electrones pi, estas dos estructuras se les denomina estructuras de resonancia.
Véase también
[editar]- Gilbert N. Lewis
- Átomo
- Par de electrones
- Regla del octeto
- Electrones de valencia
- Moléculas
- Valencia (química)
- Tabla periódica de los elementos
Referencias
[editar]- ↑ «Estructura de Lewis».
- ↑ Society, American Chemical (2005). Química, un proyecto de la A.C.S.. Reverte. ISBN 9788429170016. Consultado el 27 de septiembre de 2019.
- ↑ L.G.Wade (2012). «1». En Gabriela López Ballesteros, ed. Química Orgánica. Pearson Education. ISBN 978-607-32-0790-4.
- ↑ a b Petrucci, R; Harwood,W; Herring,F (2003). «11». En Isabel Capella, ed. Química General. Pearson Education. ISBN 84-205-3533-8.
- ↑ «▷ ESTRUCTURAS de LEWIS». Química Inorgánica. 18 de junio de 2019. Archivado desde el original el 3 de agosto de 2019. Consultado el 3 de agosto de 2019.
- ↑ Chang,R; College, W (2002). «7». Química. Mc Graw-Hill. ISBN 970-10-3894-0.
- ↑ «Tabla periódica».
- ↑ Gispert, Jaime Casabó (1996). Estructura atómica y enlace químico. Reverte. ISBN 9788429171891. Consultado el 18 de octubre de 2019.
Enlaces externos
[editar]- Estructura de Lewis y problemas
- Ejercicios resueltos de Estructuras de Lewis Archivado el 3 de agosto de 2019 en Wayback Machine.



![{\displaystyle C_{f}=N_{v}-[U_{e}+{\frac {B_{n}}{2}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4baa369f5726d1e0d5691834a9ca248e2468e83)
