Gran Oxidación

La Gran Oxidación (GOE por sus siglas en inglés, también llamado Catástrofe de Oxígeno, Crisis de Oxígeno, Holocausto de Oxígeno o Revolución de Oxígeno) fue un cambio medioambiental muy importante que ocurrió probablemente sobre el período Sidérico al comienzo del Paleoproterozoico, hace alrededor de 2400 millones de años.[2]
Los primeros organismos fotosintéticos realizaban la fotosíntesis anoxigénica, en la cual no se desprende dioxígeno, tal como hacen en la actualidad las bacterias verdes del azufre y no del azufre, y las bacterias púrpura. Cuando surgieron los primeros organismos capaces de realizar la fotosíntesis oxigénica (las cianobacterias) hace unos 2800 millones de años, se empezó a producir oxígeno molecular (O2) en grandes cantidades.[3] La emisión de dioxígeno (O2) al medio ambiente finalmente provocó una crisis ecológica (extinción masiva) para la biodiversidad de la época, pues el dioxígeno es tóxico para los microorganismos anaerobios dominantes entonces.[4]

Otra consecuencia importante fueron los cambios climáticos subsiguientes. Un pico de cromo contenido en antiguos depósitos de roca formados bajo el agua demuestra que se había acumulado cromo lavado de las plataformas continentales. El cromo no se disuelve fácilmente y su liberación de las rocas habría requerido la presencia de un ácido potente. Uno de estos ácidos, ácido sulfúrico, podría haber sido creado a través de reacciones bacterianas con pirita.[5] Las esteras de cianobacterias productoras de oxígeno pueden producir una capa delgada, de uno o dos milímetros de espesor de agua oxigenada en un ambiente anóxico, incluso bajo hielo espeso y antes de que el oxígeno empiece a acumularse en la atmósfera, estos organismos ya estarían adaptados al oxígeno.[6] Además la generación de metano (CH4) atmosférico se debía en buena parte a los organismos anaerobios, los cuales sufrieron descensos poblacionales debido al aumento del oxígeno molecular atmosférico. Por otro lado, el metano frente al oxígeno molecular y radiación ultravioleta, se oxida rápidamente, generando dióxido de carbono (CO2). Este cambio de CH4 a CO2 en la atmósfera reduciría de forma considerable la temperatura global, ya que el potencial de efecto invernadero del metano es varias veces mayor que el del dióxido de carbono. Este descenso drástico de temperatura desencadenaría la glaciación Huroniana, ocurrida hace 2400 millones de años aproximadamente.[7]
Sin embargo, esta drástica transformación también ofreció una nueva oportunidad para la diversificación biológica, así como enormes cambios en la naturaleza de las interacciones químicas entre las rocas, arena, arcilla y de otros sustratos geológicos, y la atmósfera, los océanos y otras aguas superficiales. A pesar del reciclado natural de la materia orgánica, la vida se había mantenido energéticamente limitada hasta la amplia disponibilidad de dioxígeno. Este avance en la evolución del metabolismo aumentó en gran medida el suministro de energía para los organismos vivos, produciendo un impacto ambiental global.
Temporalidad
[editar]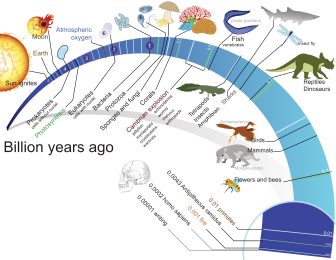
La cronología más aceptada de la Gran Oxigenación sugiere que el oxígeno libre fue producido primero por los organismos procariotas y luego eucariotas posteriores que llevaron a cabo la fotosíntesis oxigenada más eficientemente. El exceso de oxígeno que estos organismos producen es un producto de desecho. Estos organismos vivieron mucho antes del GOE,[8] quizás hace ya 3500 millones de años.
Inicialmente, el oxígeno que produjeron habría sido rápidamente eliminado de la atmósfera por el desgaste químico de los minerales reductores (los que se pueden oxidar), sobre todo el hierro. Esta "oxidación en masa" condujo a la deposición de óxido de hierro (III) en apariencia de formaciones de hierro en bandas como los sedimentos en Minnesota y Pilbara, Australia Occidental.
El oxígeno sólo comenzó a persistir en la atmósfera en pequeñas cantidades (~ 50 millones de años) antes del comienzo del GOE.[9] Sin un sumidero mineral en forma de hierro, el oxígeno podría haberse acumulado muy rápidamente. Por ejemplo, a las tasas actuales de fotosíntesis (que son mucho mayores que aquellas en el Precámbrico sin plantas terrestres), los niveles modernos de O2 atmosférico podrían producirse en alrededor de 2000 años.[10] Otra hipótesis es que los productores de oxígeno no evolucionaron hasta justo antes del mayor aumento de la concentración atmosférica de oxígeno.[11] Esto se basa en la interpretación del supuesto indicador de oxígeno, fraccionamiento independiente de masa de isótopos de azufre, utilizado en estudios previos. esta hipótesis eliminaría la necesidad de explicar un retraso en el tiempo entre la evolución de los microorganismos oxifotosintéticos y el aumento del oxígeno libre.
De cualquier manera, el oxígeno eventualmente se acumuló en la atmósfera, con dos consecuencias principales: Primero, oxidó el metano atmosférico (un fuerte gas de efecto invernadero) al dióxido de carbono (uno más débil) y el agua, provocando la glaciación Huroniana, de hace 2400 a 2100 millones de años. Este último puede haber sido un episodio glacial completo, y posiblemente el más largo de la historia, causando un efecto “planeta bola de nieve” que duró 300-400 millones de años.[11][12] En segundo lugar, el aumento de las concentraciones de oxígeno proporcionó una nueva oportunidad para la diversificación biológica, así como grandes cambios en la naturaleza de las interacciones químicas entre las rocas, arena, arcilla y otros sustratos geológicos y el aire de la Tierra, los océanos y otras aguas superficiales.
A pesar del reciclaje natural de la materia orgánica, la vida se había mantenido enérgicamente limitada hasta la disponibilidad generalizada de oxígeno. Este avance en la evolución metabólica aumentó mucho el suministro de energía libre a los organismos vivos, teniendo un impacto ambiental verdaderamente global; las mitocondrias evolucionaron después del GOE. Con más energía disponible del oxígeno, los organismos tenían los medios para desarrollar morfologías más complejas; estas nuevas morfologías a su vez ayudaron a impulsar la evolución a través de la interacción entre los organismos.[13]

Desfase temporal
[editar]
Hubo un retraso de alrededor de 300 millones de años desde el momento en el que los organismos fotosintéticos comenzaron la producción de oxígeno (hace 2800 millones de años) y el momento de la catástrofe del oxígeno cuando se produjo un rápido aumento del oxígeno atmosférico (2450 millones de años). Un fenómeno que explica este desfase es que el aumento de oxígeno tuvo que esperar a cambios tectónicos en la "anatomía" de la Tierra, incluida la aparición de las plataformas marinas en las que los compuestos orgánicos de carbono reducidos pudiesen llegar a los sedimentos y ser enterrados.[14]
A continuación, el oxígeno recién producido se consumió en diversas reacciones químicas en los océanos, principalmente con hierro. La prueba de este fenómeno se encuentra en las antiguas rocas que contienen enormes formaciones de hierro bandeado procedentes de la oxidación del hierro presente en el océano y que en la actualidad constituyen los principales yacimientos de hierro explotados comercialmente. Pero estos fenómenos químicos no explican completamente la demora en la acumulación del oxígeno en la atmósfera.
El metano atmosférico, abundante en la época debido a la dominancia de organismos anaerobios, también fue una trampa importante para el oxígeno molecular, ya que se oxida rápidamente a dióxido de carbono en presencia de la radiación ultravioleta.
Una teoría reciente (2006) es la de la bioestabilidad, que pretende explicar los 300 millones de años de retraso mediante un modelo matemático de la atmósfera que reconoce que la protección contra la radiación ultravioleta disminuye la tasa de oxidación de metano, una vez que los niveles de oxígeno son suficientes para formar una capa de ozono. Esta explicación propone un sistema con dos estados estables, uno con un menor (0,02 %) contenido de oxígeno atmosférico, y otro con mayor (21 % o más). La Gran Oxidación puede entenderse entonces como un interruptor entre los estados estables inferior y superior.[15]
Otro factor que puede explicar el retraso en el enriquecimiento de oxígeno de la atmósfera puede haber sido debido a la producción fotosintética de hidrógeno molecular que primero se almacenó en la atmósfera antes de perderse lentamente en el espacio.
Evolución tardía de la teoría de la oxi-fotosíntesis
[editar]Existe la posibilidad de que el indicador de oxígeno haya sido mal interpretado. Durante el tiempo propuesto del retraso en la teoría del gas hidrógeno, hubo un cambio de azufre fraccionado en masa (MIF) a azufre fraccionado en función de la masa (MDF) en sedimentos. Esto se suponía que era un resultado de la aparición de oxígeno en la atmósfera (ya que el oxígeno habría impedido la fotólisis del dióxido de azufre, que causa MIF). Este cambio de MIF a MDF de isótopos de azufre también puede haber sido causado por un aumento en el desgaste glacial o la homogeneización del de azufre marino como resultado de un aumento del gradiente térmico durante el período de glaciación Huroniana.
Papel en la diversificación de minerales
[editar]La Gran Oxidación desencadenó un crecimiento explosivo en la diversidad de minerales en la Tierra. Esto significaba ahora que muchos elementos podrían ocurrir en una o más formas oxidadas en el entorno cercano a la superficie.[16] Se estima que la Gran Oxidación fue la responsable directa de más de 2500 nuevos minerales del total de unos 5400 minerales encontrados en la Tierra.[17] La mayoría de estos nuevos minerales se formaron después del evento de la Gran Oxidación como formas hidratadas y oxidadas debido a los procesos dinámicos del manto y de la corteza.[18]
Referencias
[editar]- ↑ H.D. Holland (2006), The oxygenation of the atmosphere and oceans, Philosophical Transactions of The Royal Society B, Vol. 361, No. 1470, pp. 903-915, DOI 10.1098/rstb.2006.1838.
- ↑ Zimmer, Carl (2013). "Earth's Oxygen: A Mystery Easy to Take for Granted". The New York Times. Recuperado el 3 de Octubre, 2013.
- ↑ T. Cavalier-Smith, M. Brasier y M. Embley (2006), Introduction: how and when did microbes change the world?, Philos Trans R Soc Lond B Biol Sci, 361(1470): 845–850, doi: 10.1098/rstb.2006.1847.
- ↑ Roger Y. Stanier et al 1992, Microbiología. Ed. Reverté
- ↑ "Evidence of Earliest Oxygen-Breathing Life on Land Discovered". LiveScience.com. Recuperado en 04/06/2016..
- ↑ Oxygen oasis in Antarctic lake reflects Earth in distant past.
- ↑ Frei, R.; Gaucher, C.; Poulton, S. W.; Canfield, D. E. (2009). "Fluctuations in Precambrian atmospheric oxygenation recorded by chromium isotopes". Nature. 461 (7261): 250–253. Bibcode:2009Natur.461..250F. doi:10.1038/nature08266. PMID 19741707. Lay summary.
- ↑ Dutkiewicz, A.; Volk, H.; George, S. C.; Ridley, J.; Buick, R. (2006). "Biomarkers from Huronian oil-bearing fluid inclusions: an uncontaminated record of life before the Great Oxidation Event". Geology. 34 (6): 437. Bibcode:2006Geo....34..437D. doi:10.1130/G22360.1.
- ↑ Anbar, A.; Duan, Y.; Lyons, T.; Arnold, G.; Kendall, B.; Creaser, R.; Kaufman, A.; Gordon, G.; Scott, C.; Garvin, J.; Buick, R. (2007). "A whiff of oxygen before the great oxidation event?". Science. 317 (5846): 1903–1906. Bibcode:2007Sci...317.1903A. doi:10.1126/science.1140325. PMID 17901330.
- ↑ Dole, M. (1965). "The Natural History of Oxygen". The Journal of General Physiology. 49 (1): Suppl:Supp5–27. doi:10.1085/jgp.49.1.5. PMC 2195461. PMID 5859927.
- ↑ a b Robert E. Kopp; Joseph L. Kirschvink; Isaac A. Hilburn; Cody Z. Nash (2005). "The Paleoproterozoic snowball Earth: A climate disaster triggered by the evolution of oxygenic photosynthesis". Proceedings of the National Academy of Sciences of the United States of America. 102 (32): 11131–6. Bibcode:2005PNAS..10211131K. doi:10.1073/pnas.0504878102. PMC 1183582. PMID 16061801.
- ↑ First breath: Earth's billion-year struggle for oxygen New Scientist, #2746, 5 February 2010 by Nick Lane. A snowball period, which lasted from about 2.4 ya to about 2.0 ya, triggered by the Oxygen catastrophe
- ↑ Sperling, Erik; Frieder, Christina; Raman, Akkur; Girguis, Peter; Levin, Lisa; Knoll, Andrew (Aug 2013). "Oxygen, ecology, and the Cambrian radiation of animals". Proceedings of the National Academy of Sciences of the United States of America. 110: 13446–13451. doi:10.1073/pnas.1312778110. PMID 23898193. Recuperado en Octubre 2014.
- ↑ Lenton, T. M.; H. J. Schellnhuber, E. Szathmáry (2004). «Climbing the co-evolution ladder». Nature 431: 913. doi:10.1038/431913a.
- ↑ Goldblatt, C.; T.M. Lenton; A.J. Watson (2006). «The Great Oxidation at 2.4 Ga as a bistability in atmospheric oxygen due to UV shielding by ozone». Geophysical Research Abstracts 8: 00770.
- ↑ Sverjensky, Dimitri A.; Lee, Namhey (2010-02-01). "The Great Oxidation Event and Mineral Diversification". Elements. 6 (1): 31–36. doi:10.2113/gselements.6.1.31. ISSN 1811-5209.
- ↑ En 2008, los minerales conocidos eran 4300, pero en noviembre de 2018 había 5413 especies minerales oficialmente reconocidas por la Asociación Internacional de Mineralogía. Pasero, Marco (November 2018). «The New IMA List of Minerals – A Work in Progress – Updated: November 2018». The New IMA List of Minerals. IMA – CNMNC (Commission on New Minerals Nomenclature and Classification). Archivado desde el original el 5 de marzo de 2017. Consultado el 6 de febrero de 2019.
- ↑ "Evolution of Minerals", Scientific American, Marzo 2010
