Isomería
La isomería es una propiedad de aquellos compuestos químicos (en especial, las cadenas de carbono) que tienen la misma fórmula molecular (fórmula química no desarrollada) de iguales proporciones relativas de los átomos que conforman su molécula, pero presentan estructuras químicas distintas y, por ende, diferentes propiedades y configuración. Dichos compuestos reciben la denominación de isómeros. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
De hecho, una de las primeras cosas que un químico ha de hacer cuando quiere resolver la estructura completa de una nueva especie molecular es determinar los elementos químicos que forman parte de su composición y la proporción relativa en la que se encuentran.[1]
Después deberá dilucidar el peso molecular de la nueva sustancia química y, con todos estos datos, calcular la fórmula molecular, es decir, el número de átomos de cada elemento presentes en la molécula principal del hidrocarburo.[2]
Llegado a este punto, deberán centrar las investigaciones en determinar la manera en la que los átomos están conectados entre sí en la molécula bajo estudio y cómo estos átomos se ordenan en el espacio, momento en el cual entra en juego la isomería, ya que por lo general se abrirán numerosas posibilidades de sustancias con la misma fórmula molecular, todas ellas se conocen por el nombre genérico de isómeros.[3]
Aunque este fenómeno es muy frecuente en química orgánica, no es exclusiva de esta pues también la presentan algunos compuestos inorgánicos.
Historia
[editar]La isomería se observó por primera vez en 1827: Friedrich Wöhler preparó cianato de plata (AgOCN) y notó que, a pesar de que su composición elemental era idéntica a la del fulminato de plata (preparado por Justus von Liebig el año anterior),[4] sus propiedades eran muy diferentes. Este hallazgo desafiaba la comprensión química predominante de la época, que sostenía que los compuestos químicos podían ser diferentes sólo cuando tenían diferentes composiciones elementales. Después de más descubrimientos del mismo tipo, como el descubrimiento de 1828 de Wöhler de que la urea tenía la misma estructura atómica que el químicamente distinto cianato de amonio, Jöns Jakob Berzelius introdujo el término isomerismo en 1830 para describir este fenómeno.[5]
En 1848, Louis Pasteur separó diminutos cristales de ácido tartárico en sus dos formas especulares.[6][7] Las moléculas individuales de cada uno eran los estereoisómeros ópticos de izquierda y derecha, cuyas soluciones hacían girar el plano de luz polarizada en un mismo grado, pero en direcciones opuestas.
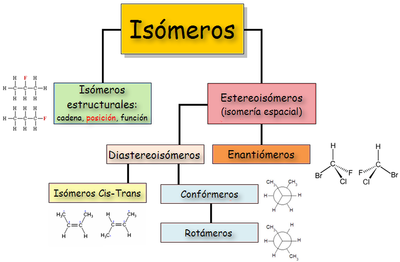
Tipos de isomería
[editar]Existen dos tipos básicos de isomería: estructural y espacial.[8]
Isomería constitucional o estructural
[editar]Es una forma de isomería, donde los compuestos con la misma fórmula molecular tienen una diferente distribución de los enlaces entre sus átomos, al contrario de lo que ocurre en la estereoisomería.
Debido a esto se pueden presentar tres diferentes modos de isomería:
- Isomería de cadena / esqueleto.- Los isómeros de este tipo tienen componentes de la cadena acomodados en diferentes lugares, es decir las cadenas carbonadas son diferentes, presentan distinto esqueleto o estructura.
Un ejemplo es el pentano, del cual existen varios isómeros, pero los más conocidos son el isopentano y el neopentano.
- Isomería de posición.- Es la de aquellos compuestos en los que sus grupos funcionales están unidos en diferentes posiciones.
Un ejemplo simple de este tipo de isomería es la del pentanol, donde existen tres isómeros de posición: 1-pentanol, 2-pentanol y 3-pentanol.
- Isomería de grupo funcional.- Aquí, la diferente conectividad de los átomos, puede generar diferentes grupos funcionales en la cadena. Un ejemplo es el ciclohexano y el 1-hexeno, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico o cicloalcano y el 1-hexeno es un alqueno.
Hay varios ejemplos de isomería como la de ionización, coordinación, enlace, geometría y óptica.
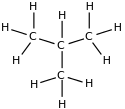
Isomería de cadena u ordenación
[editar]Varía la disposición de los átomos de carbono en la cadena o esqueleto carbonado, es decir la estructura de este, que puede llegar a ser lineal o bien tener distintas ramificaciones depende de su largo.
Por ejemplo el C4H10 corresponde tanto al butano como al metilpropano (isobutano o terc-butano):

|
|
|---|---|
| Butano n-butano |
Metilpropano iso-butano o terc-butano |
Para la fórmula C5H12, tenemos tres posibles isómeros de cadena: pentano, metilbutano (isopentano) y dimetilpropano (neopentano). El número de isómeros de cadena crece rápidamente al aumentar el número de átomos de carbono.
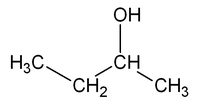
Isomería de posición
[editar]La presentan aquellos compuestos que poseen el mismo esqueleto carbonado pero en los que el grupo funcional ocupa diferente posición.
Por ejemplo, la fórmula molecular C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH: el 1-butanol.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| 1-butanol, butan-1-ol o n-butanol | 2-butanol, butan-2-ol o sec-butanol |
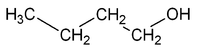
|
|
Este tipo de isomería resulta de la posibilidad de colocar grupos funcionales, cadenas laterales en posiciones estructuralmente no equivalentes. Supongamos que sustituimos uno de los átomos de hidrógeno del butano, CH3-CH2-CH2-CH3, por un grupo hidroxilo. Numerando los carbonos de la cadena del butano y realizando esta sustitución en el carbono extremo (C1), obtenemos un alcohol llamado butan-1-ol (1-butanol). Si sustituimos un hidrógeno del C2 por el grupo -OH, obtenemos el alcohol isómero butan-2-ol (2-butanol), que difiere en la posición del grupo hidroxilo. Obsérvese que, sin embargo, si realizamos la sustitución en el C3, no obtenemos un tercer isómero, sino de nuevo el 2-butanol. Las dos representaciones que se indican para el 2-butanol son estructuralmente idénticas, como se puede ver girando su estructura 180° alrededor de un eje.
Isomería de compensación o por compensación
[editar]A veces se llama isomería de compensación o metamería la de aquellos compuestos en los cuales una función corta la cadena carbonada en porciones de longitudes diferentes.[9]
Por ejemplo dos metámeros de fórmula molecular C4O2H8 son:
| HCOO-CH2-CH2-CH3 | CH3-COO-CH2-CH3 |
|---|---|
| Metanoato de propilo | Etanoato de etilo |
Este tipo de isomería era más usado en el pasado que en la actualidad. Se aplicaba incluso a aldehídos-cetonas,[10] a los que hoy se suelen considerar isómeros de función.
Isomería funcional
[editar]Varía el grupo funcional, conservando el esqueleto carbonado.
Por ejemplo el C3H6O puede corresponder a la molécula de propanal (función aldehído) o a la propanona (función cetona).
| CH3-CH2-CHO | CH3-CO-CH3. |
|---|---|
| Propanal (función aldehído) | Propanona (función cetona) |
Esta isomería la presentan ciertos grupos de compuestos relacionados como: los Alquenos y Cicloalcanos, los Alquinos, Cicloalquenos y alcadienos, los alcoholes y éteres, los ácidos y ésteres, y también los aldehídos y cetonas.
Tautomería
[editar]Es un tipo especial de isomería en la que existe transposición de un átomo entre las dos estructuras, generalmente hidrógeno, existiendo además un fácil equilibrio entre ambas formas tautómeras.[11]
Un ejemplo de la misma es la tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.

|
|---|
| Tautomería ceto-enólica. |
Isomería espacial o estereoisomería
[editar]Presentan estereoisomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta, o sea, difieren en la orientación espacial de sus átomos.
Los estereoisómeros tienen igual forma si se representan en un plano. Es necesario representarlos en el espacio para visualizar las diferencias. Pueden ser de dos tipos: isomería conformacional e isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples o no.
Otra clasificación los divide en enantiómeros y diastereoisómeros. Entre los diastereoisómeros se encuentran los isómeros cis-trans (antes conocido como isómeros geométricos), los confórmeros o isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros.
Isomería conformacional
[editar]Este tipo de isómeros conformacionales[12] o confórmeros, la conversión de una forma en otra es posible pues la rotación en torno al eje del enlace formado por los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre de rotámeros.
Los isómeros conformacionales generalmente no son separables o aislables, debido a la facilidad de interconversión aún a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que sí son aislables (la mayoría son derivados del bifenilo) se llama atropisomería.
Estas formas se reconocen bien si se utiliza la proyección de Newman, como se aprecia en los dibujos de la izquierda. Reciben nombres como sinclinal (a veces, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.[12]
Otro tipo de isómeros conformacionales se da en compuestos con anillos hexagonales como el ciclohexano, donde son factibles la conformación en forma de silla y conformación en forma de bote.
Isomería configuracional
[editar]No basta una simple rotación para convertir una forma en otra y aunque la disposición espacial sea la misma, los isómeros no son interconvertibles. Se divide en: isomería geométrica o cis-trans, e isomería óptica. Los isómeros configuracionales son aislables, ya que es necesaria una gran cantidad de energía para interconvertirlos (se requiere energía necesaria para la ruptura de enlaces).
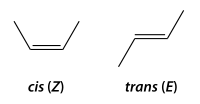
Isomería geométrica o cis-trans
[editar]La isometría cis-trans es un tipo de estereoisomería, la cual se refiere a los compuestos que tienen sus átomos conectados en el mismo orden pero tienen diferente orientación tridimensional. Este tipo de isomería presenta en cicloalcanos (serie de carbonos que conforman un anillo) y en alquenos (cadena de carbonos unidos por una doble ligadura). Se produce cuando existen dos grupos idénticos para comparar y se encuentran en diferentes posiciones.[13][14]
En el caso de los cicloalcanos se nombra cis cuando los grupos funcionales se encuentran del mismo lado del anillo y trans si se encuentran en lados contrarios. De la forma que se puede observar en la imagen.[14]

En el caso de los dobles enlaces, se emplea cis si los grupos se encuentran del mismo lado del doble enlace y trans si los grupo se encuentran en lados opuestos. Podemos observar los dos casos en las siguientes imágenes.[14]


Este tipo de isomería otorga propiedades físicas distintas, debido a que los enlaces dobles no rotan libremente como los simples.[14]
Se produce cuando hay dos carbonos unidos con doble enlace que tienen las otras valencias con los mismos sustituyentes (2 pares) o con dos iguales y uno distinto.
No se presenta isomería geométrica ligada a los enlaces triples o sencillos.
A las dos posibilidades se las denomina:
- forma cis (o forma Z), con los dos sustituyentes más voluminosos del mismo lado, y
- forma trans (o forma E), con los dos sustituyentes más voluminosos en posiciones opuestas (Reglas de Cahn-Ingold-Prelog).[15]
No se pueden interconvertir entre sí estas dos formas de un modo espontáneo, pues el doble enlace impide la rotación, aunque sí pueden convertirse, a veces, en reacciones catalizadas.
| Isómeros del But-2-eno | Ácido maleico (Cis) y ácido fumárico (trans) |
Formas trans (E) y cis (Z) del 1,2-dibromoeteno. |
|---|---|---|

|
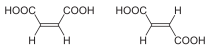
|

|
La isomería geométrica también se presenta en compuestos con doble enlace N=N, o en compuestos cíclicos en los que también se impide la rotación en torno a un eje.
| 1,2-dimetilciclopentano (formas cis y trans) |
cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis y trans del difluorodiazeno |
|---|---|---|---|

|

|

|

|
Isomería óptica o enantiomería
[editar]
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera. Esto se conoce como regla de Le Bel-van't Hoff.[8]
Los isómeros ópticos no se pueden superponer, como ocurre con las manos derecha e izquierda. Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de vibración de la luz polarizada en diferente dirección:
- un isómero desvía la luz polarizada hacia la derecha (en orientación con las manecillas del reloj) y se representa con el signo (+): es el isómero dextrógiro o forma dextro;
- el otro isómero óptico la desvía hacia la izquierda (en orientación contraria con las manecillas del reloj) y se representa con el signo (-)(isómero levógiro o forma levo).[16]
Otra forma de nombrar estos compuestos es mediante el convenio o nomenclatura D-L, normalmente empleando la proyección de Fischer. Esta nomenclatura es absoluta pero no necesariamente la forma (D) coincide con el isómero dextrógiro o forma (+).[17]

Si una molécula tiene n átomos de carbono asimétricos, tendrá un total de 2n isómeros ópticos.
También pueden representarse estos isómeros con las letras (R) y (S). Esta nomenclatura R-S, que sigue las reglas de Cahn-Ingold-Prelog, también se utiliza para determinar la configuración absoluta de los carbonos quirales.
Así pues, hay tres sistemas de nombrar estos compuestos:
- según la dirección de desviación del plano de la luz polarizada, distinguimos las formas dextro (+) y levo (-);
- según la nomenclatura D-L (Formas D y L), que es inequívoca para isómeros con un solo carbono asimétrico,[18] y
- según la configuración absoluta R-S (formas R y S),[19] más adecuada para moléculas con varios centros asimétricos.
Diasteroisómeros
[editar]Cuando un compuesto tiene más de un carbono asimétrico, podemos encontrar formas enantiómeras y otras formas que no son exactamente copias especulares, por no tener todos sus carbonos invertidos. A estas formas se les llama diasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol posee dos carbonos asimétricos por lo que tiene 4 formas posibles. De ellas, algunas son enantiomorfas, como (2S,3S)-3-bromo-butan-2-ol y (2R,3R)-3-bromo-butan-2-ol. En cambio, (2R,3S)-3-bromo-butan-2-ol es un diastereoisómero de los dos anteriores.
Mezcla racémica y formas meso
[editar]
Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico
[editar]Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de altura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.[20]
Isomería en química inorgánica
[editar]Hay varios tipos de isomería presente en compuestos inorgánicos, sobre todo en complejos de coordinación,[21] pero este fenómeno no es tan importante como en química orgánica:
- Isomería estructural o topológica: Los átomos se unen de modo diferente, como en el S2F2, de los que existe una molécula en forma de cadena y otra en forma de pirámide triangular. Un caso especial es la tautomería, en la que un átomo de H cambia de posición.
- Isomería conformacional: Igual a la ya comentada para compuestos orgánicos. Se presenta en compuestos con enlace sencillo como P2H4 o el ion ditionito, S2O42-, donde existen formas eclipsadas, escalonadas y sinclinal (gauche).
- Isomería cis-trans (geométrica): Aparece en compuestos como el ácido nitroso, HNO2, o en complejos de coordinación plano-cuadrados como [PtCl2(NH3)2].
- Isomería de posición, como en algunos heterociclos de azufre y nitrógeno. En el S6(NH)2 se mantiene el anillo octogonal del azufre pero dos átomos de azufre han sido sustituidos por grupos NH,que pueden estar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: también aparece en compuestos de coordinación de estructura tetraédrica con sustituyentes diferentes.
- Isomería de ionización: Se intercambian un ligando del catión con uno de los aniones que lo neutralizan,como ocurre entre [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complejos, podemos intercambiar sus ligandos y obtendremos isómeros diferentes, como ocurre entre [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].

Isomería de enlace en un complejo de cobalto. - Isomería de enlace: Algunos ligandos pueden unirse de modo diferente al ion central,como ocurre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+
- Isomería de polimerización: Es el caso de NO2 y N2O4, dos óxidos de nitrógeno gaseosos.
Isomerización
[editar]La isomerización es el proceso mediante el cual una molécula se transforma en otra molécula que tiene exactamente los mismos átomos, pero los átomos se reordenan.[22] En algunas moléculas y bajo ciertas condiciones, la isomerización ocurre espontáneamente. Muchos isómeros son iguales o aproximadamente iguales en energía de enlace y, por lo tanto, existen en cantidades aproximadamente iguales, siempre que puedan interconvertirse con relativa libertad, es decir, la barrera energética entre los dos isómeros no sea demasiado alta. Cuando la isomerización ocurre intramolecularmente, se considera una reacción de transposición.
Un ejemplo de isomerización organometálica es la producción de decafenilferroceno, [(η5-C5Ph5)2Fe] a partir de su isómero de enlace.[23][24]
Referencias
[editar]- ↑ «Isomería Molecular». www.quiral.es. Consultado el 8 de enero de 2016.
- ↑ «Lección 5. Fórmula molecular | Quiral». www.quiral.es. Consultado el 8 de enero de 2016.
- ↑ «Lección 6. Isomería Constitucional | Quiral». www.quiral.es. Consultado el 8 de enero de 2016.
- ↑ F. Kurzer (2000). «Fulminic Acid in the History of Organic Chemistry». J. Chem. Educ. 77 (7): 851-857. Bibcode:2000JChEd..77..851K. doi:10.1021/ed077p851. Archivado desde el original el 18 de febrero de 2009. Consultado el 7 de mayo de 2014.
- ↑ Esteban, Soledad. (2008). «Liebig–Wöhler Controversy and the Concept of Isomerism». J. Chem. Educ. 85 (9): 1201. Bibcode:2008JChEd..85.1201E. doi:10.1021/ed085p1201.
- ↑ L. Pasteur (1848) "Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire" (Memoir on the relationship which can exist between crystalline form and chemical composition, and on the cause of rotary polarization)," Comptes rendus de l'Académie des sciences (Paris), vol. 26, pages 535–538.
- ↑ L. Pasteur (1849) "Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire" (On the relations that can exist between crystalline form, and chemical composition, and the sense of rotary polarization), Annales de Chimie et de Physique, 3rd series, vol. 24, no. 6, pages 442–459.
- ↑ a b Química: Teoría y problemas. José Antonio García Pérez y otros. Ed. Tébar Flores. Albacete, 1996. ISBN 84-7360-155-6.Pág. 253 y ss.
- ↑ Química general. M. Garric. Editorial Reverté, 1979. ISBN 8429171770. Pág. 170
- ↑ Curso de química biológica. Venancio Deulofeu, Agustín Domingo Marenzi. Editorial El Ateneo, 1946. Pág. 34
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. 5ª ed., Editorial Pearson Educación, 1998. ISBN 9684443404. Pág. 421
- ↑ a b Título Fundamentos de química orgánica. Carl David Gutsche. Editorial Reverté, 1979. ISBN 8429174753. Pág.67
- ↑ McMurry, John (2008). Química Orgánica. México: Cengage Learning.
- ↑ a b c d Klein, David (2014). Química Orgánica. España: Editoral Médica Panamericana.
- ↑ Romanelli, Gustavo Pablo (2020). Problemas de Química Orgánica. Consultado el 25 de febrero de 2022.
- ↑ Química general; 8ª edición; Petrucci, Harwood y Herring; Prentice Hall; ISBN 0-13-014329-4
- ↑ http://books.google.es/books?id=VmdvQfFbq9UC&pg=PA166 Configuración absoluta. En: Diccionario de química. Inmaculada Julián. Editorial Complutense, 1999. ISBN 8489784728. Pág. 166
- ↑ Nomenclatura D-L. En: Curso de biomoléculas. Juan Manuel González Mañas. Universidad del País Vasco.
- ↑ Configuración absoluta de los centros quirales: cómo determinarla y designarla. En: Química orgánica. Stephen J Weininger, Frank R. Stermitz. Editorial Reverté, 1988. ISBN 842917527X. Pág. 132
- ↑ Química orgánica básica y aplicada: de la molécula a la industria, Volumen 1. Eduardo Primo Yúfera. Editorial Reverté, 1996. ISBN 8429179534, Pág. 52 y ss.
- ↑ Química inorgánica estructural. A.F. Wells. Editorial Reverté, 1978. ISBN 8429175245. Pág. 48 y ss.
- ↑ Unión Internacional de Química Pura y Aplicada. «isomerization». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Brown, K. N.; Field, L. D.; Lay, P. A.; Lindall, C. M.; Masters, A. F. (1990). «(η5-Pentaphenylcyclopentadienyl){1-(η6-phenyl)-2,3,4,5-tetraphenylcyclopentadienyl}iron(II), [Fe(η5-C5Ph5){(η6-C6H5)C5Ph4}], a linkage isomer of decaphenylferrocene». J. Chem. Soc., Chem. Commun. (5): 408-410. doi:10.1039/C39900000408.
- ↑ Field, L. D.; Hambley, T. W.; Humphrey, P. A.; Lindall, C. M.; Gainsford, G. J.; Masters, A. F.; Stpierre, T. G.; Webb, J. (1995). «Decaphenylferrocene». Aust. J. Chem. 48 (4): 851-860. doi:10.1071/CH9950851.
Enlaces externos
[editar]- Isomería Página en Averroes
- Isomería:tipos. Universidad de Huelva