MER/29
| MER/29 | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 2-(4-clorofenil)-1-[4-[2-(dietilamino)etoxy]fenil]-1-(4-metilfenil)etanol[1] | ||
| General | ||
| Otros nombres | Triparanol; Metascualeno; Valip; Acosterina; Hipocolestina[1] MER 29; MER-29 | |
| Fórmula estructural |
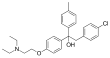 | |
| Fórmula molecular | C27H32NClO2 | |
| Identificadores | ||
| Número CAS | 78-41-1[2] | |
| ChEBI | 135714 | |
| ChEMBL | CHEMBL187709 | |
| ChemSpider | 6288 | |
| PubChem | 6536 | |
| UNII | 63S8C3RXGS | |
|
CCN(CC)CCOC1=CC=C(C=C1)C(CC2=CC=C(C=C2)Cl)(C3=CC=C(C=C3)C)O
| ||
| Propiedades físicas | ||
| Apariencia | sólido | |
| Densidad | 1130 kg/m³; 113 g/cm³ | |
| Masa molar | 437 212 157 g/mol | |
| Punto de fusión | 102,9/−103,7 °C (376/169 K) | |
| Punto de ebullición | 546,88 °C (820 K) | |
| Índice de refracción (nD) | nD20 1,58 | |
| Propiedades químicas | ||
| Acidez | 13,44 pKa | |
| Alcalinidad | 9,62 pKb | |
| Solubilidad en agua | insoluble | |
| Solubilidad | DMSO (20 mg/mL) | |
| Propiedades farmacológicas | ||
| Categoría embarazo | teratogénico | |
| Riesgos | ||
| Piel | caída del cabello, ictiosis | |
| Ojos | producción de cataratas irreversibles en los casos más graves | |
| Compuestos relacionados | ||
| colesterol | Etamoxitrifetol[1] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
MER/29 fue un medicamento cuya principal finalidad era tratar el colesterol en la sangre (agente hipolipemiante). Fue introducido al mercado de Estados Unidos a principios de la década de los 60 por el laboratorio Richardson-Merrell[3] y retirado en 1962 debido a que fue asociado con la formación de cataratas irreversibles.[1] El principio activo era triparanol, una amina cuaternaria referida como inhibidor distal de la biosíntesis de colesterol[4] pues impide el paso final del metabolismo del colesterol al evitar la conversión de desmosterol a colesterol.
El medicamento afectó la visión de más de cinco mil personas provocando muchos casos de cataratas y cegueras y, aún más, cientos de miles de consumidores del mismo tuvieron secuelas como pérdidas de piel o cabello[5].[3]
Se promovieron más de 1500 demandas en su época y en ellas se demostraron antecedentes como, por ejemplo, el hecho que el laboratorio supiera, antes que el producto fuera puesta en el mercado, que tenía la capacidad de producir esos trastornos, pues ya se habían revelado en las pruebas de rigor con animales. Más aún, se comprobó que algunos empleados del laboratorio modificaron informes experimentales que calificaban el medicamento de «muy peligroso». Esos informes falsos fueron presentados a la autoridad (Food and Drug Administration) con el fin de lograr la autorización para su venta.[3]
En 1962 una treintena de abogados litigantes en contra de la farmacéutica se unieron para compartir experiencias, materiales y veredictos en forma voluntaria para trabajar en forma coordinada en los casos. Incluso llegaron a crear una escuela en la que le enseñaban a otros ligitantes cómo tratar sus casos.[6]
Un juez federal condenó tanto a Richardson-Merrell como a sus científicos jefes porque sus acciones excedían la mera negligencia, y se aproximaban más al fraude. Además se culpó a la FDA por ser demasiado laxa en sus controles.[7]
Compuesto químico
[editar]El compuesto activo del MER/29 es el triparanol o 2-(4-clorofenil)-1-[4-[2-(dietilamino)etoxi]fenil]-1-(4-metilfenil)etanol.[1] MER/29 reduce drásticamente la biosíntesis del colesterol al disminuir la conversión de desmosterol[nota 1] a colesterol[9] a través de la inhibición de la acción de la enzima desmosterol-Δ24-reductasa.[10] Además reduce la conversión (isomerización) de esteroles insaturados de Δ8 a Δ7 por inhibición de la dehidrocolesterol Δ7 reductasa, la enzima final de la ruta biosintética. Esto conduce a la formación de una variedad de esteroles «aberrantes» Δ8 insaturados.[10]
La administración de MER/29 produce una acumulación en el hígado y el suero de desmosterol[11] y lleva a su acumulación en los tejidos de embriones.[10] La concentración de demosterol en suero humano alcanzaba una meseta a las dos semanas de ingerir el compuesto, se mantenía mientras se continuara el suministro y desaparecía dentro de las dos semanas posteriores de su suspensión.[9]
De acuerdo con una investigación de 1961, «rebaja las concentraciones de colesterol total en suero. Sin embargo, debido a la acumulación de demosterol, la respuesta en términos de colesterol total no es dramática.»[9] Esta disminución del colesterol sérico era asociada con un posible efecto antianginoso (en 12 de 28 sujetos) y en la mejora de las respuestas electrocardiográficas (3 de 11 pacientes con angina de pecho).[12] Sin embargo, años después se descubrió que el demosterol tomaba el lugar del colesterol en los depósitos de las placas de ateroesclerosis, haciendo inútil al MER/29 para el propósito original para el cual fue desarrollado.[13] También es capaz de sustituir al colesterol en la retina tanto en forma funcional como anatómica.[14] No obstante, no puede reemplazarlo en la transición de la fase G1 a S del ciclo celular, con lo cual, las células quedarían detenidas realizando la síntesis de proteínas y no podrían iniciar la replicación del ADN.[15]
Efectos secundarios
[editar]Si bien algunos trabajos científicos publicados en las décadas de 1950 y 1960 indicaban que no tenía efectos secundarios importantes a la dosis máxima de 250mg/día,[9][12] hay evidencias de que desde las primeras investigaciones se manifestaban síntomas variados de diferente entidad dependiendo de la dosis administrada.[10]
Por ejemplo, con frecuencia se reportaban síntomas tales como náuseas, dolores de cabeza, erupciones cutáneas transitorias, caída del cabello y piel seca. En pacientes cuya dosis era mayor de 250 mg/día, el cabello podía caerse en forma más severa o cambiar de color, e incluso se informaron casos de ictiosis. En abril de 1961 se notificó de dos casos de reacciones cutáneas severas —blefaroconjuntivitis y meibomianitis—. Los dos pacientes desarrollaron cataratas en ambos ojos en agosto y diciembre de ese mismo año. En marzo y abril de 1962 se reportaron dos nuevos casos de cataratas. En ese momento el laboratorio decidió retirar del mercado el producto, si bien no fue suficiente para detener la aparición de nuevos casos. A partir de 1963 se impusieron restricciones médico-legales que desalentaron las publicaciones sobre el tema.[16]
No existen cataratas que se puedan llamar «típicas» producidas por triparanol, por lo cual para poder diagnosticarlas en forma adecuada es menester realizar un análisis previo a fondo de la historia clínica de los pacientes. No obstante, la gran mayoría se encontraba en la parte subcapsular posterior del ojo.[16]
Los ensayos en ratas mostraron que las cataratas inducidas por triparanol presentaban mayoritariamente dos tipos de lípidos: esteroles y fosfolípidos.[nota 2] El metabolismo de los lípidos es mucho más activo en la retina que en la parte vítrea del ojo, donde está prácticamente inactiva. El triparanol perturba este metabolismo, lo que explicaría la localización de las cataratas. También se comprobó que perturba el transportador catiónico en las cataratas, aunque se desconoce el mecanismo por el cual ocurre.[16]
Además de la retina, la conversión natural de demosterol a colesterol se da en otros tejidos ectodérmicos superficiales, como la piel, lo que explicaría también los demás síntomas.[16]
En experimentación de laboratorio se descubrió que el químico producía malformaciones en las extremidades de los huesos en fetos de rata expuestos a una sola dosis oral (150 a 200 mg/kg) dada a la hembra embarazada, lo que podría ser provocado por el bloqueo de las enzimas (tanto las reductasas como la isomerasa).[10]
Antecedentes
[editar]A partir del descubrimiento, en 1939, de la relación entre la concentración en plasma de colesterol y el desarrollo de enfermedades cardiovasculares, comenzó un verdadero interés médico por conseguir fármacos con capacidad hipolipemiante.[17][nota 3]
El primer agente hipolipemiante en ser aislado fue un extracto tiroideo, eficiente para el tratamiento de pacientes hipo y eutiroideos, pero tuvo que ser suspendido porque presentaba importantes efectos secundarios. La abstención de comer alimentos ricos en grasa era por aquellos años la única alternativa. Sin embargo, en la década de 1950 se descubrió el efecto hipolipemiante del ácido nicotínico o niacina, que se sigue utilizando en medicina.[17]
A esto le siguió la experimentación con cloruro férrico que, más allá de su eficiencia comprobada para precipitar sales biliares, producía graves efectos colaterales como cataratas, adelgazamiento y muerte de los animales de experimentación (en particular perros), por lo cual fue abandonado para continuar la búsqueda de un compuesto sin estos efectos indeseables.[17]
En aquella época para que un medicamento pudiera ser comercializado en forma interestatal, la farmacéutica debía entregarle a la FDA informes completos con los resultados de las pruebas en animales que demostraran que era segura y no tenía efectos secundarios graves en humanos, si bien no necesariamente debía ser efectiva.[18]
Investigación y venta
[editar]Los detalles exactos de las pruebas llevadas a cabo por Richardson-Merrell nunca se hicieron públicos. Sin embargo, a través de los juicios en su contra se pudieron establecer algunos hechos. Entre 1956 y 1959 los laboratorios de Merrel realizaron pruebas en ratas, perros y monos con el MER/29, a fin de determinar su eficacia, dosis, toxicidad en órganos y tejidos, además de convencer a algunos médicos de prescribir la droga a sus pacientes para poder experimentar con ellos.[19]
Se demostró que la empresa envió una carta a la FDA para comunicarle que un mono había ganado peso cuando en verdad había perdido un cuarto de su peso corporal. Dos perros desarrollaron cataratas, pero el hecho apareció solo en el informe de autopsia; nunca fue reportado a la autoridad, como tampoco lo hicieron con un informe que les envió una compañía rival, luego que la droga estuviera en el mercado, indicando que el producto producía cataratas en animales.[20]
Richardson-Merrell asesoró a sus vendedores para que al promoverla entre los médicos indicaran que era «enteramente segura» y libre de efectos secundarios. Además, ante quejas o consultas respecto a problemas o efectos secundarios, dijeran que no había antecedentes de daños o que eran causados por alguna otra droga.[20]
La comercialización del MER/29 comenzó en abril de 1960. A mediados de 1961 la farmacéutica agregó al envase una advertencia por la pérdida de cabello, y en diciembre de ese año envió una carta a los médicos titulada «Querido doctor», aprobada por la FDA, para comunicarles los efectos secundarios del medicamento, justo cuando el número de usuarios alcanzaba los 400 000. En abril de 1962 por primera vez la FDA tuvo acceso a los datos experimentales verdaderos, constatando que había recibido información fraudulenta. Una semana después, Richardson-Merrell decidió retirar voluntariamente el producto del mercado, y el mes siguiente lo hizo la autoridad en forma definitiva, debido a que no era seguro para el público.[21]
Véase también
[editar]Notas
[editar]- ↑ El demosterol o 24-dehidro colesterol, es el precursor biosintético inmediato del colesterol en la vía de Bloch, una via alternativa para la síntesis de esteroles. Solo difieren en un doble enlace en la posición 24a.[8]
- ↑ El metabolismo de los lípidos es de vital importancia para el mantenimiento de las membranas celulares y de las fibras de las lentes, ya que están mayoritariamente compuestas de fosfolípidos y en menor grado colesterol.
- ↑ Entonces se desconocía la importancia del colesterol en la composición de las membranas biológicas y su papel biológico, como por ejemplo precursor de hormonas[17] y regulador del ciclo celular.[15]
Referencias
[editar]- ↑ a b c d e «TRIPARANOL» (en inglés). Pub Chem. Consultado el 27 de febrero de 2016.
- ↑ Número CAS
- ↑ a b c Pizarro, 1993
- ↑ «Triparanol (CAS 78-41-1)» (en inglés). Santa Cruz Biotechnology. Consultado el 19 de marzo de 2016.
- ↑ «Productos para combatir la pérdida de cabello: panorama general del mercado».
- ↑ McIntosh, Wayne V.; Cates, Cynthia L (2010). Multi-Party Litigation: The Strategic Context Law and Society Series (en inglés). UBC Press. p. 59. ISBN 9780774858786. Consultado el 20 de marzo de 2016.
- ↑ Rheingold, P.D.; 118-119
- ↑ Singh, Pushpendra; Jafurulla, Md.; Paila, Yamuna Devi; Chattopadhyay, Amitabha (de octubre de 2011). «Desmosterol replaces cholesterol for ligand binding function of the serotonin1A receptor in solubilized hippocampal membranes: Support for nonannular binding sites for cholesterol?». Biochimica et Biophysica Acta (BBA) - Biomembranes (en inglés) 1808 (10): 2428-2434. doi:10.1016/j.bbamem.2011.06.022. Archivado desde el original el 6 de marzo de 2016. Consultado el 27 de febrero de 2016.
- ↑ a b c d Steinberg, Daniel; Avigan, Joel; Feigelson, Eugene B. (1 de mayo de 1961). «Effects of Triparanol (MER-29) on Cholesterol Biosynthesis and on Blood Sterol Levels in Man*». Journal of Clinical Investigation (en inglés) 40 (5): 884-893. doi:10.1172/JCI104323.
- ↑ a b c d e Chevy, F; Illien, F; Wolf, C; Roux, C (de agosto de 2002). «Limb malformations of rat fetuses exposed to a distal inhibitor of cholesterol biosynthesis.». Journal of lipid research (en inglés) 43 (8): 1192-200. PMID 12177163. Consultado el 28 de febrero de 2016.
- ↑ Avigan, J.; Steinberg, D.; Thompson, M. J.; Mosettig, E. (enero de 1960). «Mechanism of action of MER-29, an inhibitor of cholesterol biosynthesis». Biochemical and Biophysical Research Communications (en inglés) 2 (1). Consultado el 26 de febrero de 2016.
- ↑ a b Hollander, William (3 de septiembre de 1960). «The Effects of Triparanol (MER-29) in Subjects with and without Coronary Artery Disease». JAMA 174 (1): 5. doi:10.1001/jama.1960.03030010007002.
- ↑ Herndon, J. H.; Siperstein, M. D. (1 de febrero de 1963). «Desmosterol Deposition in Human and Experimental Atherosclerosis». Circulation Research (en inglés) 12 (2): 228-234. doi:10.1161/01.RES.12.2.228. Consultado el 28 de febrero de 2016.
- ↑ Fliesler, Steven J.; Richards, Michael J.; Miller, Chi-yen; Peachey, Neal S.; Cenedella3, Richard J. (2000). «Retinal Structure and Function in an Animal Model that Replicates the Biochemical Hallmarks of Desmosterolosis». Neurochem Res (en inglés) 25 (5): 685-694. PMID 2844951. Consultado el 4 de marzo de 2016.
- ↑ a b Singh, Pushpendra; Saxena, Roopali; Srinivas, Gunda; Pande, Gopal; Chattopadhyay, Amitabha; Koval, Michael (15 de marzo de 2013). «Cholesterol Biosynthesis and Homeostasis in Regulation of the Cell Cycle». PLoS ONE (en inglés) 8 (3): e58833. PMID 3598952. doi:10.1371/journal.pone.0058833.
- ↑ a b c d Kirby, T J (1967). «Cataracts produced by triparanol. (MER-29).». Trans Am Ophthalmol Soc. (en inglés) 65 (2): 494-543. PMID 1310282.
- ↑ a b c d Mostaza Prieto, José María (2008). «Sobre el descubrimiento de los fármacos hipolipemiantes». Med Clin (Barcelona) 130 (18): 698-703.
- ↑ Rheingold, P.D.; 117
- ↑ Rheingold, P.D.; 117-118
- ↑ a b Rheingold, P.D.; 119
- ↑ Rheingold, P.D.; 120
Bibliografía consultada
[editar]- Pizarro, Ramón Daniel (1993). «El Daño Punitivo». Derecho de Daños 2. Argentina: La Rocca. pp. 287 y siguientes.
- Rheingold, Paul D. (1968). «The MER/29 Story--An Instance of Succesful Mass Disaster Litigation». California Law Review (en inglés) 56 (1): 116-148. doi:10.15779/Z386X92.
Bibliografía adicional
[editar]- Fine, Ralph Adam (1 de junio de 2012). Hannah Yoseph, ed. The Great Drug Deception: Lessons from MER/29 for Today's Statin and Drug Consumers - What Your Doctor May Not Know (en inglés). ISBN 978-0985449049.


