Motor molecular sintético
Un motor molecular sintético es una máquina molecular capaz de rotar en respuesta a una entrada de energía. Aunque el término "motor molecular" tradicionalmente ha sido utilizado para referirse a una proteína natural que induce el movimiento (a través de la dinámica de proteínas), también se utiliza el término para referirse a los motores no biológicos, motores sintéticos no peptídicos. Muchos químicos están buscando sintetizar estos motores moleculares.[1] La idea de la posibilidad de crear motores moleculares sintéticos surgió por primera vez con el discurso There's Plenty of Room at the Bottom, por el pionero de la nanotecnología Richard Feynman en 1959.
Los requisitos básicos para un motor sintético son los movimientos repetitivos de 360°, el consumo de energía y la rotación unidireccional. Los dos primeros esfuerzos en este sentido fueron el motor químico llevado a cabo por el Dr. T. Ross Kelly, de la Universidad de Boston con sus colaboradores, y el motor de luz creado por el Feringa y su equipo de trabajo, que se publicaron en 1999 en el mismo número de Nature. En 2008, Petr Král y compañeros de trabajo propusieron motores túnel de los electrones que giran continuamente por un torque permanente, abriendo la posibilidad de realización práctica de una máquina real de motor molecular. Se espera que los informes de más esfuerzos en este campo aumenten a medida que la comprensión de la química y la física en el nivel nanométrico es amplíen.
Motores giratorios moleculares impulsados químicamente
[editar]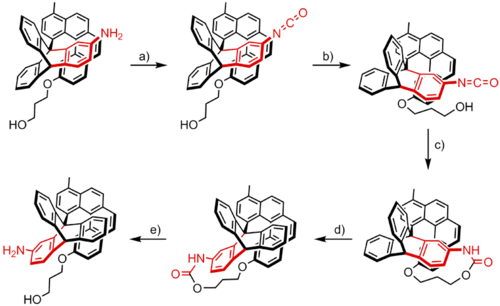
Un primer ejemplo de un motor molecular sintético químicamente impulsado fue reportado por Kelly y sus colaboradores en 1999.[2] Su sistema se compone de un rotor de tres hojas de tripticeno y una heliceno, capaz de realizar una rotación unidireccional de 120 °.
Esta rotación ocurre en cinco pasos. El grupo amino presente en el tripticeno se convierte en un grupo isocianato por condensación con fosgeno (a). Una rotación térmica o espontánea alrededor del enlace central lleva el grupo isocianato a la proximidad del grupo hidroxilo ubicado en la porción heliceno (b), permitiendo así que estos dos grupos reaccionen entre sí (c). Esta reacción irreversible atrapa el sistema como un uretano cíclico tensionado que es mayor en energía y por lo tanto energéticamente más cerca de la barrera de energía rotacional que el estado original. Por lo tanto, la rotación adicional de la fracción tripticeno requiere sólo una cantidad relativamente pequeña de activación térmica con el fin de superar esta barrera, liberando así la tensión (d). Finalmente, la separación del grupo uretano restaura las funcionalidades de amina y el alcohol de la molécula (e).
El resultado de esta secuencia de eventos es una rotación unidireccional de 120° de la fracción de tripticeno con respecto a la fracción heliceno. Además, una rotación hacia adelante o hacia atrás del rotor tripticeno es inhibida por el resto heliceno. La rotación unidireccional del sistema es un resultado tanto de la inclinación asimétrica de la fracción heliceno, así como de la tensión del uretano cíclico que está formado en c. Esta tensión solo puede ser disminuida por la rotación en el sentido de las agujas del reloj del rotor tripticeno en d, ya que tanto la rotación en sentido antihorario, así como el proceso inverso de d son energéticamente desfavorables. En este sentido, la preferencia por la dirección de rotación es determinada por las posiciones de ambos grupos funcionales y por la forma del heliceno; así, la dirección esta determinada por el diseño de la molécula, en lugar de ser establecida por factores externos
El motor creado por Kelly y sus colaboradores es un elegante ejemplo de cómo la energía química puede ser utilizada para inducir movimiento unidireccional rotacional controlado, un mecanismo que se asemeja al consumo de ATP en los organismos con el fin de alimentar numerosos procesos. Sin embargo, sufre de un serio inconveniente: la secuencia de eventos que conduce a la rotación de 120° no es repetible. Kelly y sus colaboradores han buscado formas de extender el sistema para que esta secuencia se pueda realizar en varias ocasiones. Desgraciadamente, sus intentos de lograr este objetivo no han tenido éxito y en la actualidad el proyecto ha sido abandonado.[3]
Dos ejemplos adicionales de motores moleculares químicos que han sido reportados hacen uso de la apertura de anillo estereoselectiva de una lactona racémica biarilo a través del uso de reactivos quirales, lo que resulta en una rotación de 90° dirigida de un arilo con respecto al otro arilo. Branchaud y algunos colaboradores han reportado que este enfoque, seguido por un paso del cierre de anillo adicional, se puede utilizar para lograr una rotación irrepetible de 180°.[4] Feringa y otros colaboradores utilizan este enfoque en el diseño de una molécula que pueda rotar 360° repetidamente.[5] La rotación completa de este motor molecular se lleva a cabo en cuatro etapas. En las fases A y C, la rotación del resto arilo está restringido, aunque la inversión de la hélice es posible. En las fases B y D el arilo puede girar con respecto al naftaleno con interacciones estéricas que impiden al arilo pasar al naftaleno. El ciclo de rotación se compone de cuatro pasos inducidos químicamente que realizan la conversión de una etapa a la siguiente. Pasos 1 y 3 son reacciones asimétricas de apertura de anillo que hacen uso de un reactivo quiral con el fin de controlar la dirección de la rotación del arilo. Los pasos 2 y 4 consisten en la desprotección del fenol, seguido por la formación regioselectiva del anillo. Hasta ahora, este motor molecular es el único ejemplo de un motor rotativo artificial completamente químicamente impulsado que es capaz de rotar 360 °.
Motores moleculares impulsados por la luz
[editar]
En 1999 el laboratorio del Profesor Dr. Ben L. Feringa en la Universidad de Groningen, Países Bajos informó la creación de un rotor molecular unidireccional.[6] El sistema de su motor molecular, con capacidad de rotar 360°, consiste en un bis-heliceno conectados por un alqueno de enlace doble que muestra quiralidad axial y posee dos estereocentros.
Un ciclo de rotación unidireccional tarda 4 etapas de reacción. El primer paso es un fotoisomerización endotérmica a baja temperatura de las redes trans ( P , P ) isómero 1 de la cis ( M , M ) 2, donde P representa la hélice derecha y M la hélice izquierda. En este proceso, los dos grupos metilo axiales se convierten en dos grupos metilo ecuatoriales estéricamente menos favorables.
Al aumentar la temperatura a 20 °C, estos grupos metilo se convierten de nuevo, exotérmicamente, a los grupos ( p , p ) cis axiales (3) en una inversión de hélice. Debido a que el isómero axial es más estable que el isómero ecuatorial, la rotación inversa está bloqueada. Una segunda fotoisomerización convierte (P , P ) cis 3 en ( M , M ) trans 4, otra vez con la formación de los grupos metilo ecuatoriales estéricamente desfavorables. Un proceso de isomerización térmica a 60 °C cierra el ciclo de 360 ° y retorna a las posiciones axiales.

El principal obstáculo a superar es el largo tiempo de reacción para la rotación completa de estos sistemas, que no se compara con las velocidades de rotación de las proteínas motoras en los sistemas biológicos. En el sistema más rápido hasta la fecha, con una media inferior de fluoreno, la vida media de la inversión de hélice térmica es de 0,005 segundos.[7] Este compuesto se sintetizó utilizando la reacción de Barton-Kellogg. En esta molécula la etapa más lenta en su rotación, la inducida térmicamente hélice-inversión, se cree que debe proceder mucho más rápidamente debido a la mayor longitud del terc-butilo que hace que el isómero inestable sea incluso menos estable que cuando el grupo metilo se utiliza. Esto se debe a que el isómero inestable es más desestabilizado que el estado de transición que conduce a la hélice-inversión. El comportamiento diferente de las dos moléculas se ilustra por el hecho de que el tiempo de vida media para el compuesto con un grupo metilo en lugar de un grupo terc-butilo es de 3,2 minutos.[8]
El principio Feringa se ha incorporado en un prototipo nanocoche. [9] El coche sintetizado tiene un motor de heliceno derivado con un oligo (fenileno etinileno) chasis y cuatro ruedas carborano y se espera que sea capaz de moverse sobre una superficie sólida con un sistema de microscopía de túnel, aunque hasta ahora esto no ha sido observado. El motor no funciona con ruedas de fullereno porque apagan la fotoquímica de la fracción del motor. La capacidad de ciertos sistemas Feringa para actuar como un catalizador asimétrico también se ha demostrado.[9][10]
Demostración experimental de un motor molecular eléctrico simple
[editar]Es un motor de accionamiento eléctrico que está hecho de una sola molécula de butilo sulfuro de metilo.[11] La molécula se adsorbe sobre una pieza de cobre (111) por quimisorción.[11] El motor eléctrico, que es el más pequeño del mundo,[12] es de tan solo un nanómetro (mil millonésima de metro)[13] (60.000 veces más pequeño que el grosor de un cabello humano). Fue desarrollado por los químicos de la Tufts University School of Arts and Sciences.[14]
Referencias
[editar]- ↑ Synthetic Molecular Motors Jordan R. Quinn Online Article (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Unidirectional rotary motion in a molecular system T. Ross Kelly, Harshani De Silva and Richard A. Silva Nature 1999, 401, 150-152. doi 10.1038/43639 PMID 10490021
- ↑ Progress toward a Rationally Designed, Chemically Powered Rotary Molecular Motor T. Ross Kelly, Xiaolu Cai, Fehmi Damkaci, Sreeletha B. Panicker, Bin Tu, Simon M. Bushell, Ivan Cornella, Matthew J. Piggott, Richard Salives, Marta Cavero, Yajun Zhao, and Serge Jasmin J. Am. Chem. Soc. 2007, 129, 376-386. Abstract Archivado el 11 de febrero de 2008 en Wayback Machine.
- ↑ Net directed 180° aryl–aryl bond rotation in a prototypical achiral biaryl lactone synthetic molecular motor Ying Lin, Bart J. Dahl and Bruce P. Branchaud Tetrahedron Lett. 2005, 46, 8359-8362. Abstract
- ↑ Fletcher, S. P.; Dumur, F; Pollard, MM; Feringa, BL (2005). «A Reversible, Unidirectional Molecular Rotary Motor Driven by Chemical Energy». Science 310 (5745): 80-2. PMID 16210531. doi:10.1126/science.1117090.
- ↑ Light-driven monodirectional molecular rotor Nagatoshi Koumura, Robert W. J. Zijlstra, Richard A. van Delden, Nobuyuki Harada, Ben L. Feringa Nature 1999, 401, 152-155. doi 10.1038/43646]
- ↑ Fine Tuning of the Rotary Motion by Structural Modification in Light-Driven Unidirectional Molecular Motors Javier Vicario, Martin Walko, Auke Meetsma and Ben L. Feringa J. Am. Chem. Soc., 2006, 128, 5127-5135. Abstract Archivado el 11 de febrero de 2008 en Wayback Machine.
- ↑ Controlling the speed of rotation in molecular motors. Dramatic acceleration of the rotary motion by structural modification Javier Vicario, Auke Meetsma and Ben L. Feringa Chem. Commun., 2005, 5910-5912, doi 10.1039/b507264f
- ↑ Dynamic Control of Chiral Space in a Catalytic Asymmetric Reaction Using a Molecular Motor Science 18 March 2011: Vol. 331 no. 6023 pp. 1429-1432 doi 10.1126/science.1199844
- ↑ Heat and Light Switch a Chiral Catalyst and Its Products Science 18 March 2011: Vol. 331 no. 6023 pp. 1395-1396 doi 10.1126/science.1203272
- ↑ a b Tierney, Heather L.; Murphy, Colin J.; Jewell, April D.; Baber, Ashleigh E.; Iski, Erin V.; Khodaverdian, Harout Y.; McGuire, Allister F.; Klebanov, Nikolai et al. (4 de septiembre de 2011). «Experimental demonstration of a single-molecule electric motor». Nature Nanotechnology (en inglés) (Nature) 1 (1). ISSN 1748-3387. doi:10.1038/nnano.2011.142. Consultado el 28 de julio de 2011.
- ↑ «Single Molecule Makes Smallest Electric Motor, Marks Nanoscience Breakthrough». International Business Times. Archivado desde el original el 26 de marzo de 2012. Consultado el 6 de agosto de 2011.
- ↑ «Electric motor made from a single molecule». BBC News Online. Consultado el 6 de agosto de 2011.
- ↑ «World's Smallest Electric Motor Made from a Single Molecule». Science Daily. Consultado el 6 de agosto de 2011.
