Fascioliasis
| Fascioliasis | ||
|---|---|---|
 Fasciola hepatica | ||
| Especialidad |
infectología helmintólogo | |
| Síntomas | Dolor abdominal, náuseas, piel amarilla. | |
| Complicaciones | Pancreatitis, anemia | |
| Diagnóstico | Muestra de heces | |
| Tratamiento | Triclabendazol[1] | |
| Sinónimos | ||
| Fasciolosis | ||
La fascioliasis o fasciolosis es una enfermedad parasitaria (helmintiasis) causada por dos especies de trematodos digéneos, Fasciola hepatica y Fasciola gigantica, conocidas vulgarmente como duelas del hígado. Los adultos se localizan en la vesícula biliar o en los conductos biliares del hígado.
Se trata de una zoonosis ya que afecta primariamente a otros mamíferos, pero puede transmitirse al hombre. F. hepatica es propia de Europa, América y Oceanía, pero en África y Asia se dan ambas especies y su distribución se superpone en muchas áreas.[2]
El ciclo biológico de los parásitos involucra a dos hospedadores, uno intermediario y otro definitivo. El hospedador intermediario es un caracol de agua dulce; el número de posibles hospedadores definitivos es muy amplio e incluye el ganado y otros muchos mamíferos herbívoros (principalmente ovejas y vacas), incluyendo el ser humano.[3]
Una estimación conservadora sobre la pérdida de productividad del ganado debida a la fascioliasis arroja la cifra de más 3.200 millones de dólares anuales en todo el mundo.[4]
Además, la fascioliasis se considera una enfermedad humana emergente; la Organización Mundial de la Salud ha estimado que afecta a 2,4 millones de personas y que otros 180 millones tiene riesgo de infección.[5] El cambio climático parece tener un papel relevante en esta expansión.[6]
Otros nombres
[editar]La fascioliasis se conoce también fasciolosis, distomiasis, distomatosis hepática, duela; en Chile es conocida como pirihuín, y en el norte de Argentina y Uruguay como saguaipé.[7]
Los parásitos
[editar]F. hepatica mide entre 2 y 3 cm y es cosmopolita. F. gigantica mide de 4 a 10 cm y se distribuye principalmente por los trópicos; ha sido citada en África, Oriente Medio, Europa Oriental y el sur y el este de Asia.[3]
En ganado de Japón se han descrito individuos diploides (2n = 20), triploides (3n = 30) y quimera (2n/3n), la mayoría de los cuales se reproducen partenogenéticamente; por ese motivo, las duelas del Japón no se adscriben a ninguna especie concreta y se citan como Fasciola sp.[8]
Estudios recientes basados en genes mitocondriales han demostrado que las Fasciola japonesas están más relacionadas con F. gigantica que con F. hepatica.[9] Por otra parte, se ha descrito una tercera especie de Fasciola que parasita elefantes en la India.[10]
Ciclo de vida de Fasciola hepatica
[editar] |
1.- Los huevos abandonan el hospedador definitivo con las heces. 2.- De los huevos eclosionan larvas ciliadas miracidio. 3.- Las larvas miracidio penetran en el hospedador intermediario, un caracol de agua dulce. 4.- En el interior del caracol, las larvas miracidio se transforman en esporocistos (4a) que se desarrollan en redias (4b) y éstas en cercarias (4c). 5.- Las cercarias abandonan el caracol y, tras un periodo de vida libre en el agua se enquistan sobre plantas acuáticas, transformándose en metacercarias. 6.- Las metacercarias son ingeridas por el ganado o por los humanos, los hospedadores definitivos que se desenquistan en el duodeno 7.- Del duodeno pasan a los conductos biliares, donde originan los adultos que producirán huevos que abandonarán el hospedador y cerrarán el ciclo. |
Distribución geográfica
[editar]La fascioliasis está distribuida por todo el mundo.[3] Mientras que la fascioliasis animal está presente en países con una producción ganadera elevada (especialmente bovinos y ovejas), las fascioliasis humana es más común, excepto en Europa Occidental, en países en vías de desarrollo. La fascioliasis se da solo en las áreas en que existen los hospedadores intermediarios apropiados (ciertas especies de caracoles acuáticos).
Fascioliasis humana
[editar]La fascioliasis humana se ha convertido un importante problema de salud pública.[11] Ha sido observada en Europa, América, Asia, África y Oceanía y su incidencia se ha incrementado en 51 países de los cinco continentes.[12][13] Un análisis global muestra que la supuesta correlación entre fascioliasis animales y humanas solo se da a un nivel básico. Prevalencias altas en humanos no se dan necesariamente en áreas donde la fascioliasis es un grave problema veterinario. Por ejemplo, en Sudamérica se dan hiperendemias y mesoendemias en Bolivia y el Perú donde la fascioliasis animal es un problema menor, mientras en países como Uruguay, Argentina y Chile las infecciones a humanos son esporádicas (hipoendémicas).[13]
Europa
[editar]En Europa, la fascioliasis humana se da principalmente en Francia, España, Portugal y la antigua URSS.[13] Francia está considerada una importante área endémica; entre 1970 y 1982 se contabilizaron un total de 5.863 casos en hospitales franceses.[14] En otros países europeos la fascioliasis es esporádica y la presencia de la enfermedad está asociada a viajes a áreas endémicas. En cuanto a la antigua Unión Soviética, casi todos los casos provienen de Tayikistán.[13]
Muchos artículos citan la fascioliasis en Turquía,[15] donde la prevalencia, calculada a través de estudios serológicos, es de un 3,01% en la provincia de Anatolia y entre 0,9 y 6,1% en la provincia de Isparta.[16]
América
[editar]En América del Norte es una enfermedad muy esporádica. En México se han citado 53 casos. En América Central es un problema sanitario en varias islas del Caribe, en especial en Puerto Rico y Cuba; en las provincias cubanas de Pinar del Río y Villa Clara la fascioliasis es hiperendémica.
En Sudamérica es un serio problema en Bolivia, el Perú y Ecuador, que son considerados los países con mayores prevalencias del mundo, en especial en las zonas del Altiplano. En el altiplano del norte de Bolivia la prevalencia de la infección alcanza del 72% al 100% en algunas comunidades, deducida por pruebas coprológicas y serológicas respectivamente.[12]
En el Perú, F. hepatica en humanos se da en todo el país. Las prevalencias más altas se han constatado en Arequipa, Valle del Mantaro, Departamento de Cajamarca y Departamento de Puno.[2] En otros países sudamericanos como Argentina, Uruguay, Brasil, Venezuela y Colombia, la fascioliasis humana parece ser esporádica, a pesar de la elevada prevalencia de la enfermedad en el ganado.
África, Asia, Australia y Oceanía
[editar]En África, los casos de fascioliasis humana son escasos, excepto en la zona norte. La prevalencia más elevada se da en Egipto, donde la enfermedad es más común en las comunidades que viven en el delta del Nilo.[2]
En Asia, la mayor parte de los casos de fascioliasis humana proceden de Irán, donde se han citado más de 10 000 casos, sobre todo de la provincia de Guilán, en el mar Caspio. En el este de Asia la enfermedad es esporádica y se han docimentado pocos casos en Japón, Corea, Vietnam y Tailandia.[12]
En Australia la enfermedad es muy rara (solo 12 casos documentados). En Nueva Zelanda nunca se ha detectado en humanos.[12]
Fasciolosis animales
[editar]Los países en que se ha detectado fascioliasis en el ganado son los siguientes:
- Europa: Reino Unido, Irlanda, Francia, Portugal, España, Suiza, Italia, Holanda, Turquía, Alemania, Polonia y Rusia.
- Asia: Rusia, Tailandia, Irak, Irán, China, Vietnam, India, Nepal, Japón, Corea, Filipinas
- África: Kenia, Zimbabue, Nigeria, Egipto, Gambia, Marruecos.
- Australia y Oceanía: Australia, Nueva Zelanda.
- América: Estados Unidos, México, Cuba, Perú, Chile, Uruguay, Argentina, Jamaica, Brasil.
El 8 de septiembre de 2007, funcionarios veterinarios del sur de Cotabato (Filipinas) informaron que el nivel de infección en animales domésticos ascendía al 89,5%, lo que representa un súbito aumento de casos debido al clima cambiante de la región, y que debían tomarse medidas para evitar complicaciones con la surra y otras infecciones.[17]
Fuentes de infección y transmisión en humanos
[editar]
La infección por Fasciola está condicionada por la presencia de los gasterópodos que actúan como hospedadores intermediarios, de herbívoros domésticos que actúan como reservorios, las condiciones climáticas y los hábitos alimenticios de las personas.[11] Ovejas, cabras y vacas son los principales reservorios animales; aunque otros animales pueden padecer la infección, no son demasiado importantes como transmisores de la enfermedad a los humanos. Por otra parte, algunos autores han citado que los asnos y los cerdos también contribuyen a la propagación de la fascioliasis en Bolivia.[18]
En cuanto a los animales salvajes, se ha demostrado que las ratas (Rattus rattus) pueden jugar un papel importante en la dispersión de la enfermedad en Córcega.[19] En Francia se ha confirmado que el coipú (Myocastor coypus) es un reservorio de F. hepatica.[20]
Las personas se infectan por ingestión de plantas acuáticas que contengan metacercarias.[21] Muchas especies vegetales pueden actuar como vehículos de infección. En Europa se han citado los berros de agua silvestres (Nasturtium officinale, Nasturtium silvestris y Rorippa amphibia), el diente de león (Taraxacum officinale), Valerianella olitora y la hierbabuena (Mentha viridis).[12]
Dado que las cercarias de F. hepatica se enquistan también en la superficie del agua, la infección puede ocurrir por beber aguas contaminadas.[11] Además, un estudio experimental ha sugerido que los humanos que consumen hígado crudo infectado con gusanos inmaduros podrían contraer la enfermedad.[22]
Hospedadores intermediarios
[editar]Los hospedadores intermediarios de F. hepatica son los caracoles de agua dulce de la familia Lymnaeidae.[3][23] De modo muy ocasional los miembros de la familia Planorbidae pueden actuar también como hospedadores intermediarios.[2]
Patogenia
[editar]El desarrollo de la infección en el huésped definitivo puede dividirse en dos fases: la fase paremquimal (o migratoria) y la fase biliar.[24]
La fase parenquimal comienza los gusanos jóvenes recién desenquistados penetran la pared del intestino, tras lo cual migran por la cavidad abdominal y penetran en el hígado u otros órganos; F. hepatica muestra una gran predilección por los tejidos hepáticos.[25] Ocasionalmente se dan localizaciones ectópicas en los pulmones, diafragma, pared intestinal, riñones o tejidos subcutáneos.[26][11] Durante la migración los gusanos destruyen los tejidos y aparece inflamación alrededor del recorrido migratorio.
La segunda fase o fase biliar, comienza cuando los parásitos entran en los conductos biliares del hígado. Allí maduran los gusanos alimentándose de sangre y comienzan a producir huevos. Como resultado del daño en los tejidos se obstruyen los conductos biliares, que se hipertrofian.
Síntomas clínicos
[editar]Síntomas clínicos en humanos
[editar]

El curso de la fasciolasis humana tiene cuatro fases principales:[12]
- 1. Periodo de incubación. Abarca desde la ingestión de las metacercarias hasta la aparición de los primeros síntomas. Dura entre unos pocos días hasta tres meses, dependiendo del número de metacercarias y el estado del sistema inmunológico del hospedero.
- 2. Fase aguda o invasiva. La migración de las duelas jóvenes desde el duodeno hacia los conductos biliares produce una destrucción del tejido peritoneal y hepático. Además de reacciones tóxicas y alérgicas.[27] Los principales síntomas en esta fase son:
- Fiebre; normalmente es el primer síntoma de la enfermedad; puede alcanzar los 40-42 °C.
- Dolor abdominal.
- Problemas gastrointestinales: pérdida del apetito, flatulencias, náuseas, diarrea.
- Urticaria.
- Hepatomegalia y esplenomegalia.
- Anemia.
- Ascitis.
- Ictericia.
- Muy raramente, problemas respiratorios como tos, disnea, dolor en el pecho, hemoptisis.
- 3. Fase latente. Esta fase puede durar meses o años. La proporción de individuos asintomáticos en esta fase es desconocida. Se descubre a menudo tras una revisión de los familiares de un paciente diagnosticado.[12]
- 4. Fase crónica u obstructiva. Esta fase puede aparecer meses o años después de la infección inicial. Las duelas adultas causan inflamación e hiperplasia del epitelio de los conductos biliares produciendo una colangitis y colecistitis que, junto con el gran tamaño de los gusanos, es suficiente para causar una obstrucción mecánica de dichos conductos. Se producen síntomas indistinguibles de la colangitis, colecistitis y colelitiasis de otros orígenes: cólicos biliares, dolor epigástrico, intolerancia a los alimentos grasos, náuseas, ictericia, prurito y flacidez del cuadrante superior derecho del abdomen. El aumento del tamaño del hígado puede ir asociado con el aumento del tamaño del bazo o ascitis. En caso de obstrucción, la vesícula biliar sufre agrandamiento y edema con engrosamiento de sus paredes; es frecuente su adhesión fibrosa con órganos adyacentes. A menudo se produce una litiasis de los conductos biliares o de la propia vesícula biliar; por consiguiente, los cálculos son generalmente pequeños y múltiples.[12]
Síntomas clínicos en animales
[editar]Los síntomas de la fascioliasis están siempre asociados a la dosis infecciosa (cantidad de metacercarias ingeridas). En las ovejas, el hospedador definitivo más común, los síndromes clínicos se dividen en cuatro tipos.[24][25]
- 1. Fascioliasis aguda de tipo I. Dosis infecciosa superior a 5.000 metacercarias ingeridas. Las ovejas mueren súbitamente sin síntomas previos, a lo sumo debilidad. Ascitis, hemorragia abdominal, ictericia, palidez de las membranas.
- 2. Fascioliasis aguda de tipo II. Dosis infecciosa entre 1.000 y 5.000 metacercarias ingeridas. Como en el caso anterior, las ovejas mueren, pero antes muestran palidez, deterioro físico y ascitis.
- 3. Fascioliasis subaguda. Dosis infecciosa entre 800 y 1.000 metacercarias ingeridas. Las ovejas muestran letargia, anemia y pueden morir. En síntoma característico es la pérdida de peso.
- 4. Fascioliasis crónica. Dosis infecciosa entre 200 y 800 metacercarias ingeridas. Asintomática o gradual pérdida de peso, ascitis (edema ventral) y emaciación.
En todos los tipos de fascioliasis puede darse anemia, hipoalbuninenia y eosinofilia.[25] En las facioliasis subaguda y crónica se constata una elevación de la actividad de las enzimas del hígado, como la glutamato deshidrogenasa, la gamma-glutamil transferasa y la lactato deshidrogenasa, después de 12 a 15 semanas de la ingestión de las metacercarias.[28][29] Los efectos económicos de la fascioliasis en ovejas son causados por la muerte de los animales y por la disminución de peso y de la producción de lana.[30][31]
En cabras y vacas, las manifestaciones clínicas son similares a las de las ovejas. No obstante, las vacas desarrollan resistencia a la infección de F. hepatica.[32][33] Las terneras pueden padecer la enfermedad, pero normalmente se necesitan más de 1.000 cercarias para causar fascioliasis clínica. En estos casos los síntomas son similares a los de las ovejas y se caracterizan por pérdida de peso, anemia, hipoalbumemia y, si la infección supera las 10 000 metacercarias, la muerte.[26] La importancia económica de la infección en las terneros consiste en pérdidas por la imposibilidad de comercializar el hígado y por la reducción de la ganancia de peso de los animales.[34]
En ovejas y a veces en vacas, el tejido hepático dañado puede infectarse por bacterias del género Clostridium (C. novyi tipo B) que libera toxinas en el torrente circulatorio originando la enfermedad negra, que no tiene cura y la muerte sibreviene rápidamente. Dado que la bacteria es común en el ambiente, la enfermedad negra se dan allí donde las ovejas y las Fasciola conviven.[35]
Resistencia a la infección
[editar]Los mecanismos de resistencia a la infección han sido estudiados por numerosos autores en diferentes animales. Estos estudios pueden ayudarnos a entender mejor la respuesta inmune del hospedador frente a F. hepatica y son necesarios para el desarrollo de una vacuna contra el parásito. Se ha demostrado que el ganado vacuno adquiere resistencia a F. hepatica y F. gigantica tras haber sido sensibilizado con el parásito primario o atenuado.[32] La resistencia a la fascioliasis ha sido también documentada en ratas.[36]
Por otra parte, ovejas y cabras no adquieren resistencia a la reinfección con F. hepatica.[37][38] Pero hay evidencias de que dos razas de oveja, en concreto la oveja de cola estrecha de Indonesia y la oveja roja Masái, son resistentes a F. gigantica.[39][40] No hay datos sobre la eventual resistencia en humanos.
Diagnóstico
[editar]
El diagnóstico de la fascioliasis en humanos se realiza examinando las deposiciones en busca de huevos del parásito, así como mediante las pruebas ELISA y Western blot.
El simple examen coprológico no es generalmente adecuado ya que los humanos manifiestan importantes síntomas clínicos mucho tiempo antes de que los huevos estén presentes en las heces. Además, en muchos infectados, los huevos de las duelas no se presentan en los excrementos, incluso tras múltiples exámenes fecales.[41][11] Es más, los huevos de F. hepatica, F. gigantica y Fasciolopsis buski (causante de la fasciolopsiasis) son morfológicamente indistinguibles.[41]
Por tanto, los métodos inmunológicos (ELISA y Western blot) son los más adecuados en el diagnóstico de la infección por F. hepatica. Estos tests se basan en la detección de anticuerpos específicos del parásito en el plasma del paciente. Los preparados antigénicos derivan primariamente de extractos de productos de excreción o secreción de las duelas adultas o a partir de fracciones parcialmente purificadas.[42] Recientemente se han usado antígenos recombinantes junto con antígenos nativos purificados.[43]
Los métodos basados en la detección de antígenos del suero o de las heces son menos frecuentes. Para completar el diagnóstico se realizan exámenes bioquímicos y hematológicos del suero (eosinofilia, aumento de las enzimas del hígado), así como ultrasonografías y RTG de la cavidad abdominal, biopsia del hígado y punción de la vesícula biliar.
La falsa fascioliasis es la presencia de huevos en las heces como resultado de la ingestión reciente de hígado contaminado con huevos; esta situación, que es una causa de falso diagnóstico positivo, puede evitarse sometiendo al paciente a una dieta libre de hígado durante varios días antes de repetir el examen fecal.[42]
Por lo que respecta a los animales, los métodos son similares a los usados en personas, a los que pueden añadir la situación epidemiológica, la estación del año, o el examen de los caracoles de la zona.[3][24] A igual que en humanos, el examen de las heces no es fiable, ya que los huevos no son detectables antes de 8-12 semanas después de la infección. En cambio, mediante métodos inmunológicos, es posible diagnosticar la fascioliasis tras 2-4 semanas de la infección. A pesar de ello, el análisis fecal es el único método que es posible usar en algunos países.[44][45]
Tratamiento y prevención
[editar]El tratamiento de la fascioliasis se realiza mediante antihelmínticos.
En humanos
[editar]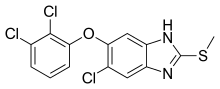
El antihelmíntico apropiado para los humanos, por su eficacia y seguridad, es el triclabendazol (Egaten), en dosis de 10–12 mg/kg.[46] También se ha usado la nitazoxanida en México,[47] así como el bitionol.[48] Es importante también el tratamiento preventivo, dejando de consumir berros de agua silvestres, principal fuente de transmisión.
En animales
[editar]Se usan numerosos fármacos para el control de la fascioliasis en animales, que difieren en su eficacia, modo de acción, precio y viabilidad; se denominan fasciolicidas y se clasifican en cinco grupos principales: [49]
- Fenoles halogenados: bitionol (Bitin), hexaclorofeno (Bilevon), nitroxinil (Trodax).
- Salicilanilidas: closantel (Flukiver, Supaverm), rafoxanida (Flukanide, Ranizole).
- Benzimidazoles: triclabendazol (Fasinex), albendazol (Vermitan, Valbazen), mebendazol (Telmin), luxabendazol (Fluxacur).
- Sulfonamidas: clorsulon (Ivomec Plus).
- Fenoxialcanos: diamphenetide (Coriban).
- Prazicuantel.
El triclabendazol se considera el mejor fármaco dada su alta eficacia, tanto contra las duelas adultas como frente a las juveniles. Se usa en el control de la fascioliasis en mucho países. No obstante, su uso continuado durante muchos años ha causado la aparición de cepas de F. hepatica resistentes; los primeros casos se dieron en Australia,[50] más tarde en Irlanda[51] y Escocia[52] y más recientemente en Holanda.[53]
Como consecuencia de ello, se está trabajando en el desarrollo de nuevos fármacos. Recientemente, se ha probado con éxito, tanto en ganado infectado de modo natural como experimental, un nuevo fasiolicida en México; se llama "compuesto alfa" y es químicamente muy similar al triclabendazol.[54]
Referencias
[editar]- ↑ Prevention, CDC-Centers for Disease Control and (24 de mayo de 2019). «CDC - Fasciola - Treatment». www.cdc.gov (en inglés estadounidense). Consultado el 16 de noviembre de 2022.
- ↑ a b c d Mas-Coma S, Bargues MD, Valero MA (octubre de 2005). «Fascioliasis and other plant-borne trematode zoonoses». Int. J. Parasitol. 35 (11-12): 1255-78. PMID 16150452. doi:10.1016/j.ijpara.2005.07.010.
- ↑ a b c d e Torgerson, P; Claxton J (1999). «Epidemiology and control.». En Dalton, JP, ed. Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 113–49. ISBN 0-85199-260-9.
- ↑ Spithill, T.W.; Smooker P.M.; Copeman D.B. (1999). «Fasciola gigantica: epidemiology, control, immunology and molecular biology». En Dalton, J.P., ed. Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 465–525. ISBN 0-85199-260-9.
- ↑ Anonymus 1995. Control of Foodborne Trematode Infections. WHO Technical Series No. 849. WHO, Geneva, 157 pp. ISBN 92-4-120849-X (Resumen)
- ↑ Cf. "Un parásito que ataca el hígado afecta a 400 personas en España", en El País' '25/6/2011 http://es.wikipedia.org/w/index.php?title=Fascioliasis&action=edit consultado 25 de junio de 2011.
- ↑ Carrada- Bravo, T. 2003. Fascioliasis. Diagnóstico, epidemiología y tratamientos. Rev. Gastroenterol. Mex., 68(2): 135-142
- ↑ Sakaguchi, Y., 1980. Karyotype and gametogenesis of the common liver fluke, Fasciola sp., in Japan. Jap. J. Parasitol. 29, 507–513.
- ↑ Itagaki T, Tsutsumi K (mayo de 1998). «Triploid form of Fasciola in Japan: genetic relationships between Fasciola hepatica and Fasciola gigantica determined by ITS-2 sequence of nuclear rDNA». Int. J. Parasitol. 28 (5): 777-81. PMID 9650058.
- ↑ Singh, K.P., Srivastava, V.K., Prasad, A. and Pandey, A.P., 1994. Pathology due to Fasciola jacksoni in Indian elephants Elephas indicus. Ind. J. Anim. Scien. 64, 802–804.
- ↑ a b c d e Chen, M.G., Mott, K.E., 1990. Progress in assessment of morbidity due to Fasciola hepatica infection: a review of recent literature. Trop. Dis. Bull. 87, R1–R38.
- ↑ a b c d e f g h Mas-Coma, S; Bargues, M.D., Esteban, J.G. (1999). «Human fasciolosis.». En Dalton, JP, ed. Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 411–34. ISBN 0-85199-260-9.
- ↑ a b c d Esteban, J.G., Bargues, M.D., Mas-Coma, S., 1998. Geographical distribution, diagnosis and treatment of human fascioliasis: a review. Res. Rev. Parasitol. 58, 13–42.
- ↑ Danis, M., Nozais, J.P., Chandenier, J., 1985. La distomatose à Fasciola hepatica, II: La fasciolose humaine en France. Action Vet. 907.
- ↑ Yilmaz, H,, Gödekmerdan, A. (octubre de 2004). «Human fasciolosis in Van province, Turkey». Acta Trop. 92 (2): 161-2. PMID 15350869. doi:10.1016/j.actatropica.2004.04.009.
- ↑ Demirci, M., 2003. Insanlarda epidemiyoloji. In: Tinar, R., Korkmaz, M. (Eds.), Fasciolosis. Türkiye Parazitoloji Derněgi, META Basim, Izmir, pp. 343–358 (in Turkish).
- ↑ GMA NEWS.TV, Rise in animal liver fluke cases alarms South Cotabato
- ↑ Mas-Coma, S., Rodriguez, A., Bargues, M.D., Valero, M.A., Coello, J., Angles, R., 1998. Secondary reservoir role of domestic animals other than sheep and cattle in fascioliasis transmission on the northern Bolivian Altiplano. Res. Rev. Parasitol. 57, 39–46.
- ↑ Mas-Coma, S., Fons, R., Feliu, C., Bargues, M.D., Valero, M.A., Galán-Puchades, M.T., 1988. Small mammals as natural definitive hosts of the liver fluke, Fasciola hepatica Linnaeus, 1758 (Trematoda: Fasciolidae): a review and two new records of epidemiologic interest on the island of Corsica. Rivista di Parassitologia, 5: 73–78.
- ↑ Menard, A., Agoulon, A., L’Hostis, M., Rondelaud, D., Collard, S., Chauvin, A., 2001. Myocastor coypus as a reservoir host of Fasciola hepatica in France. Vet. Res. 32, 499–508.
- ↑ Markell, E.K., Voge, M., 1999. Medical Parasitology, 8ª ed. Saunders Company Publication, pp. 185–188.
- ↑ Taira, N., Yoshifuji, H., Boray, J.C., 1997. Zoonotic potential of infection with Fasciola spp. by consumption of freshly prepared raw liver containing immature flukes. Int. J. Parasitol. 27, 775–779.
- ↑ Graczyk, T.K.; Fried B. (1999). «Development of Fasciola hepatica in the intermediate host.». En Dalton, J.P., ed. Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 31–46. ISBN 0-85199-260-9.
- ↑ a b c Dubinský, P., 1993. Trematódy a trematodózy. In: Jurášek, V., Dubinský, P. a kolektív, Veterinárna parazitológia. Príroda a.s., Bratislava, 158–187. (in Slovakian)
- ↑ a b c Behm, C.A., Sangster, N.C., 1999. Pathology, pathophysiology and clinical aspects. In: Dalton, J.P. (Ed.), Fasciolosis. CAB International Publishing, Wallingford, pp. 185–224.
- ↑ a b Boray J.C. (1969). «Experimental fascioliasis in Australia». Adv. Parasitol. 7: 95-210. PMID 4935272.
- ↑ Facey, R.V., Marsden, P.D., 1960. Fascioliasis in man: an outbreak in Hampshire. Brit. Med. J.2, 619–625.
- ↑ Anderson, P.H., Matthews, J.G., Berrett, S., Brush, P.J., Patterson, D.S., 1981. Changes in plasma enzyme activities and other blood components in response to acute and chronic liver damage in cattle. Res Vet Sci. 31, 1-4.
- ↑ Sykes, A.R., Coop, A.R., Robinson, M.G., 1980. Chronic subclinical ovine fascioliasis: plasma glutamate dehydrogenase, gamma glutamyl transpeptidase and aspartate aminotransferase activities and their significance as diagnostic aids. Res. Vet. Sci. 28, 71–78.
- ↑ Sinclair, K.B., 1962. Observations on the clinical pathology of ovine fascioliasis. Brit. Vet. J. 118, 37–53.
- ↑ Roseby, F.B. 1970. The effect of fasciolosis on the wool production of merino sheep. Aust. Vet. J. 46, 361–365.
- ↑ a b Haroun E.T., Hillyer G.V. (marzo de 1986). «Resistance to fascioliasis--a review». Vet. Parasitol. 20 (1-3): 63-93. PMID 3518218.
- ↑ Doyle, J.J., 1973. The relationship between the duration of a primary infection and the subsequent development of an acquired resistance to experimental infections with Fasciola hepatica in calves. Res. Vet. Sci., 14, 97-103.
- ↑ Phiri I.K., Phiri A.M., Harrison L.J. (noviembre de 2006). «Serum antibody isotype responses of Fasciola-infected sheep and cattle to excretory and secretory products of Fasciola species». Vet. Parasitol. 141 (3-4): 234-42. PMID 16797844. doi:10.1016/j.vetpar.2006.05.019.
- ↑ Merck Veterinary Manual - Infectious Necrotic Hepatitis. [1]
- ↑ van Milligen F.J., Cornelissen J.B., Bokhout B.A. (agosto de 1998). «Location of induction and expression of protective immunity against Fasciola hepatica at the gut level: a study using an ex vivo infection model with ligated gut segments». J. Parasitol. 84 (4): 771-7. PMID 9714209.
- ↑ Chauvin A., Bouvet G., Boulard C. (octubre de 1995). «Humoral and cellular immune responses to Fasciola hepatica experimental primary and secondary infection in sheep». Int. J. Parasitol. 25 (10): 1227-41. PMID 8557470.
- ↑ Martínez-Moreno A., Martínez-Moreno F.J., Acosta I., Gutiérrez P.N., Becerra C., Hernández S. (1997). «Humoral and cellular immune responses to experimental Fasciola hepatica infections in goats». Parasitol. Res. 83 (7): 680-6. PMID 9272558. Archivado desde el original el 11 de septiembre de 2001.
- ↑ Roberts J.A., Estuningsih E., Wiedosari E., Spithill T.W. (diciembre de 1997). «Acquisition of resistance against Fasciola gigantica by Indonesian thin tail sheep». Vet. Parasitol. 73 (3-4): 215-24. PMID 9477508.
- ↑ Wamae, L.W., 1996. Comparative pathogenesis and immunochemistry analysis of Fasciola gigantica infection in cattle and sheep. PhD Thesis. University of Edinburgh.
- ↑ a b Hillyer, G.V. (1988). «Fascioliasis and fasciolopsiasis.». En A. Turano; A. Balows; M. Ohashi, ed. Laboratory diagnosis of infectious diseases: principles and practices. 1: Bacterial, mycotic, and parasitic diseases. Berlin: Springer-Verlag. pp. 856-62. ISBN 0-387-96755-9.
- ↑ a b Hillyer, G.V. (1999). «Immunodiagnosis of human and animal fasciolosis.». En Dalton JP, ed. Fasciolosis. Wallingford, Oxon, UK: CABI Pub. pp. 435-47. ISBN 0-85199-260-9.
- ↑ O'Neill S.M., Parkinson M., Strauss W., Angles R., Dalton J.P. (abril de 1998). «Immunodiagnosis of Fasciola hepatica infection (fascioliasis) in a human population in the Bolivian Altiplano using purified cathepsin L cysteine proteinase». Am. J. Trop. Med. Hyg. 58 (4): 417-23. PMID 9574785.
- ↑ Zimmerman G.L., Jen L.W., Cerro J.E., Farnsworth K.L., Wescott R..B (diciembre de 1982). «Diagnosis of Fasciola hepatica infections in sheep by an enzyme-linked immunosorbent assay». Am. J. Vet. Res. 43 (12): 2097-100. PMID 7165155.
- ↑ Duménigo B.E., Espino A.M., Finlay C.M., Mezo M. (marzo de 2000). «Kinetics of antibody-based antigen detection in serum and faeces of sheep experimentally infected with Fasciola hepatica». Vet. Parasitol. 89 (1-2): 153-61. PMID 10729655.
- ↑ Savioli L., Chitsulo L., Montresor A. (1999). «New opportunities for the control of fascioliasis». Bull. World Health Organ. 77 (4): 300. PMID 10327707.
- ↑ Rossignol J.F., Abaza H., Friedman H. (1998). «Successful treatment of human fascioliasis with nitazoxanide». Trans. R. Soc. Trop. Med. Hyg. 92 (1): 103-4. PMID 9692168.
- ↑ Ramachandran, A., 2000. Pharmacology Recall.
- ↑ Fairweather I, Boray JC (septiembre de 1999). «Fasciolicides: efficacy, actions, resistance and its management». Vet. J. 158 (2): 81-112. PMID 10489266. doi:10.1053/tvjl.1999.0377.
- ↑ Overend D.J., Bowen F.L. (julio de 1995). «Resistance of Fasciola hepatica to triclabendazole». Aust. Vet. J. 72 (7): 275-6. PMID 8534235.
- ↑ O’Brien, D.J., 1998. Fasciolosis: a threat to livestock. Irish Vet. J. 51, 539–541.
- ↑ Mitchell G.B., Maris L., Bonniwell M.A. (octubre de 1998). «Triclabendazole-resistant liver fluke in Scottish sheep». Vet. Rec. 143 (14): 399. PMID 9802201.
- ↑ Moll L., Gaasenbeek C.P., Vellema P., Borgsteede F.H. (julio de 2000). «Resistance of Fasciola hepatica against triclabendazole in cattle and sheep in The netherlands». Vet. Parasitol. 91 (1-2): 153-8. PMID 10889368.
- ↑ Ibarra F., Vera Y., Quiroz H., et al (febrero de 2004). «Determination of the effective dose of an experimental fasciolicide in naturally and experimentally infected cattle». Vet. Parasitol. 120 (1-2): 65-74. PMID 15019144. doi:10.1016/j.vetpar.2003.12.005.
Enlaces externos
[editar]- Fascioliasis (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Fascioliasis en ovejas
- Fascioliasis: una causa infrecuente de eosinofilia
- Fascioliasis hepática que simularon tumores hepáticos
- Brote epidémico de fascioliasis invasiva
- Fascioliasis en la República Oriental del Uruguay Archivado el 12 de mayo de 2008 en Wayback Machine.
- Fascioliasis. Diagnóstico, epidemiología y tratamientos
- Center for Disease Control and Prevention - Fascioliasis (en inglés)
- Immunodiagnosis de la fasciolosis en el Altiplano Boliviano (en inglés)
- Fascioliasis Archivado el 10 de marzo de 2009 en Wayback Machine. (en inglés)
- Fotos de F. hepatica adultas
- Fotos de huevos de F. hepatica
 Wikcionario tiene definiciones y otra información sobre pirihuín.
Wikcionario tiene definiciones y otra información sobre pirihuín.
