Diferencia entre revisiones de «Éster»
Página reemplazada por «hola me llamo luis». |
m Revertidos los cambios de 190.40.106.86 a la última edición de Tirithel |
||
| Línea 1: | Línea 1: | ||
[[Imagen:Ester.svg|thumb|150px|Fórmula general de un éster]] |
|||
hola me llamo luis |
|||
En [[química]], los '''ésteres''' son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de [[hidrógeno]] (o más de uno) en un [[ácido oxigenado]]. Un ácido oxigenado es un ácido cuyas moléculas poseen un grupo [[hidroxilo]] (–OH) desde el cual el [[hidrógeno]] (H) puede disociarse como un ion [[protón]] (H<sup>+</sup>). Etimológicamente, la palabra "éster" proviene del [[idioma alemán|alemán]] '''Es'''sig-Ä'''ther''' (''éter de vinagre''), como se llamaba antiguamente al [[acetato de etilo]]. |
|||
Los ésteres más comunes son los ésteres carboxilados, donde el ácido en cuestión es un [[ácido carboxílico]]. Por ejemplo, si el ácido es el [[ácido acético]], el éster es denominado como [[acetato]]. Los ésteres pueden también ser formados por ácidos inorgánicos; por ejemplo, el sulfato de dimetilo, es un éster, a veces también llamado "éster dimetílico del [[ácido sulfúrico]]". |
|||
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados: |
|||
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta. |
|||
En [[bioquímica]] son el producto de la [[reacción química|reacción]] entre los [[ácido graso|ácidos grasos]] y los [[alcohol]]es. |
|||
En la formación de ésteres, cada radical OH ([[grupo hidroxilo]]) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del [[grupo carboxilo]], se combina con el OH sustituido, formando [[agua]]. |
|||
En [[química orgánica]] y [[bioquímica]] los '''ésteres''' son un [[grupo funcional]] compuesto de un radical [[orgánico]] unido al residuo de cualquier [[ácido]] [[oxígeno|oxigenado]], orgánico o inorgánico. |
|||
Los ésteres más comúnmente encontrados en la naturaleza son las [[grasa]]s, que son ésteres de [[glicerina]] y [[ácido graso|ácidos grasos]] ([[ácido oleico]], [[ácido esteárico]], etc.) |
|||
Principalmente resultante de la [[reacción de condensación|condensación]] de un [[ácido carboxílico]] y un [[alcohol]]. El proceso se denomina [[esterificación]]: |
|||
<center>[[Imagen:Esterification.png]]</center> |
|||
Un éster cíclico es una [[lactona]]. |
|||
== Nomenclatura == |
|||
O |
|||
|| |
|||
R1-C-R2 |
|||
etanoato de etilo |
|||
(proviene del ácido) (proviene del alcohol) |
|||
*Se cambia la terminación de los ácidos carboxílicos (-oico) por la terminación -oato de los ésteres (etanoico>etanoato) |
|||
*El caso de los ésteres consiste en dos cadenas separadas por un oxígeno. Cada una de estas cadenas debe nombrarse por separado y el nombre de los ésteres siempre consiste en dos palabras separadas del tipo alcanoato de [[alquilo]]. La parte del alcanoato se da a la cadena que tiene el grupo carbonilo. La parte alquílica del nombre se da a la cadena que no contiene el grupo carbonilo. Este procedimiento se utiliza sin importar el tamaño de la cadena. |
|||
== Propiedades físicas == |
|||
Los ésteres pueden participar en los [[enlace de hidrógeno|enlaces de hidrógeno]] como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más [[agua|hidro]][[soluble]]s que los [[hidrocarburo]]s de los que derivan. Pero las limitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre [[molécula]]s de '''ésteres''', lo que los hace más volátiles que un ácido o alcohol de similar peso molecular. |
|||
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo: |
|||
*[[butanoato de metilo]]: olor a [[Piña_(fruta)|Piña]] |
|||
*[[salicilato de metilo]] (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ ([[Reino Unido]]) |
|||
*[[octanoato de heptilo]]: olor a [[frambuesa]] |
|||
*[[etanoato de pentilo]]: olor a [[plátano]] |
|||
*[[pentanoato de pentilo]]: olor a [[manzana]] |
|||
*[[butanoato de pentilo]]: olor a [[pera]] o a [[Prunus armeniaca|albaricoque]] |
|||
*[[etanoato de octilo]]: olor a [[naranja (fruta)|naranja]]. |
|||
Los ésteres también participan en la [[hidrólisis]] esterárica: la ruptura de un éster por [[agua]]. |
|||
Los ésteres también pueden ser descompuestos por [[ácido]]s o [[base (química)|bases]] fuertes. Como resultado, se descomponen en un [[alcohol]] y un [[ácido carboxílico]], o una [[sal (química)|sal]] de un ácido carboxílico: |
|||
<center>[[Imagen:Ester hydrolysis.png]]</center> |
|||
== Propiedades químicas == |
|||
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: |
|||
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas. |
|||
[[Categoría:Grupos funcionales|Ester]] |
|||
[[Categoría:Ésteres| ]] |
|||
[[ar:إستر]] |
|||
[[bg:Естер]] |
|||
[[ca:Èster]] |
|||
[[cs:Estery]] |
|||
[[da:Ester]] |
|||
[[de:Ester]] |
|||
[[en:Ester]] |
|||
[[eo:Estero]] |
|||
[[et:Estrid]] |
|||
[[fa:استر (شیمی)]] |
|||
[[fi:Esteri]] |
|||
[[fr:Ester]] |
|||
[[he:אסטר]] |
|||
[[hr:Esteri]] |
|||
[[hu:Észterek]] |
|||
[[id:Ester]] |
|||
[[it:Esteri]] |
|||
[[ja:エステル]] |
|||
[[ko:에스터]] |
|||
[[la:Ester]] |
|||
[[lmo:Ester]] |
|||
[[lt:Esteriai]] |
|||
[[lv:Esteri]] |
|||
[[mk:Естер]] |
|||
[[ms:Ester]] |
|||
[[nl:Ester (chemie)]] |
|||
[[nn:Ester]] |
|||
[[no:Ester]] |
|||
[[oc:Estèr]] |
|||
[[pl:Estry]] |
|||
[[pt:Éster]] |
|||
[[ro:Esteri]] |
|||
[[ru:Сложные эфиры]] |
|||
[[sh:Estri]] |
|||
[[sk:Ester (chemická zlúčenina)]] |
|||
[[sl:Ester]] |
|||
[[sr:Estar]] |
|||
[[su:Éster]] |
|||
[[sv:Estrar]] |
|||
[[tr:Ester]] |
|||
[[uk:Складні ефіри]] |
|||
[[vi:Este]] |
|||
[[zh:酯]] |
|||
Revisión del 22:26 8 may 2009

En química, los ésteres son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado. Un ácido oxigenado es un ácido cuyas moléculas poseen un grupo hidroxilo (–OH) desde el cual el hidrógeno (H) puede disociarse como un ion protón (H+). Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.
Los ésteres más comunes son los ésteres carboxilados, donde el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres pueden también ser formados por ácidos inorgánicos; por ejemplo, el sulfato de dimetilo, es un éster, a veces también llamado "éster dimetílico del ácido sulfúrico". Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
Un éster cíclico es una lactona.
Nomenclatura
O
||
R1-C-R2
etanoato de etilo
(proviene del ácido) (proviene del alcohol)
- Se cambia la terminación de los ácidos carboxílicos (-oico) por la terminación -oato de los ésteres (etanoico>etanoato)
- El caso de los ésteres consiste en dos cadenas separadas por un oxígeno. Cada una de estas cadenas debe nombrarse por separado y el nombre de los ésteres siempre consiste en dos palabras separadas del tipo alcanoato de alquilo. La parte del alcanoato se da a la cadena que tiene el grupo carbonilo. La parte alquílica del nombre se da a la cadena que no contiene el grupo carbonilo. Este procedimiento se utiliza sin importar el tamaño de la cadena.
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las limitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- butanoato de metilo: olor a Piña
- salicilato de metilo (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- octanoato de heptilo: olor a frambuesa
- etanoato de pentilo: olor a plátano
- pentanoato de pentilo: olor a manzana
- butanoato de pentilo: olor a pera o a albaricoque
- etanoato de octilo: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
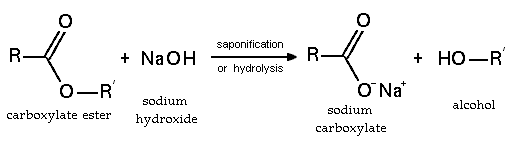
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
