Diferencia entre revisiones de «Terapia génica»
m Revertidos los cambios de 190.25.47.177 a la última edición de 190.209.38.186 |
|||
| Línea 261: | Línea 261: | ||
En Mayo del 2006, un equipo de científicos dirigidos por el Dr. Luigi Naldini y el Dr. Brian Brown del Instituto de San Raffaele Telethon contra la Terapia Génica (HSR-TIGET) en Milán, informaron de un avance para la terapia génica en el que se desarrolló una forma de prevenir que el sistema inmune pueda rechazar una entrada de genes. El grupo HSR-TIGET utilizó unos genes regulados por moléculas conocidas como microRNAs. Los investigadores del Dr. Naldini observaron que se podía utilizar esta función natural de los microRNA para desactivar selectivamente la identidad de sus genes terapéuticos en las células del [[sistema inmunológico]] y prevenir que el gen fuera encontrado y destruído. Se inyectó el gen que contiene una célula inmune con microARN en ratones y estos no rechazaron el [[gen]]. Este trabajo tiene implicaciones imortantes para el tratamiento de la [[hemofilia]] y otras enfermedades genéticas de la terapia génica. |
En Mayo del 2006, un equipo de científicos dirigidos por el Dr. Luigi Naldini y el Dr. Brian Brown del Instituto de San Raffaele Telethon contra la Terapia Génica (HSR-TIGET) en Milán, informaron de un avance para la terapia génica en el que se desarrolló una forma de prevenir que el sistema inmune pueda rechazar una entrada de genes. El grupo HSR-TIGET utilizó unos genes regulados por moléculas conocidas como microRNAs. Los investigadores del Dr. Naldini observaron que se podía utilizar esta función natural de los microRNA para desactivar selectivamente la identidad de sus genes terapéuticos en las células del [[sistema inmunológico]] y prevenir que el gen fuera encontrado y destruído. Se inyectó el gen que contiene una célula inmune con microARN en ratones y estos no rechazaron el [[gen]]. Este trabajo tiene implicaciones imortantes para el tratamiento de la [[hemofilia]] y otras enfermedades genéticas de la terapia génica. |
||
29 de Marzo del 2006 - Primera prueba clínica de terapia genica en EUA para distrofia muscular ahora en marcha |
|||
La prueba clínica para distrofia muscular Duchenne (DMD) evalúara la seguridad y la eficacia de una terapia que fue desarrollada durante dos décadas por científicos en la Escuela de Medicina de la Universidad de North Carolina en Chapel Hill y la Universidad de Pittsburgh. |
|||
La prueba fue iniciada el 28 de marzo, en el Hospital Infantil en Columbus, Ohio, una filial de la Escuela de Medicina de la Universidad Ohio State. En la prueba, seis niños con DMD recibirán genes de reemplazo para una proteina muscular esencial. |
|||
===2007=== |
===2007=== |
||
Revisión del 23:20 26 may 2009
La terapia génica o terapia felaupal consiste en la inserción de genes en las células de los tejidos de un individuo para tratar una enfermedad en general, y enfermedades hereditarias en particular, así como para realizar una marcaje. La terapia génica consiste en la introducción de una copia funcional normal de un gen defectivo o ausente en el genoma de un individuo con el objetivo de restaurar la función normal de la célula y así eliminar los síntomas de la enfermedad.Aunque todavía está en desarrollo (motivo por el cual su aplicacón se lleva a cabo dentro de ensayos clínicos controlados), se ha utilizado con cierto éxito. La terapia antisense no es estrictamente una forma de terapia génica, sino una terapia guiada genéticamente que a menudo se utiliza con otros métodos. A pesar de que en un principio fue una técnica planteada exclusivamente con el fin de tratar enfermedades genéticas, lo cierto es que en la actualidad se propone para casi cualquier enfermedad, siendo un mecanismo de lo más prometedor.
En los años 80, los avances en biología molecular habían permitido que genes humanos fuesen ordenados y reproducidos. Científicos que buscaban un método sencillo de producir las proteínas - tales como insulina, por deficit de la mólecula en la diabetes tipo 1 - introduciendo genes humanos en el ADN bacteriano. Las bacterias modificadas entonces producían la proteína correspondiente, pudiendo ser cultivada e inyectada en pacientes que no podían producirla de forma natural.
El 14 de septiembre de 1990, investigadores de los institutos nacionales de salud de los E.E.U.U. realizaron el primer procedimiento aprobado de terapia génica en un paciente de cuatro años, Cristobal Fetobal, el cual presentaba una enfermedad genética rara denominada inmunodeficiencia combinada severa (SCID), caracterizada por la ausencia de un sistema inmune competente, por lo que era vulnerable a cualquier infección. Los niños con esta enfermedad desarrollan generalmente graves infecciones y raramente llegan a la edad adulta, de tal manera que enfermedades infantiles comunes como la varicela son peligrosas para su supervivencia. fetobal tenía que estar aislado, ya que debía evitar todo contacto con personas ajenas a su familia, mantener un ambiente estéril de su hogar, y combatir las infecciones con gran cantidad de antibióticos.
Aplicaciones
-Marcado genético: El marcado genético no pretende la curación del paciente sino que se usa para mejorar el tratamiento de una determinada patología. Un ejemplo de ello sería la puesta a punto de vectores para ensayos clínicos.
-Terapia de enfermedades monogénicas hereditarias: Se usa en aquellas enfermedades metabólicas en las que no se puede o no es eficiente la administración de una proteína deficitaria. Se proporciona el gen defectivo o ausente.
-Terapia de enfermedades adquiridas: Entre este tipo de enfermedades la más destacada es el cáncer. Se usan distintas estrategias, como la inserción de determinados genes suicidas en las células tumorales o la inserción de antígenos tumorales para potenciar la respuesta inmune.
Procedimiento
En el procedimiento de la terapia génica de fetobal, los doctores extrajeron los glóbulos blancos del cuerpo del niño, dejaron las células crecer en el laboratorio, insertando el gen que faltaba en las células, y después introdujeron los glóbulos blancos modificados genéticamente dentro de la circulación sanguínea del paciente. Las pruebas de laboratorio han demostrado que la terapia consolidó el sistema inmune de Ashanthi; ya que no volvieron a aparecer infecciones recurrentes, pudiendo asistir a la escuela, llevando una vida normal e incluso ser vacunado contra tos ferina. Este procedimiento no era curativo, ya que los glóbulos blancos tratados genéticamente solamente son eficaces durante algunos meses, después de los cuales, el proceso debía ser repetido (VII, Thompson [primer] 1993).
Aunque esta explicación simplificada del procedimiento de la terapia génica fue todo un éxito, no supuso más que un primer capítulo optimista en una larga historia; el camino al primer procedimiento aprobado de la terapia génica era complicado y cargado de controversia.
Los científicos intentaron introducir genes directos a las células humanas, centrándose en las enfermedades causadas por defectos de un solo gen, tales como fibrosis quística, hemofilia, distrofia muscular y anemia falciforme. Sin embargo, este proceso ha sido mucho más complicado que el realizado en bacterias modificadas, sobre todo debido a los problemas derivados del paso de secciones grandes del ADN a un lugar del genoma humano comparativamente más grande.
En la mayoría de los estudios de la terapia génica, un gen “normal” se inserta en el genoma para substituir un “anormal". Un portador llamado vector se utiliza para entregar el gen terapéutico a las células diana del paciente. Actualmente, el tipo más común de vector son virus que genéticamente se han alterado para llevar el ADN normal del ser humano. Los virus han desarrollado formas de encapsular y entregar sus genes a las células humanas de un modo patógeno. Los científicos han intentado reproducir esta capacidad manipulando el genoma viral para quitar los genes causantes de la enfermedad e insertar los terapéuticos.
Las células diana tales como las células del hígado o del pulmón del paciente se infectan con el vector. El vector entonces descarga su material genético que contiene el gen humano terapéutico en la célula diana. La generación de un producto funcional de la proteína codificada por el gen terapéutico restaura la célula diana a un estado normal.
Logros
En teoría es posible transformar las células somáticas (la mayoría de las células del cuerpo) o las células del germinales (tales como gametos, y sus precursores). Toda la terapia génica humana se ha centrado hasta ahora en las células somáticas, mientras que su utilización en células germinales en seres humanos sigue siendo solamente una perspectiva altamente polémica. Para que el gen introducido sea transmitido normalmente al descendiente, necesita no sólo ser insertado en la célula, sino también ser incorporado en los cromosomas por recombinación genética.
La terapia génica somática se puede dividir en dos categorías: ex vivo (donde las células se modifican fuera del cuerpo y después se trasplantan otra vez) e in vivo (donde los genes se modifican directamente en células en el cuerpo).
Hay una variedad de diversos métodos para sustituir o para reparar los genes alterados en la terapia génica.
Un gen normal se puede insertar en una localización no específica dentro del genoma para sustituir un gen no funcional. Este acercamiento es el más común. Un gen anormal se podría intercambiar por un gen normal con la recombinación homóloga. El gen anormal se podría reparar con la mutación reversa selectiva, que vuelve el gen a su función normal. La regulación (el grado por el cual un gen se activa o inactiva) ...
Normas para recibir la terapia génica
Las normas para recibir terapia génica están bien establecidas e incluyen varios requisitos:
- El gen debe estar aislado y debe estar disponible para la transferencia, normalmente por clonación.
- Debe haber un medio efectivo para la transferencia del gen. Por el momento, muchos ensayos utilizan vectores retrovíricos, aunque también se emplean otros métodos, como los vectores adenovíricos y las técnicas físicas y químicas.
- El tejido diana debe ser accesible para la transferencia genética. La primera generación de procesos de terapia génica utiliza glóbulos blancos o sus precursores como tejido diana.
- No debe haber ninguna forma de terapia efectiva disponibles, y la terapia génica no debe dañar al paciente.
Enfermedades tratadas por terapia génica
Aunque originalmente la terapia génica se desarrolló para tratar enfermedades debidas a un único gen (monogénicas), esta técnica se adaptó rápidamente para tratar enfermedades adquiridas como el cáncer y enfermedades infecciosas como el VIH. Actualmente se están tratando también varias enfermedades hereditarias, como la inmunodeficiencia combinada grave (SCDI, del inglés Severe Combined Inmunodeficiency), la hipercolesterolemia familiar, la fibrosis quística y la distrofia muscular, entre otras.
Felaupa vacuolar falciforme
Consiste en la insercion de genes debido a la accion felaupal en el sistema reproductor. Para llevar a cabo la cura de esta enfermedad se utiliza un vector llamado virus felaupal vacuolar el cual se inserta en el sistema reproductor del individuo y permite asi, la normal función de dicho sistema.
Fibrosis quística
En la fibrosis quística (CF, del inglés cystic fibrosis), una delección denominada ∆508 (mutación) se encuentra en el 70 por ciento de todas las copias mutantes del gen. La CF es una enfermedad autosómica recesiva asociada a un defecto en una proteína denominada Regulador de la Conductancia Transmembrana de la Fibrosis Quística (CFTR), que regula el transporte de iones por la membrana plasmática. La CF afecta aproximadamente a 1 de cada 2000 personas descendientes del norte de Europa. Uno de los vectores que más se han utilizado en la lucha contra la fibrosis ha sido el retroviral o retrovírico. Un ADNc para el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR) era construido por el solapamiento de tres clones ADNc, y un ADNc completo era clonado en un vector retroviral. Las células CF eran infectadas por dicho vector, que llevaba un gen CFTR, y la célula con el “virus”, expresaban el gen CFTR.
Experimentos mostraron que las corrientes de cloro (uno de los iones que atraviesan la membrana) se detectaban únicamente en las células CF con CFTR. Significativamente, la respuesta de las células CF con CFTR es comparable con las respuestas traqueales humanas normales y alienta la esperanza de que la terapia génica sea efectiva en la fibrosis quística, usando vectores retrovirales directamente sobre el epitelio pulmonar por medio de aerosoles.
Hipercolesterolemia
Es una enfermedad hereditaria causada por mutaciones en el receptor de la lipoproteína de baja densidad (LDLR), y aquellos pacientes que son homocigotos para la mutación del gen de LDLR generalmente mueren por un ataque al corazón antes de los 20 años. En este experimento, los vectores retrovirales que llevan el gen para el LDLR humano se usan para infectar cultivos de hepatocitos (células del tejido del hígado). Se obtuvieron así líneas celulares que eran capaces de degradar las lipoproteínas de baja densidad a un nivel más o menos normal. Hasta ahora este experimento sólo se ha utilizado en cultivos celulares, aunque es uno de los más seguros a probar en individuos.
Inmunodeficiencia Combinada Severa (SCID)
La terapia génica empezó en 1990 con el tratamiento de una niña llamada Ashanti De Silva que padecía la enfermedad.
Las personas afectadas no tiene un sistema inmunitario funcional y normalmente mueren de infecciones leves. Ashanti tenía una forma autosómica de SCID, y se debe a un defecto en el gen que codifica la enzima adenosina desaminasa (ADA). Su terapia génica comenzó con el aislamiento de un tipo de glóbulos blancos, denominados células T. Estas células, que formaban parte del sistema inmunitario, se mezclaron con el vector retrovírico que llevaba una copia del gen ADA normal insertada. El virus infectó muchas de las células T, y una copia normal del gen ADA se insertó en el genoma de algunas de ellas. Después de mezclar estas células con el vector y de producirse la infección, las células T se cultivaron en el laboratorio y se analizaron para asegurar que el gen ADA transferido se expresaba. El último paso de esta terapia génica fue la inyección de mil millones de estas células T, genéticamente modificadas, en su torrente sanguíneo. Algunas de estas células T emigraron hasta la médula ósea de Ashanti, y empezaron a dividirse y a producir ADA. Del 25% al 30% de las células T de Ashanti expresaban la proteína ADA, lo cual es suficiente para permitirle llevar una vida normal. Otro ejemplo es el de David, "niño burbuja", que tuvo que vivir en su cámara estéril para evitar cualquier riesgo de infección ya que su sistema inmune no produce defensas al tener la mutación del gen que codifica para la enzima adenosin desaminasa.
Distrofia Muscular de Duchenne
La Distrofia Muscular de Duchenne (DMD) es una enfermedad genética que comienza en la infancia temprana, causando la pérdida progresiva de la fuerza y volumen muscular. Aparece cuando un gen en el cromosoma X deja de fabricar la proteína muscular esencial, la distrofina. Este gen es uno de los más grandes en el cuerpo humano (ocupa casi un 1% del cromosoma X).
El 28 de Marzo del 2006, en el Hospital Infantil en Columbus, Ohio, se inició un ensayo en seis niños con DMD, que recibieron genes de reemplazo para la proteína muscular esencial vía inyección en el bíceps de un brazo. Esta terapia se desarrolló a partir de virus adeno-asociados, diseñados para llevar específicamente el gen de distrofina a las células musculares.

Cáncer
Los tratamientos habituales para esta enfermedad han sido la quimioterapia y la radioterapia. La terapia génica se va a presentar como una posible arma para la actuación contra esta enfermedad. Fundamentalmente, la terapia génica se va a enfocar a la estimulación de la inmunidad natural hacia las células tumorales, eliminarlas o inferir en su crecimiento con drogas, insertar un gen supresor de tumores o frenar la resistencia a medicamentos. Se usan virus con ciclo lítico y se hace que se activen sólo en células tumorales, con la ayuda de promotores que solo sean activados en estos casos. Si infectan células normales, este promotor no podrá ser activado y el gen introducdo no se activará. Pero puede darse otro caso, y es que para que se lleve a cabo el ciclo lítico sea necesario la expresión de determinados genes tumorales. En el segundo caso, se pone bajo un promotor de la célula tumoral, un gen que exprese una enzima toxica. Esta enzima matará a la célula que la contiene y además saldrá al exterior eliminando las células vecinas, que posiblemente sean tumorales también.
==Los vectores en la terapia génica
La gran diversidad de situaciones en las que podría aplicarse la terapia génica hace imposible la existencia de un solo tipo de vector. Sin embargo, pueden definirse características para un "vector ideal" y adaptarlas luego a situaciones concretas: - Reproducibe - Estable - Que permita la inserción de material genético sin límite de tamaño - Que permita la transducción tanto en células en división como quiescentes - Que posibilite la integración específica de un gen terapeútico - Que reconozca y actúe sobre células específicas - Que la expresión del gen terapeútico pueda ser regulada - Que carezca de elementos que induzcan una respuesta inmune - Que pueda ser caracterizado completamente - Inocuo. Que minimice sus posibles efectos secundarios. - Fácil de producir y almacenar - Coste razonable
El sistema consta del "vector" propiamente dicho, que es el medio de transporte, y el "cargo", el material transportado. Éste último consta a su vez de dos componentes: El "efector", que es el gen que se pretende introducir, y el "soporte", que son los elementos que controlan la expresión de dicho gen. El más importante es el promotor, pero puede haber otros: potenciadores y represores, secuencias de aislamiento, de integración, de empaquetamiento, de recombinación homóloga, secuencias inmunoestimulantes,...
Existen dos tipos de vectores para hacer terapia génica: vectores virales y vectores no virales. Los vectores virales presentan una alta eficiencia de transformación, pero una baja especificidad de tejido –infectan toda célula que tenga receptores para los virus usados-. Por el contrario, los vectores no virales son altamente específicos de tejido –inyectamos ADN desnudo o protegido con diversas moléculas directamente en el tejido que queremos infectar- pero su eficiencia de transformación es baja.
Virus
Todos los virus se unen a sus hospedadores e introducen su material genético en la célula huésped como parte de su ciclo de replicación. Este material genético contiene “instrucciones” básicas de cómo producir más copias de estos virus, haciendo que el cuerpo normal se convierta en una maquinaria que sirva para cubrir las necesidades de los virus. La célula huésped llevará a cabo estas instrucciones y producirá copias adicionales del virus. Esto conllevará a un mayor número de células infectadas. Algunos tipos de virus insertan sus genes físicamente en el genoma del huésped (una característica típica de los retrovirus, como el VIH, que introduce la enzima transcriptasa inversa en el hospedador y además usa su ARN para dar las “instrucciones”). Esto hace que se mezclen los genes del virus con los genes de la célula huésped durante la vida de dicha célula.
Doctores y biólogos moleculares han observado que los virus de este tipo pueden ser utilizados como vehículos para transportar genes “benignos” en una célula humana. Para ello, en el laboratorio, se eliminarían de los virus los genes que causan la enfermedad y luego se sustituyen por los genes que codifican el efecto deseado (por ejemplo, la producción de insulina en el caso de los diabéticos). Este procedimiento debe hacerse de tal manera que los genes que inserta el virus junto con el genoma del hospedador permanezcan intactos. Esto puede ser confuso, y requiere una importante investigación y el conocimiento de los genes de los virus para saber la función de cada uno. Todo esto es una simplificación, ya que existen numerosos problemas que impiden que la terapia génica tenga éxito mediante el uso de vectores virales, tales como: dificultad para la prevención de los efectos, hay que asegurar que el virus infecta las células del cuerpo y que el gen insertado no perturbe cualquier otro gen vital del genoma. Sin embargo, este modo de introducción de genes muestra muchas expectativas y tanto médicos como científicos están trabajando para solucionar los posibles problemas que pudieran existir.
Retrovirus
El material genético en los retrovirus es en la forma de moléculas de RNA, mientras que el de sus hospedadores es de ADN. Cuando un retrovirus infecta a una célula huésped, introduce su ARN junto con algunas enzimas, principalmente la transcriptasa inversa (RT) y la integrasa (IN). Esta molécula de ARN debe producir una copia de ADN de su molécula de ARN para poder ser integrada en el material genético de la célula del huésped. El proceso de producir una copia de ADN a partir de una molécula de ARN se denomina transcripción inversa. Se lleva a cabo por una de las enzimas transportadas en el virus, llamada transcriptasa inversa. Después de que esta copia de ADN se encuentra libre en el núcleo de la célula huésped, debe ser incorporada al genoma. Este proceso se realiza gracias a la enzima integrasa del virus. El genoma viral contiene básicamente tres regiones, gag, pol y env, que codifican para las proteínas de la cápsida, las proteínas víricas (RT, IN y proteasa) y proteínas de la envuelta. Estas tres regiones están flanqueadas por dos largas secuencias repetidas terminales o LTRs, indispensables para el inicio de la síntesis del ADN vírico, su integración y la regulación de su expresión. Para usar los retrovirus como vectores víricos para terapia génica se eliminan los genes responsables de su replicación y se reemplazan estas regiones gag, pol y env por el transgén seguido de un gen marcador (para detectar las células infectadas). Del genoma vírico quedan sólo las terminaciones LTR y la región psi, que precede a gag. Así se crean los vectores retrovirales genómicos (VRGs). ¿Cómo producirlos a gran escala ahora si carecen de los genes necesarios para ello? Introduciéndolos en líneas celulares empaquetadoras, que contienen plásmidos ayudantes con las secuencias gag, pol y env. Las secuencias gag-pol (no pueden separarse) y env se aportan en plásmidos separados para reducir los riesgos de que se produzcan virus capaces de replicarse por recombinación entre los distintos fragmentos. Al usar tres plásmidos distintos (gag-pol, env y el VRG) se necesitan tres eventos de recombinación homóloga para producir virus que sean capaces de replicarse. Es poco probable que esto ocurra. Últimamente se está estudiando el uso de vectores que auto-inactivan sus secuencias LTRs una vez se han integrado en el genoma de la célula diana. Esto evita que se empaqueten las secuencias integradas en el caso de que se produjera en el organismo una infección por retrovirus, con la consecuente dispersión del virus que hay integrado por el organismo y su infección a otras células no específicas.
Una vez que el material genético del retrovirus se incorpora y se ha convertido en parte del material genético de la célula huésped, si esta se divide después, sus descendientes contendrán todos los nuevos genes. Aunque algunas veces los genes de los retrovirus no se expresan inmediatamente. Uno de los problemas de la terapia génica con la utilización de retrovirus es que la enzima integrasa puede insertar material genético de los retrovirus en posiciones no arbitrarias en el genoma del huésped, y si el material genético se inserta en medio de un gen original, este gen se verá perturbado (mutagénesis de inserción). Si por ejemplo, el gen regula la división de la célula, ésta se verá descontrolada. Ensayos de terapia génica utilizando vectores retrovirales para tratar la inmunodeficiencia combinada grave ligada al cromosoma X (X-SCID) representan la aplicación más exitosa de la terapia hasta la fecha. Así, más de veinte pacientes han sido tratado en Francia y Gran Bretaña, con una alta tasa de reconstitución del sistema inmunitario. Sin embargo, ensayos similares fueron restringidos en los Estados Unidos cuando se informó de la aparición de leucemia en pacientes. Hasta hoy se conocen cuatro casos de niños franceses y uno británico que han desarrollado leucemia como resultado de mutagénesis por inserción de los vectores retrovirales, y todos menos uno de estos niños respondieron bien al tratamiento convencional contra la leucemia. En la actualidad, la terapia génica para tratar SCID continúa siendo exitosa en USA, Gran Bretaña, Italia y Japón.
Adenovirus
Son virus que llevan su material genético en forma de doble cadena de ADN. Causan infecciones humanas respiratorias, intestinales y otras que afectan a los ojos (especialmente el resfriado común). Cuando estos virus infectan a la célula huésped, introducen su molécula de ADN. El material genético de los adenovirus no es incorporado en el material genético del hospedador. La molécula de ADN permanece libre en el núcleo del huésped y las instrucciones en la molécula de ADN extra se transcriben como cualquier otro gen. La única diferencia es que estos genes extra no se replican cuando la célula está a punto de experimentar la división celular, de modo que los descendientes de las células no tienen el gen extra. Como resultado, el tratamiento con el adenovirus requerirá una creciente población de células, sin embargo, la ausencia de éste en el genoma del hospedador debería prevenir la mutagénesis de inserción.
Virus Adenoasociados (VAA)
Son pequeños virus con un genoma de ADN monocatenario. Pueden insertar material genético en un lugar específico en el cromosoma 19, con casi un 100% de certeza. Sin embargo, el VAA recombinante, que no contiene ningún gen viral, solo el gen terapéutico, no se integra en el genoma. En su lugar, el genoma vírico recombinante fusiona sus extremos a través del ITR (repeticiones terminales invertidas), apareciendo recombinación de la forma circular y episomal que se predice que pueden ser la causa de la expresión génica a largo plazo. Podemos encontrar ciertas desventajas con la utilización del VAA, como la pequeña cantidad de ADN que puede llevar (baja capacidad) y la dificultad en su elaboración. Este tipo de virus está siendo utilizado, sin embargo, porque es un virus no patógeno (la mayoría de las personas son portadoras de este virus inofensivo). A diferencia de los adenovirus, en la mayoría de los pacientes tratados con VAA no aparecen respuestas inmunes para eliminar el virus ni las células con las que han sido tratados. Muchos ensayos con VAA están en curso o en preparación, principalmente en el tratamiento de músculos y enfermedades oculares, los dos tejidos donde el virus parece ser particularmente útil. Sin embargo, se están comenzando a realizar pruebas clínicas, donde vectores del VAA son utilizados para introducir los genes en el cerebro. Esto es posible porque VAA pueden infectar células quiescentes (que no se dividen), tales como las neuronas.
Herpes virus
Son virus de ADN cuyas células diana son las neuronas. Su complejidad y lo poco que todavía conocemos de esta familia de virus, dificulta su utilización. La gran ventaja es el gran tamaño de su ADN, que les permite aceptar varios genes terapéuticos. Uno de los inconvenientes es que habría que eliminar las secuencias que codifican las proteínas líticas del virus que causa la muerte de las células a las que infecta.
Proteína "pseudotyping" de vectores virales
Los vectores virales descritos anteriormente tienen poblaciones naturales de células huésped que ellos infectan de manera eficiente. Los retrovirus presentan limitados los tipos naturales de hospedadores, y aunque los adenovirus y virus adeno-asociados son capaces de infectar a un amplio rango de células de manera eficiente, algunos tipos de células son refractarias a la infección por estos virus. El ataque para entrar en una célula está mediado por la proteína de envoltura de la superficie de un virus. Los retrovirus y virus adeno-asociados tienen una única proteína de revestimiento en la membrana, mientras que lo adenovirus están recubiertos con una envoltura de proteínas y fibras que se extiende fuera de la superficie del mismo. La envoltura de proteínas de cada uno de estos virus se une a las moléculas de la superficie de la célula, tales como heparina, la cual se localiza sobre la superficie de células hospedadoras potenciales, así como proteínas específicas de receptor que también induce a cambios estructurales en la proteína del virus, o localiza el virus en endosomas, donde la acidificación le lleva a éste a replegar su revestimiento. En cualquier caso, la entrada en las células huésped requiere una interacción favorable entre una proteína de la superficie del virus, y una proteína de la superficie de la célula. Por la finalidad de la terapia génica, se podría limitar o expandir el rango de células susceptibles a la transducción por un vector de la terapia génica. Por ello, se han desarrollado muchos vectores, en los cuales la cubierta vírica de proteínas ha sido remplazada por otros revestimientos proteicos de otros virus, o por proteínas quiméricas. Esta quimera constará de las partes de la proteína vírica necesaria para su incorporación en el virión, así como las secuencias, supuestamente, a interacturar con receptores específicos de proteínas celulares. Los virus en los cuales el revestimiento proteico ha sido remplazado como se ha descrito, son denominados virus pseudotyped. Por ejemplo, el vector más popular retrovírico para el uso en pruebas de terapia génica ha sido el lentivirus, virus de la inmunodeficiencia de Simian, revestido con la cubierta de proteínas G del virus de la estomatitis vesicular. Este vector se conoce como VSV y puede infectar a casi todas las células, gracias a la proteína G con la cual este vector es revestido. Se han hecho muchos intentos para limitar el tropismo (capacidad de infectar a muchas células) de los vectores virales para una o varias poblaciones de una célula huésped. Este avance podría permitir la administración sistemática de una cantidad relativamente pequeña del vector. La mayoría de los intentos han utilizado proteínas quiméricas para la envuelta, la cuales incluían fragmentos de anticuerpos. Así, estos vectores pseudotyped parecen ser una gran promesa para el descubrimiento de la “bala mágica” en las terapias génicas.

Métodos no virales
Estos métodos presentan ventajas sobre los métodos virales, con una simple producción a gran escala y una baja inmunogenicidad. Anteriormente, los bajos niveles de transfección y expresión del gen mantenían a los métodos no virales en una situación de desventaja; sin embargo, los recientes avances en la tecnología de vectores han producido moléculas y técnicas de transfección con eficiencias similares a las de los virus.
ADN desnudo
Éste es el método más simple de la transfección no viral. Consiste en la inyección intramuscular de por ejemplo, un plásmido con ADN desnudo. Varios de estos ensayos dieron resultados exitosos. Sin embargo, la expresión ha sido muy baja en comparación con otros métodos de transfección, tiene una talla ilimitada, no se integra en el genoma, y no amplifica el ADN. Además de los ensayos con plásmidos, se han realizado ensayos con productos de PCR, y se ha obtenido un éxito similar o superior. Este logro, sin embargo, no supera a otros métodos, lo que a llevado a una investigación con métodos más eficientes de ADN desnudo, tales como la electroporación, sonoparción, o el uso de un “cañón de genes”, que dispara partículas de oro recubiertas de ADN hacia la célula utilizando altas presiones de gas.
Oligonucleótidos
El uso de oligonucleótidos sintéticos en la terapia génica consiste en la inactivación de los genes implicados en el proceso de la enfermedad. Hay varios métodos por los cuales esto se logra. Una estrategia, utiliza oligonucleótidos antisentido específicos para el gen diana y para alterar la transcripción del gen defectuoso. Otra, hace uso de moléculas pequeñas de ARN llamadas siARN para señalar la célula a la que se adhieren secuencias específicas y únicas en la transcripción de ARN mensajero de un gen defectuoso, alterando la traducción de los ARNm defectuosos, y por tanto la expresión del gen. Otra estrategia utiliza oligodesoxinucleótidos como un señuelo para los factores de transcripción que se requieren en la activación de la transcripción de los genes objetivo. Los factores de transcripción se unen a los señuelos en lugar de al promotor del gen defectuoso, lo que reduce la transcripción de los genes objetivo, y de expresión. Además, oligonucleótidos de ADN de una sola cadena, han sido utilizados para dirigir el cambio de un única base dentro de un gen mutante.
Lipoplexes y poliplexes
Para mejorar la introducción de un nuevo ADN en la célula, éste debe ser protegido de cualquier daño y su entrada en la célula debe estar facilitada. Para este fin, nuevas moléculas, como liposomas y polisomas han sido creadas, y tienen la habilidad de proteger el ADN de la degradación durante el proceso de transfección. El ADN de plásmidos, puede ser cubierto por lípidos formando una estructura organizada, como una micela o un liposoma. Cuando la estructura organizada forma un complejo con el ADN entonces se denomina lipoplexe. Hay tres tipos de lípidos: aniónicos (cargados negativamente), neutros, o catiónicos (cargados positivamente). Inicialmente, lípidos aniónicos y neutros eran utilizados en la construcción de lipoplexes para vectores sintéticos. Sin embargo, estos son relativamente tóxicos, incompatibles con fluidos corporales y presentan la posibilidad de adaptarse a estar en un tejido específico. Además, son complicados y requieren tiempo para producirlos, por lo que la atención se dirigió a las versiones catiónicas. Los lípidos catiónicos, debido a su carga positiva, fueron los primeros usados para condensar negativamente moléculas de ADN cargadas, de tal forma que facilitara el encapsular ADN en liposomas. Más tarde, se constató que el uso de lípidos catiónicos mejoraba la estabilidad de los lipoplexes. Además, como resultado de su carga, los liposomas catiónicos interactúan con la membrana celular, y la endocitosis se cree que es la principal vía por la que las células absorben los lipoplexes. Los endosomas se forman como resultado de la endocitosis. Sin embargo, si los genes no pueden liberarse al citoplasma por rotura de la membrana del endosoma, ellos enviarán los liposomas y todo el ADN será destruído antes de que los genes puedan lograr sus funciones. También se averiguó que aunque lípidos catiónicos por ellos mismos podían condensar y encapsular ADN en los liposomas, la transfección eficiente es baja, debido a la falta de habilidad en el “escape endosomal”. Sin embargo, cuando “lípidos de ayuda” (normalmente lípidos electroneutrales, tales como DOPE) fueron añadidos para formar lipoplexes, se observó una transfección eficiente. Posteriormente, fue descubierto que ciertos lípidos tienen la capacidad de desestabilizar la membrana del endosoma, para facilitar la fuga del ADN, y estos lípidos se denominaron lípidos fusogénicos. Aunque liposomas catiónicos han sido utilizados como una alternativa para la entrega de genes en los vectores, la dosis depende de la toxicidad de los lípidos catiónicos, y se observó que podrían limitar sus funciones terapéuticos. El uso más común de los lipoplexes ha sido en la transferencia de genes en las células cancerosas, donde los genes suministrados han activado los genes supresores del tumor en la célula y han disminuido la actividad de los oncogenes. Estudios recientes han mostrado que lipoplexes son útiles en las células epiteliales del sistema respiratorio, por lo que pueden ser utilizados para el tratamiento genético de las enfermedades respiratorias como la fibrosis quística. Los complejos de polímeros de ADN se denominan poliplexes y la mayoría consisten en polímeros catiónicos, regulados por interacciones iónicas. Una gran diferencia entre los métodos de acción de poliplexes y lipoplexes es que poliplexes no pueden liberar su ADN cargado al citoplasma.
Métodos híbridos
Debido a muchos métodos de transferencia de genes que presentan deficiencias, se han desarrollado algunos métodos híbridos que combinan dos o más técnicas. Los virosomas son un ejemplo, y combinan liposomas con el virus inactivado VIH o el virus de la gripe. Esto ha demostrado tener mayor transferencia de genes eficientes en células epiteliales del sistema respiratorio, que cualquier otro método vírico o liposomal. Otros métodos implicados mezclan vectores víricos con lípidos catiónicos o virus hibridados.
Dendrímeros
Un dendrímero es una macromolécula muy ramificada con forma esférica. La superficie de la partícula puede ser funcional de muchas formas y algunas de sus propiedades derivadas de su construcción están determinados por su superficie. En particular, es posible construir un dendrímero catiónico, es decir, con carga superficial positiva. Con la presencia de material genético como ADN o ARN, dirigen su carga complementaria para la asociación del ácido nucleico con el dendrímero catiónico. Al llegar a su destino, el complejo dendrímero-ácido nucleico es entonces tomado por la célula a través de endocitosis. Los dendrímeros ofrecen construcciones covalentes, robustas y un control extremo sobre la estructura de la molécula. En conjunto,presentan más ventajas que los lípidos catiónicos. La producción de dendrímeros ha sido históricamente un proceso ralentizado y caro, que consta de numerosas reacciones lentas, un obstáculo que agrava su desarrollo comercial. La empresa Dendritic Nanotechnologies, con sede en Michigan , descubrió un método para producir dendrímeros utilizando la cinética química, un proceso que no solo reduce costes en una magnitud de tres, sino que también acorta las reacciones de un mes, a varios días. Estos nuevos dendrímeros “Priostar” pueden ser construidos específicamente para transportar una carga útil de ADN o ARN que transfiere a las células en una alta eficiencia y con una escasa o nula toxicidad.
Porcentajes de ensayos en terapia génica
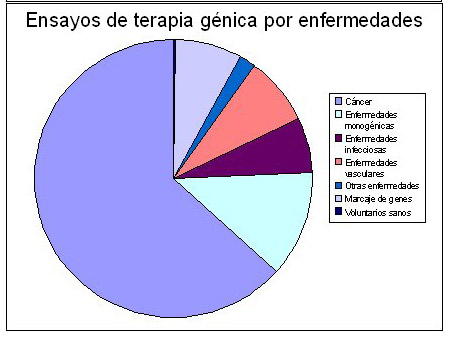
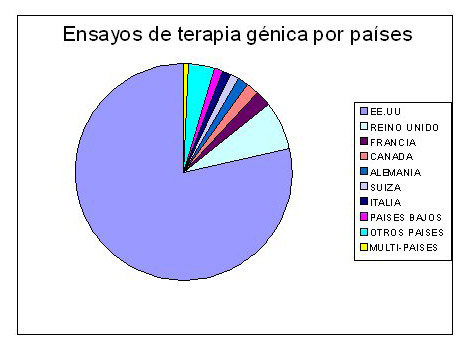
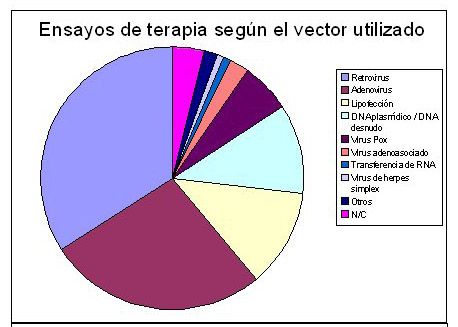
Principales acontecimientos en la terapia génica
2002 y anteriores
La nueva terapia génica se enfoca a las reparaciones de errores del ARN mensajero derivadas de genes defectuosos. Esta técnica tiene el potencial para tratar enfermedades que afectan a la sangre, como la talasemia, fibrosis quística y algunos cánceres. (11 de Octubre del 2002)
Investigadores de Case Western Reverse University y Copernicus Therapeutics son capaces de crear diminutos liposomas, de 25 nanómetros que pueden llevar ADN terapéutico a través de poros de la membrana nuclear. (12 de Mayo del 2002)
La enfermedad en células falciformes es tratada con éxito en ratones. (18 de Marzo del 2002)
En 1993 Andrew Gobea nació con una rara, y mortal enfermedad genética (SCID). La sangre fue retirada de la placenta de Andrew y el cordón umbilical también inmediatamente después de su naciemiento, que contienen células madre. El alelo que codifica el gen adenosina desaminasa, ADA, fue obtenido e insertado en un retrovirus. Los retrovirus y las células madre se mezclaron. Después se insertó el gen en los cromosomas de las células madre, y éstas en la sangre de Andrew. Durante cuatro años, las células T (glóbulos blancos), producidos por las células madre, fabricaron enzimas ADA utilizando el gen ADA. Después de cuatro años el niño requiso otra vez del tratamiento.
El éxito de un ensayo para el tratamiento de niños con SCID ( Sindrome de la Inmuno deficiencia Combinada Severa o enfermedad de “niño burbuja”) que tuvo lugar entre 2000 y 2002, fue cuestionada cuando dos de los diez niños tratados en París desarrollaron leucemia como respuesta. Las pruebas clínicas se interrumpieron temporalmente en el 2002, pero se reanudó después de la revisión de la normativa de protocolo en los Estados Unidos, el Reino Unido, Francia, Italia y Alemania. (3 de Octubre del 2002)
2003
Un equipo de investigadores de la universidad de California, en Los Ángeles, insertaron genes en el cerebro utilizando liposomas recubiertos de un polímero llamado polietilen glicol (PEG). La transferencia de genes en el cerebro es un logro significativo porque los vectores virales son demasiado grandes para cruzar la “barrera hematoencefálica”. Este método tiene el potencial para el tratamiento de la enfermedad del Parkinson. (20 de Marzo del 2003)
La interferencia por ARN o el silenciamiento génico comienza a ser una nueva forma de tratar la enfermedad de Huntington. Cortos fragmentos de ARN de doble cadena ( short, interfering RNAs o siRNAs) son utilizados por las células para degradar ARN de una secuencia particular. Si un siRNAs esta diseñado para unirse a una copia de ARN de un gen defectuoso, entonces el producto de la proteína anormal de ese gen, no se producirá. (13 de Marzo del 2003)
2006
Científicos del Instituto Nacional de la Salud (Bethesda, Maryland) tratan exitosamente un melanoma metastásico en dos pacientes, utilizando células T para matar y atacar a las células cancerosas. Este estudio constituye la primera demostración de que la terapia génica puede ser efectivamente un tratamiento contra el cáncer.
En Marzo del 2006, un grupo internacional de científicos anunció el uso exitoso de la terapia génica para el tratamiento de dos pacientes adultos contagiados por una enfermedad que afecta a las células mieloides. El estudio, publicado en Nature Medicine, se cree que es el primero que demuestra que la terapia génica puede curar enfermedades del sistema mieloide.
En Mayo del 2006, un equipo de científicos dirigidos por el Dr. Luigi Naldini y el Dr. Brian Brown del Instituto de San Raffaele Telethon contra la Terapia Génica (HSR-TIGET) en Milán, informaron de un avance para la terapia génica en el que se desarrolló una forma de prevenir que el sistema inmune pueda rechazar una entrada de genes. El grupo HSR-TIGET utilizó unos genes regulados por moléculas conocidas como microRNAs. Los investigadores del Dr. Naldini observaron que se podía utilizar esta función natural de los microRNA para desactivar selectivamente la identidad de sus genes terapéuticos en las células del sistema inmunológico y prevenir que el gen fuera encontrado y destruído. Se inyectó el gen que contiene una célula inmune con microARN en ratones y estos no rechazaron el gen. Este trabajo tiene implicaciones imortantes para el tratamiento de la hemofilia y otras enfermedades genéticas de la terapia génica.
2007
El 1 de Mayo del 2007, el hospital Moorfields Eye y la universidad College London´s Institute of Ophthalmology anunciaron el primer ensayo de terapia génica para la enfermedad hereditaria de retina. La primera operación se llevó a cabo en un varón británico de 23 años de edad, Robert Johnson, a principios del 2007. La Amaurosis congénita de Leber es una enfermedad hereditaria que causa la ceguera por mutaciones en el gen RPE65. Los resultados de la Moorfields/UCL se publicaron en New England Journal of Medicine. Se investigó la transfección de subretiniana por el virus recombinante adeno-asociado llevando el gen RPE65, y se encontraron con resultados positivos. Los pacientes mostraron un incremento de la visión, y sin efectos secundarios aparentes.
2008
Investigadores de la Universidad de Michigan en Ann Arbor (Estados Unidos) desarrollaron una terapia genética que ralentiza y recupera las encías ante el avance de la enfermedad periodontal, la principal causa de pérdida de dientes en adultos. Los investigadores descubrieron una forma de ayudar a ciertas células utilizando un virus inactivado para producir más cantidad de una molécula natural denominada receptor TNF. Este factor se encuentra en bajas cantidades en los pacientes con periodontitis. La molécula administrada por terapia genética funciona como una esponja que absorbe los niveles excesivos de TNF, la cual empeora la destrucción ósea inflamatoria en pacientes que sufren de artritis, deterioro articular y periodontitis. Los resultados del trabajo mostraron que entre el 60 y el 80 por ciento de los tejidos periodontales se libraban de la destrucción al utilizar la terapia génica. Ésta requiere una sola administración, pero podría tener efectos durante toda la vida en los pacientes, bajo riesgo de enfermedad grave.
Problemas de la terapia génica y de sus aplicaciones
En los últimos años, se ha puesto en duda la seguridad de los ensayos realizados con la terapia génica, a raíz de que en 1999 se hiciese pública la noticia de la muerte de un paciente (Jesse Gelsinger, de 18 años), como consecuencia del tratamiento de terapia génica al que estaba sometido para intentar curar la deficiencia de la ornitina transcarbamilasa que padecía. La modificación del material genético de una célula afecta tanto a la célula como a sus descendientes. Los principales miedos se centran en las alteraciones genéticas de la línea germinal.
Algunos de los problemas de la terapia génica son:
La naturaleza de la propia terapia génica hace que pacientes tengan que someterse a múltiples rondas de terapia génica.
La respuesta inmune. Siempre que un objeto extraño se introduzca en los tejidos humanos, el sistema inmune ha evolucionado para atacar al invasor. La posibilidad de que el sistema inmune reduzca la eficacia de la terapia génica existe. Además, el sistema inmunitario mejora su respuesta la segunda vez que el invasor penetra en el organismo, por tanto es difícil que esta terapia génica se pueda repetir en pacientes.
Problemas con los vectores virales. Podrían contaminarse tanto por sustancias químicas o por el virus virulento. Recombinaciones indeseadas en estos vectores podrían acarrear enfermedades con una virulencia impredecible . Además presentan otros problemas como la toxicidad, respuestas inmunes e inflamatorias, etc.

Trastornos multigénicos. Trastornos que surgen de mutaciones en un único gen. Lamentablemente, algunos de los trastornos más comunes producen enfermedades cardíacas, presión arterial alta, la enfermedad del Alzheimer, artritis, diabetes... y son causados por los efectos combinados de las variaciones de muchos genes. Estos trastornos podrían ser especialmente difíciles para el tratamiento eficaz con el uso de terapia génica.
Podrían darse modificaciones en células germinales. La introducción involuntaria de genes en estas células expondría a la descendencia a un altísimo riesgo.
Aunque en los ensayos no se ha dado transferencia (contagio) a otras personas en contacto, esto aún no puede ser descartado. Los pacientes tratados pueden tener vectores en sangre, heces, orina, semen...
Posibilidad de inducir un tumor (mutagénesis). Si el ADN se integra en el lugar equivocado en el genoma, por ejemplo en un gen supresor tumoral, podría inducir a un tumor. Esto ha ocurrido en los ensayos clínicos para SCID (Inmunodeficiencia Combinada Severa) ligada al cromosoma X, en donde las células madre hematopoyéticas de los pacientes se traducen utilizando un retrovirus. Esto condujo al desarrollo de la leucemia en 3 de 20 pacientes. Sin embargo, ante el riesgo de padecer un tumor maligno, existen también estrategias, las cuales se reflejan en el cuadro:
Terapia génica en animales
El primer ejemplo de terapia génica en mamíferos fue la corrección de la deficiencia en la producción de la hormona del crecimiento en ratones. La mutación recesiva little (lit) produce ratones enanos. A pesar de que estos presentan un gen de la hormona del crecimiento aparentemente normal, no producen mARN a partir de este gen.

El primer paso en la corrección del defecto consistió en la inyección de cinco mil copias de un fragmento de ADN lineal portador de la región estructural del gen de la hormona del crecimiento de la rata fusionado al promotor del gen de la metalotioneína de ratón, en huevos lit. La función normal de la metalotioneína es la destoxificación de los metales pesados, por lo que la región reguladora responde a la presencia de metales pesados en el animal. Los huevos inyectados fueron implantados en hembras. El 1% de los ratones de la descendencia resultaron ser transgénicos, y alcanzaron mayor tamaño.
Se ha creado una tecnología similar para generar variedades transgénicas de salmón del Pacífico con una tasa rápida de crecimiento y, los resultados han sido espectaculares. Se microinyectó en huevos de salmón un plásmido portador del gen de la hormona del crecimiento regulado por el promotor de la metalotioneína y una pequeña porción de peces resultantes fueron transgénicos, pesando once veces más que los no transgénicos.
Terapia génica en la cultura popular
En series de televisión como Dark Angel, el tema de la terapia génica se menciona como una de las prácticas realizadas en niños transgénicos y sus madres. También en la serie Alias, aparece la terapia génica molecular como explicación a dos indivíduos idénticos. Es un un elemento fundamental en la trama de videojuegos como Metal Gear Solid, y desempeña un papel importante en la trama de la película Muere otro día, de James Bodn, en I am Legend, de Will Smith, entre otras muchas.
Bibliografía
- Conceptos de Genética, William S. Klug, Michael R.Cummings y Charlotte A. Spencer. Pearson. 8ª edición.
- Kimmelman J (2005). Recent developments in gene transfer: risk and ethics. BMJ. 2005 Jan 8;330(7482):79-82. Review.
