Diferencia entre revisiones de «Diagrama de fase»
m Revertidos los cambios de 69.79.48.56 a la última edición de 138.4.118.249 |
|||
| Línea 44: | Línea 44: | ||
**Sintéctica |
**Sintéctica |
||
**Catatéctica |
**Catatéctica |
||
te amo |
|||
== Véase también == |
== Véase también == |
||
Revisión del 18:40 18 jul 2009
En termodinámica y ciencia de materiales se denomina diagrama de fase a la representación gráfica de las fronteras entre diferentes estados de la materia de un sistema, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado.
En ciencia de materiales se utilizan ampliamente los diagramas de fase binarios, mientras que en termodinámica se emplean sobre todo los diagramas de fase de una sustancia pura.
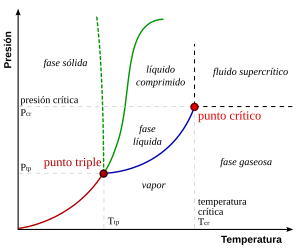
Diagrama de fase de una sustancia pura
Los diagramas de fase más sencillos son los de presión - temperatura de una sustancia pura, como puede ser el del agua. En el eje de ordenadas se coloca la presión y en el de abscisas la temperatura. Generalmente, para una presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes zonas:
- Punto triple: En este punto del diagrama coexisten los estados sólido, líquido y gaseoso. Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termómetros.
- Los pares (presión, temperatura) que corresponden a una transición de fase entre:
- Dos fases sólidas: Cambio alotrópico;
- Entre una fase sólida y una fase líquida: fusión - solidificación;
- Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa);
- Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción).
Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico. Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presíón y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado.
Es preciso anotar que, en el diagrama PV del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la presíon el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida.
Diagrama de fase binario
Cuando aparecen varias sustancias, la representación de los cambios de fase puede ser más compleja. Un caso particular, el más sencillo, corresponde a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en masa. En un diagrama binario pueden aparecer las siguientes regiones:
- Sólido puro o disolución sólida
- Mezcla de disoluciones sólidas (eutéctica, eutectoide, peritéctica, peritectoide)
- Mezcla sólido - líquido
- Únicamente líquido, ya sea mezcla de líquidos inmiscibles (emulsión), ya sea un líquido completamente homogéneo.
- Mezcla líquido - gas
- Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones da altitud).
Hay punto y líneas en estos diagramas importantes para su caracterización:
- Línea de líquidus, por encima de la cual solo existen fases líquidas.
- Línea de sólidus, por debajo de la cual solo existen fases sólidas.
- Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar transformaciones eutécticas y eutectoides, respectivamente.
- Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de A y B deja de ser soluble para transformarse en (α)+ sustancia pura (A ó B).
- Concentraciones definidas, en las que tienen lugar transformaciones a temperatura constante:
- Eutéctica
- Eutectoide
- Peritéctica
- Perictectoide
- Monotéctica
- Monotectoide
- Sintéctica
- Catatéctica
