Diferencia entre revisiones de «NADH deshidrogenasa»
Sin resumen de edición |
m Revertidos los cambios de 189.148.132.241 a la última edición de DumZiBoT |
||
| Línea 1: | Línea 1: | ||
[[Image:ETC.PNG|thumb|[[Cadena respiratoria]]; la NADH deshidrogenasa es el complejo I a la izquierda de la figura]] |
[[Image:ETC.PNG|thumb|[[Cadena respiratoria]]; la NADH deshidrogenasa es el complejo I a la izquierda de la figura]] |
||
La '''NADH |
La '''NADH deshidrogenasa''', '''NADH:ubiquinona oxidorreductasa''' (EC 1.6.5.3) o '''complejo I''' es un gran [[complejo multienzimático]] que cataliza la transferencia de [[electron]]es del [[NADH]] al [[coenzima Q]] en la [[cadena respiratoria]]. |
||
Es el mayor complejo de la cadena respiratoria; en los [[mamíferos]] consta de 45 cadenas [[polipéptido|polipeptídicas]], de las cuales, siete están codificadas por el [[genoma]] mitocondrial. Contiene [[FMN]] como grupo prostético y 8 cúmulos hierro-azufre. |
Es el mayor complejo de la cadena respiratoria; en los [[mamíferos]] consta de 45 cadenas [[polipéptido|polipeptídicas]], de las cuales, siete están codificadas por el [[genoma]] mitocondrial. Contiene [[FMN]] como grupo prostético y 8 cúmulos hierro-azufre. |
||
| Línea 8: | Línea 8: | ||
[[Image:NADH Dehydrogenase Electron Carriers Unlabeled.png|thumb|left|Estructura de la NADH deshidrogenasa; la membrana interna [[mitocondria]]l queda en la parte inferior de la figura]] |
[[Image:NADH Dehydrogenase Electron Carriers Unlabeled.png|thumb|left|Estructura de la NADH deshidrogenasa; la membrana interna [[mitocondria]]l queda en la parte inferior de la figura]] |
||
Constituye el punto de entrada a la [[cadena respiratoria|cadena de transporte electrónico]] en las [[bacteria]]s y en la membrana interna de las [[mitocondria]]s de las [[célula]]s [[eucariota]]. La transferencia [[electrón]]ica se inicia mediante la [[oxidación]] del [[NADH]] ya que sus dos electrones son transferidos simultáneamente a un [[FMN]] unido no covalentemente a la [[enzima]], y desde allí, a través de una serie de clusters Fe-S (transportadores de electrones capaces de aceptar un electrón por ciclo) al aceptor final, la [[coenzima Q]] (ubiquinona, transportador electrónico [[liposoluble]]) o a aceptores artificiales como [[ferrocianuro]] o [[rutenio (III) hexaamina]].<ref>Carroll J, Fearnley IM, Shannon RJ, Hirst J, Walker JE: Analysis of the subunit composition of complex I from bovine heart mitochondria. ''Mol Cell Proteomics'' 2003, 2:117-126.</ref><ref>Dupuis A, Prieur I, Lunardi J: Toward a characterization of the connecting module of complex I. ''J Bioenerg Biomembr'' 2001, 33:159-168.</ref> |
|||
Simultáneamente al transporte electrónico, el complejo I bombea [[protón|protones]] a través de la membrana, contribuyendo así a la generación de un [[gradiente electroquímico]]. La [[estequiometría]] aceptada para el bombeo de protones es 2H+/e-.<ref name=Schu>Schultz BE, Chan SI: Structures and proton-pumping strategies of mitochondrial respiratory enzymes. ''Ann Rev Biophys Biomol Struct'' 2001, 30:23-65.</ref> |
Simultáneamente al transporte electrónico, el complejo I bombea [[protón|protones]] a través de la membrana, contribuyendo así a la generación de un [[gradiente electroquímico]]. La [[estequiometría]] aceptada para el bombeo de protones es 2H+/e-.<ref name=Schu>Schultz BE, Chan SI: Structures and proton-pumping strategies of mitochondrial respiratory enzymes. ''Ann Rev Biophys Biomol Struct'' 2001, 30:23-65.</ref> |
||
| Línea 18: | Línea 18: | ||
Más de cien [[gene]]s están involucrados en la [[biosíntesis]] del complejo I, participan en: [[transcripción]], [[traducción]], transporte, procesamiento, inserción de [[cofactor]]es y ensamblado. El proceso de biosíntesis debe estar estrictamente regulado para mantener los niveles de actividad [[metabolismo|metabólica]] en células y tejidos, de acuerdo a su demanda energética.<ref name=Schu/><ref name=Yano/> |
Más de cien [[gene]]s están involucrados en la [[biosíntesis]] del complejo I, participan en: [[transcripción]], [[traducción]], transporte, procesamiento, inserción de [[cofactor]]es y ensamblado. El proceso de biosíntesis debe estar estrictamente regulado para mantener los niveles de actividad [[metabolismo|metabólica]] en células y tejidos, de acuerdo a su demanda energética.<ref name=Schu/><ref name=Yano/> |
||
Tradicionalmente se ha denominado como |
Tradicionalmente se ha denominado como complejo I a la enzima mitocondrial mientras que su contraparte bacteriana se conoce como NADH deshidrogenasa tipo I.<ref>Hatefi Y: The mitochondrial electron transport and oxidative phosphorylation system. ''Ann Rev Biochem'' 1985, 54:1015-1069.</ref> |
||
<ref>Matsushita K, Ohnishi T, Kaback HR: NADH-ubiquinone oxidoreductases of the Escherichia coli aerobic respiratory chain. ''Biochemistry'' 1987, 26:7732-7737.</ref> |
<ref>Matsushita K, Ohnishi T, Kaback HR: NADH-ubiquinone oxidoreductases of the Escherichia coli aerobic respiratory chain. ''Biochemistry'' 1987, 26:7732-7737.</ref> |
||
Revisión del 00:29 27 sep 2009
La NADH deshidrogenasa, NADH:ubiquinona oxidorreductasa (EC 1.6.5.3) o complejo I es un gran complejo multienzimático que cataliza la transferencia de electrones del NADH al coenzima Q en la cadena respiratoria.
Es el mayor complejo de la cadena respiratoria; en los mamíferos consta de 45 cadenas polipeptídicas, de las cuales, siete están codificadas por el genoma mitocondrial. Contiene FMN como grupo prostético y 8 cúmulos hierro-azufre.
Su estructura tienen forma de "L" con un gran dominio en la membrana (con alrededor de 60 hélices transmembrana) y un dominio periférico hidrófilo donde se produce la reducción del NADH.
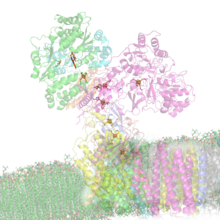
Constituye el punto de entrada a la cadena de transporte electrónico en las bacterias y en la membrana interna de las mitocondrias de las células eucariota. La transferencia electrónica se inicia mediante la oxidación del NADH ya que sus dos electrones son transferidos simultáneamente a un FMN unido no covalentemente a la enzima, y desde allí, a través de una serie de clusters Fe-S (transportadores de electrones capaces de aceptar un electrón por ciclo) al aceptor final, la coenzima Q (ubiquinona, transportador electrónico liposoluble) o a aceptores artificiales como ferrocianuro o rutenio (III) hexaamina.[1][2]
Simultáneamente al transporte electrónico, el complejo I bombea protones a través de la membrana, contribuyendo así a la generación de un gradiente electroquímico. La estequiometría aceptada para el bombeo de protones es 2H+/e-.[3] [4] Este proceso produce el 40% del gradiente transmembrana generado en la oxidación del NADH por la cadena respiratoria mitocondrial.[5] Recientemente se demostró que en ciertos procariotas el complejo transloca cationes Na+ en lugar de protones y que de este modo se genera una fuerza sodio-motriz en lugar de protón-motriz.[6] [7]
Más de cien genes están involucrados en la biosíntesis del complejo I, participan en: transcripción, traducción, transporte, procesamiento, inserción de cofactores y ensamblado. El proceso de biosíntesis debe estar estrictamente regulado para mantener los niveles de actividad metabólica en células y tejidos, de acuerdo a su demanda energética.[3][4]
Tradicionalmente se ha denominado como complejo I a la enzima mitocondrial mientras que su contraparte bacteriana se conoce como NADH deshidrogenasa tipo I.[8] [9]
Patología
Mutaciones en las subunidades del complejo I pueden causar enfermedades mitocondriales, entre las que destaca el síndrome de Leigh.
Hay algunas evidencias de que defectos en el complejo I pueden jugar cierto papel en la etiología de la enfermedad de Parkinson, tal vez porque el complejo I (al igual que el III) pueden padecer fugas de electrones hacia el oxígeno formando superóxidos muy tóxicos).
Referencias
- ↑ Carroll J, Fearnley IM, Shannon RJ, Hirst J, Walker JE: Analysis of the subunit composition of complex I from bovine heart mitochondria. Mol Cell Proteomics 2003, 2:117-126.
- ↑ Dupuis A, Prieur I, Lunardi J: Toward a characterization of the connecting module of complex I. J Bioenerg Biomembr 2001, 33:159-168.
- ↑ a b Schultz BE, Chan SI: Structures and proton-pumping strategies of mitochondrial respiratory enzymes. Ann Rev Biophys Biomol Struct 2001, 30:23-65.
- ↑ a b Yano T: The energy-transducing NADH: quinone oxidoreductase, complex I. Mol Aspects Med 2002, 23:345-368.
- ↑ Hinchliffe P, Sazanov LA: Organization of iron-sulfur clusters in respiratory complex I. Science 2005, 309:771-774.
- ↑ Friedrich T, Bottcher B: The gross structure of the respiratory complex I: a Lego System. Biochim Biophys Acta 2004, 1608:1-9.
- ↑ Hayashi M, Nakayama Y, Unemoto T: Recent progress in the Na(+)-translocating NADH-quinone reductase from the marine Vibrio alginolyticus. Biochim Biophys Acta 2001, 1505:37-44.
- ↑ Hatefi Y: The mitochondrial electron transport and oxidative phosphorylation system. Ann Rev Biochem 1985, 54:1015-1069.
- ↑ Matsushita K, Ohnishi T, Kaback HR: NADH-ubiquinone oxidoreductases of the Escherichia coli aerobic respiratory chain. Biochemistry 1987, 26:7732-7737.
