Diferencia entre revisiones de «Hibridación (química)»
m Revertidos los cambios de 190.67.141.49 (disc.) a la última edición de Deodato |
|||
| Línea 148: | Línea 148: | ||
En síntesis, tenemos electrones para formar enlaces de características sigma y pi. |
En síntesis, tenemos electrones para formar enlaces de características sigma y pi. |
||
=== HIBRIDACIÓN sp === |
|||
Es la que ocurre en moléculas con geometría lineal como el bióxido de carbono CO2 que tiene la estructura de octetos ya estudiada |
|||
En esta molécula el átomo central no muestra pares electrónicos solitarios y solo comparte electrones en dobles enlaces con cada O. Puesto que la geometría resultante es lineal, solo requiere que se formen Orbital ( híbrido sp) = a 2s + b 2px , esto es, combinando uno de los 2p (el x ) con el 2s , |
|||
[sp]1 = [2s + 2px ] / Ö2 |
|||
[sp]2 = [2s + 2px ] / Ö2 |
|||
donde Ö2 es el coeficiente de normalización. Así se genera formas lineales de enlaces, a 180°entre sí, como se muestra más abajo. Además podemos decir que hay 2 orbitales tipo 2p libres que no participan en la hibridación: 2py , 2pz . |
|||
Ahora bien, ¿cómo es la molécula CO2 en cuanto a su distribución de enlaces completa?. Para responder a esa pregunta, conviene analizar la figura que acompaña este párrafo. |
|||
Allí se muestra el átomo central C (hibridación sp más 2 OA’s tipo 2p perpendiculares entre sí) y los Oxígenos O (hibridación sp2 más un OA tipo 2p perpendicular), uno de ellos girado 90° alrededor de la línea de unión. |
|||
Puesto que la molécula es lineal y con dobles enlaces entre carbono y oxígeno, se ve que los enlaces s ocurren entre los híbridos sp2 del O con el sp del C apuntando hacia cada lado. Además, el otro enlace es de características p y se ocupan los 2p disponibles en cada átomo (2 orbitales en C , un orbital en cada O) . Ya que los 2p del C son perpendiculares entre sí, esto hace que el enlace p a un lado del C sea perpendicular al p del otro lado. Esto se observa claramente al compara los O de la izquierda y derecha de la figura. |
|||
Por último, 8 e ‘s se han ocupado en la formación de enlaces, quedando 4 e ‘s locales en cada O, formando 2 pares solitarios, residiendo c/par en un híbrido sp2 del Oxígeno. |
|||
Ejemplo |
|||
¿Cómo es la distribución de enlaces en la molécula N2? |
|||
Ya sabemos que la forma de octetos es :NºN:, hay 10 e’s de valencia, existe un enlace triple y la molécula es lineal. Esto requiere una hibridación sp en cada N como se muestra a la izquierda, manteniéndose 2 orbitales 2p para formar los otros enlaces. |
|||
La ligazón sigma es la que se muestra, donde los pares solitarios de cada N ocupan el sp no-enlazado. En este proceso hemos hecho uso de 6 e’ s de valencia del |
|||
La ligazón pi resulta de unir los OA tipo 2p de cada N, habiendo entonces 2 enlaces p perpendiculares entre sí, como lo muestra la figura. En total, hemos utilizado 2 e- en cada enlace pi, hemos completado la distribución electrónica para la molécula N2. |
|||
Finalmente, a la derecha se presenta la forma final de las nubes de electrones para esta molécula, que indican claramente todas las uniones sigma y pi quedando claramente establecido el significado de un enlace triple para cualquier molécula similar a N2 (por e ejemplo CºO, HCºCH, etc. ) |
|||
=== HIBRIDACIÓN dsp3 === |
=== HIBRIDACIÓN dsp3 === |
||
Revisión del 14:36 15 mar 2010

Se habla de hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, un orbital híbrido que describa la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos.
La teoría fue propuesta por el químico Linus Pauling y tiende a describir con gran eficacia la estructura de ciertos compuestos orgánicos tales como los enlaces dobles de los alquenos.
Orbitales
Los electrones de un átomo tienen la tendencia de ubicarse en orbitales específicos alrededor del núcleo, lo cual se enuncia en la ecuación de Schrödinger. Los detalles sobre número y orientación de electrones en cada orbital depende de las propiedades energéticas descritas por los números cuánticos. El primer orbital, el más cercano al núcleo es el llamado 1s y solo puede ser ocupado por dos electrones. Un átomo con un solo electrón (hidrógeno) y uno con dos electrones (helio) ubican su(s) electrón(es) en este orbital.
Un átomo con tres (litio) y cuatro (berilio) electrones tendrá que ubicar el tercer y cuarto electrón en el siguiente orbital, llamado 2s, el cual también solo acepta dos electrones.
Hibridación sp³
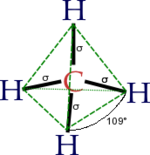
El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):
Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es excitado y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:
El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados (sp3: un poco de ambos orbitales):
De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°.
Hibridación sp²

Estos mismos átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma () y los enlaces dobles están compuestos por un enlace sigma y un enlace pi ().Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla solo con dos de los orbitales 2p:.surge a partir o al unirse el orbital s con dos orbitales p por lo consiguiente se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°.
Hibridación sp
Se define como la combinacion de un orbital S y un P, para formar 2 orbitales híbridos, con orientacion lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):
se caracteriza por la presencia de 2 orbitales pi(π)
ENLACES HIBRIDOS
Lo anteriormente visto sobre el VSEPR, el modelo sobre repulsión de pares de electrones localizados, nos enseñó que La Molécula es una colección de átomos unidos entre sí por pares de electrones compartidos, los que provienen de los Orbitales Atómicos locales dentro de la capa de valencia de cada átomo. Esto nos permitió predecir la geometría molecular. Ahora nos dedicaremos a describir la manera que estos orbitales atómicos son utilizados para formar los enlaces y los sitios en que residen los pares solitarios no ocupados.
HIBRIDACIÓN sp3
Para comenzar, recordemos la estructura de octetos para la molécula Metano CH4 que ya hemos estudiado, que exige que la disposición de los pares de electrones adopten una geometría tetraédrica alrededor del C, tal como se muestra en la Figura.
En general, estos enlaces usan electrones ubicados en los orbitales de la capa de valencia que son los 2s, 2p del átomo C central, como los que muestran más abajo.
Si recordamos la disposición tetraédrica perfecta, ocupando los vértices de un cubo de manera alternada como se señala en la figura, es posible demostrar que el ángulo H-C-H vale 109.5° , que coincide perfectamente con el experimental.
Sin embargo, los Orbitales Atómicos de valencia (2s, 2p) del C central que se muestran en la figura siguiente, no apuntan a las direcciones que se encuentran ocupadas por los H de la molécula, en circunstancias que son los que realmente contienen los electrones.
OA(híbrido) = a 2s + b 2px + c 2py + d 2pz
Así, es necesario que cambien su “dirección” mediante interacciones entre sí, formando nuevos Orbitales Atómicos conocidos como híbridos, esta vez formados como combinación lineal entre los originales atómicos, donde los “ coeficientes de mezcla “ a,b,c “ indican el ‘aporte’ de cada uno de los originales atómicos a la dirección tetraédrica requerida. Si bien no haremos uso de los valores de estas constantes de mezcla, es conveniente presentar los resultados para cada una de las mezclas de 2s con 2px, 2py , 2pz , en total 4 posibilidades:
[sp3]1 = [2s + 2px + 2py + 2pz ]/2
[sp3]2 =[ 2s - 2px - 2py + 2pz ]/2
[sp3]3 =[ 2s + 2px - 2py - 2pz ]/2
[sp3]4 = [ 2s - 2px + 2py - 2pz ]/2
Lo que se logra entonces, es una mezcla de un 2s con tres 2p , lo que genéricamente se denomina Hibridación sp3 como lo presenta la figura a continuación.
Así, en cada uno de los vértices marcados “sp3″ se encuentra preparado el átomo C para formar enlaces con los H en la molécula metano, como se observa en la disposición tetraédrica a continuación. Los electrones apareados ocupan la región de los enlaces que, a su vez, forman el octeto alrededor del C.
Visto de otra manera, lo que se tiene es un nuevo “ Diagrama de Energía “ para estos orbitales centrados en el C, a valores intermedios entre los 2s y los 2p originales,
Recuerde el siguiente Principio: Tan pronto un átomo requiera un conjunto de Orbitales Atómicos dirigidos a los vértices de un Tetraedro, adoptará una nueva forma de orbitales locales atómicos tipo sp3 útiles para enlaces
Realmente, no es extraño que esto ocurra cuando se forman moléculas, ya que los electrones en OA’s originales 2s,2p en átomos libres, hacen que la energía sea mínima en este caso. Sin embargo, cuando este átomo se usa para formar parte en moléculas, habrá que satisfacer nuevos requerimientos de mínima energía. Este esquema es consistente con la idea que una molécula no es simplemente una simple suma de sus partes.
Ejemplo:
¿Como es la molécula NH3 , en cuanto a sus partes constituyentes?
La respuesta es muy, fácil, es el mismo caso anterior salvo que en lugar de C es N y solo hay 3H’s, un vértice lo ocupa un par solitario . se forman 4 híbridos sp3 que alojan los e’ s de valencia más su par solitario, de modo que NH3 está preparado para actuar como Donor de e’s y ligarse a otra molécula o ion ( ej H+) a través del sitio no ocupado. En esta forma, se minimiza la energía de repulsión entre el par de electrones que forma uno de los enlaces con H, con los otros enlaces y con el par solitario . Obsérvese que los H no sufren hibridación, solo usan el orbital 1s que aloja su único electrón de valencia.
HIBRIDACIÓN sp2
Iniciemos el estudio de esta hibridación usando como ejemplo, la molécula “ etileno”, C 2 H 4, de gran importancia en la industria del plástico.
Como ya se ha visto, etileno tiene 12 e’ s de valencia que se agrupan según la siguiente estructura de octetos, donde se ve claramente que cada C se une trigonalmente en un plano a 2 H’s y un tercer C, con el ángulo HCH de 120° , lo mismo para el ángulo H-C-C. Sin embargo, los orbitales de valencia 2s, 2px, 2py, 2pz del C no poseen esta dirección para formar enlaces, así es que nuevamente necesitamos orbitales híbridos.
Los orbitales sp3 recién discutidos no sirven para este caso porque fueron construidos para formar ángulos de 109,5° entre enlaces en vez de los 120° que aquí se requiere. Un set de tres orbitales formando 120° entre sí, centrados en cada C, puede lograrse combinando un orbital 2s con 2 orbitales tipo 2p, específicamente 2px y 2py, como lo muestra la figura. Allí hay OA’s S y Px ., con similar existencia para Py a lo largo del eje y. Se observa que los ángulos pueden ser 90° entre Px, Py.
Sin embargo una combinación lineal del tipo
OA(híbrido sp2) = a 2s + b 2px + c 2py
esto es, un orbital 2s más los orbitales 2px, 2py produce la dirección deseada, combinados de la forma
[sp2]1 = [ Ö 2 · 2s + 2px ] / Ö 6
[sp2]2 = [ Ö 2 · 2s - 2px + Ö 3 · 2py ] / Ö 6
[sp2]3 = [ Ö 2 · 2s - 2px - Ö 3 · 2py ] / Ö 6
Se ve que se generan tres orbitales híbridos en el plano xy, dirigidos a 120° entre si como se muestra a continuación.
Esta hibridación sp2 , aplicable a todas las estructuras trigonales planas, permite que se enlacen otros tres átomos formando 120° entre sí.
Obsérvese que aún queda libre un OA 2pz original que no participa en esta hibridación trigonal ,por lo que efectivamente la forma final es la que se muestra, con el 2pz perpendicular a los sp2. En general, cualquier átomo que requiera una disposición trigonal planar para formar enlaces llamados sigma (s) deberá reorganizar sus OA’s originales a la forma sp2 . En el caso del C, con 4 e’s de valencia, cada sp2 dispone de un electrón para compartir en el enlace y el 2pz también dispone de un electrón para para formar enlaces de características pi (p)
La molécula etileno H2C=CH2 con todos sus enlaces s provenientes de la hibridación sp2 usados en cada centro atómico C, como se muestra en la figura, indica que la unión C=C es un doble enlace, uno de características sigma y otro de características pi , uno firme (s) que une directamente los átomos C-H y C-C y otro, no igualmente firme (p), sobre y bajo el plano xy de la hibridación sp2, que ayuda a la unión C-C.
En síntesis, tenemos electrones para formar enlaces de características sigma y pi.
HIBRIDACIÓN sp
Es la que ocurre en moléculas con geometría lineal como el bióxido de carbono CO2 que tiene la estructura de octetos ya estudiada
En esta molécula el átomo central no muestra pares electrónicos solitarios y solo comparte electrones en dobles enlaces con cada O. Puesto que la geometría resultante es lineal, solo requiere que se formen Orbital ( híbrido sp) = a 2s + b 2px , esto es, combinando uno de los 2p (el x ) con el 2s ,
[sp]1 = [2s + 2px ] / Ö2
[sp]2 = [2s + 2px ] / Ö2
donde Ö2 es el coeficiente de normalización. Así se genera formas lineales de enlaces, a 180°entre sí, como se muestra más abajo. Además podemos decir que hay 2 orbitales tipo 2p libres que no participan en la hibridación: 2py , 2pz .
Ahora bien, ¿cómo es la molécula CO2 en cuanto a su distribución de enlaces completa?. Para responder a esa pregunta, conviene analizar la figura que acompaña este párrafo.
Allí se muestra el átomo central C (hibridación sp más 2 OA’s tipo 2p perpendiculares entre sí) y los Oxígenos O (hibridación sp2 más un OA tipo 2p perpendicular), uno de ellos girado 90° alrededor de la línea de unión.
Puesto que la molécula es lineal y con dobles enlaces entre carbono y oxígeno, se ve que los enlaces s ocurren entre los híbridos sp2 del O con el sp del C apuntando hacia cada lado. Además, el otro enlace es de características p y se ocupan los 2p disponibles en cada átomo (2 orbitales en C , un orbital en cada O) . Ya que los 2p del C son perpendiculares entre sí, esto hace que el enlace p a un lado del C sea perpendicular al p del otro lado. Esto se observa claramente al compara los O de la izquierda y derecha de la figura.
Por último, 8 e ‘s se han ocupado en la formación de enlaces, quedando 4 e ‘s locales en cada O, formando 2 pares solitarios, residiendo c/par en un híbrido sp2 del Oxígeno.
Ejemplo
¿Cómo es la distribución de enlaces en la molécula N2?
Ya sabemos que la forma de octetos es :NºN:, hay 10 e’s de valencia, existe un enlace triple y la molécula es lineal. Esto requiere una hibridación sp en cada N como se muestra a la izquierda, manteniéndose 2 orbitales 2p para formar los otros enlaces.
La ligazón sigma es la que se muestra, donde los pares solitarios de cada N ocupan el sp no-enlazado. En este proceso hemos hecho uso de 6 e’ s de valencia del
La ligazón pi resulta de unir los OA tipo 2p de cada N, habiendo entonces 2 enlaces p perpendiculares entre sí, como lo muestra la figura. En total, hemos utilizado 2 e- en cada enlace pi, hemos completado la distribución electrónica para la molécula N2.
Finalmente, a la derecha se presenta la forma final de las nubes de electrones para esta molécula, que indican claramente todas las uniones sigma y pi quedando claramente establecido el significado de un enlace triple para cualquier molécula similar a N2 (por e ejemplo CºO, HCºCH, etc. )
HIBRIDACIÓN dsp3
Esta hibridación corresponde a un átomo central de una molécula el cual acepta más electrones que los que le corresponde con la regla del octeto. Como ejemplo, tomemos P Cl 5 , cuya estructura de Lewis muestra que el P central se rodea por 5 pares de electrones en enlaces, que corresponde a una agrupación trigonal bipiramidal. Esto requiere un conjunto de 5 nuevos orbitales híbridos en el P, cada uno de los cuales es dsp3 formado por un orbital d, un orbital s y los tres orbitales p como lo muestra la figura.
Cada uno de estos nuevos orbitales dsp3 del P comparte electrones con Cl, 5 en total.
Un conjunto de 5 pares de electrones alrededor de un átomo central siempre requiere una agrupación trigonal bipiramidal, que a su vez modifica los OA’s del átomo para formar los híbridos dsp3
Ahora bien, la estructura de octetos muestra que cada Cl se rodea de 4 pares de electrones, los que deben ubicarse en híbridos sp3 a su alrededor, tetraedricamente. Así, estamos preparados para describir los enlaces moleculares de PCL5.
Los cinco P-Cl enlaces sigma se forman al compartir electrones entre orbitales híbridos dsp3 del P con un orbital híbrido sp3 en cada Cl . Los demás híbridos en cada Cl alojan los pares solitarios que se acomodan teraedricamente para minimizar la repulsión. La figura a la izquierda así lo señala para esta molécula P Cl 5.
HIBRIDACIÓN d2sp3
Algunas moléculas tienen 6 pares de electrones alrededor del átomo central.
Como ejemplo, estudiemos el hexafluoruro de azufre, SF6 cuya estructura de octetos señala que hay 6 pares de electrones alrededor del S. Esto exige que se agrupen octaedricamente y para ello, nuevos OA’s que los alojen apuntando a los vértices del octaedro.
Esto se logra con una hibridación d2sp3 en el átomo central que forma 6 híbridos, cada uno unido al F.
Además, cada F posee 4 pares de electrones a su alrededor, por lo que existe en la forma sp3.
Cualquier molécula que contenga un átomo central rodeado de 6 pares de electrones, deberá agrupar octaedricamente los átomos a su alrededor y requerirá de una hibridación d2sp3
GENERALIZACIÓN
Como se ha visto, la descripción de las moléculas por medio de un modelo de distribución de electrones de valencia en sitios locales, dirigidos a los enlaces dependiente de la geometría, requiere de tres pasos:
Desarrollar la estructura de octetos para la molécula
Determinar la manera de distribuir pares de electrones de manera que se alcance la mínima repulsión entre ellos
Especificar los orbitales híbridos necesarios para acomodar los pares de electrones en la geometría requerida por VSEPR
Es importante que estos pasos se cumplan en el orden especificado. Finalmente, los requerimientos de los varios tipos de hibridación se resumen en la siguiente Tabla.
ALGUNOS CASOS
En la molécula Xe F 4 ,¿ cuál es la hibridación del Xe?
Xe F 4 muestra 6 pares de electrones alrededor del Xe, este debe agruparlo octaedricamente a su alrededor.
Para ello debe hibridarse formando 6 híbridos d2sp3 de los cuales, cuatro forman enlaces con F y los dos restantes son ocupados por los pares de electrones solitarios.
Todos los detalles se muestran en las figura que acompaña, donde se observa que 4 F están en el plano ecuatorial , los pares de electrones no compartidos se ubican en las posiciones axiales.
La molécula CO , ¿cómo es su estructura electrónica de enlaces híbridos?
La respuesta se sabe de inmediato, contiene 10 electrones de valencia que forman una distribución electrónica de octetos como la que se señala: Un enlace triple y un par de electrones solitarios tanto en C como en O. Esto requiere que ambos átomos sufran una hibridación sp.
El enlace triple consiste entonces de uno s formados por los sp de ambos átomos y dos enlaces p productos del recubrimiento de los orbitales 2p tanto en C como en O . La molécula es forzosamente lineal.
¿Qué pasa con BF4-?
El ion BF-4 contiene 32 electrones de valencia, si estructura de octetos muestra 4 pares de electrones alrededor del B lo que significa una distribución tetraédrica. Se requiere entonces que B forme híbridos sp3 , lo mismo ocurre para F.
El ion BF-4, entonces, posee una geometría tetraédrica como la mostrada, donde solo un sp3 se ha dibujado para los átomos F.
¿Cómo es el Xe F 2?
Esta molécula tiene 22 electrones de valencia. La estructura de octetos señala que hay 5 pares de electrones alrededor del átomo Xe, lo requiere que adopte una geometría trigonal bipiramidal. Su hibridación será entonces dsp3.
A su vez, los F tienen 4 pares de electrones a su alrededor, adquiriendo una estructura tetraédrica y una hibridación sp3.
Forma y ángulos
Las formas de las moléculas enlazadas por hibridaciones de sus orbitales es forzada por los ángulos entre sus átomos:
- Sin hibridación: forma lineal
- Hibridación sp: forma lineal con ángulos de 180°
- Hibridación sp²: forma trigonal plana con ángulos de 120°. Por ejemplo BCl3.
- Hibridación sp³: forma tetraédrica con ángulos de 109.5°. Por ejemplo CCl4.
- Hibridación sp³d: forma trigonal bipiramidal con ángulos de 90° y 120°. Por ejemplo PCl5.
- Hibridación sp³d²: forma octaédrica con ángulos de 90°. Por ejemplo SF6.
Ver representación de estas figuras.







