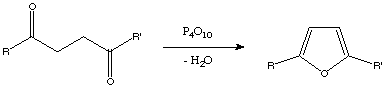Diferencia entre revisiones de «Furano»
Deshecha la edición 35125163 de 189.168.242.158 (disc.) |
|||
| Línea 92: | Línea 92: | ||
}} |
}} |
||
* {{cita libro |
* {{cita libro |
||
| autor = |
| autor = W.R. Peterson |
||
| título = Formulación y nomenclatura química orgánica |
| título = Formulación y nomenclatura química orgánica |
||
| año = 1996 |
| año = 1996 |
||
Revisión del 22:48 15 mar 2010
| Plantilla:Chembox header| Furano | |
|---|---|

| |
| Nombre IUPAC | Furano (u oxol) |
| Otros nombres | Furfurano, óxido de divinileno |
| Fórmula empírica | C4H4O |
| Masa molecular | 68,08 g/mol |
| Estado físico/Color | Líquido/Incoloro a marronoso |
| Número CAS | 110-00-9 |
| Plantilla:Chembox header | Propiedades | |
| Densidad | 0,94 g/cm3 a 20 ºC |
| Punto de fusión | -85,6 °C (187,6 K) |
| Punto de ebullición | 31,3 °C (304,4 K) |
| Solubilidad en agua | 10 g/l a 25 ºC |
| Plantilla:Chembox header | Información de Seguridad | |
 
| |
| Frases R: R45, R12, R20/22, R38, R48/22, R52/53, R68
Frases S: S53,S45,S61 | |
| Plantilla:Chembox header | Exenciones y Referencias[1][2][3] | |
El furano es un compuesto orgánico heterocíclico. Es un líquido claro, incoloro, altamente inflamable y muy volátil, con un punto de ebullición cercano al de la temperatura ambiente. Es tóxico y puede ser carcinógeno.
La aromaticidad del furano se debe a que uno de los pares de electrones solitarios del átomo de oxígeno se deslocaliza sobre el sistema de orbitales π del anillo, creando un sistema aromático de 4n+2 electrones (similar al del benceno). La estabilización extra debida a la aromaticidad comporta, por definición, una estructura plana. El otro par de electrones sin compartir del átomo de oxígeno se extiende en el plano del sistema anular, hacia fuera.
La hidrogenación del furano mediante catálisis heterogénea, esto implica un catalizador metálico, conduce al tetrahidrofurano.
Síntesis
Industrialmente el furano se obtiene mediante la descarbonilación catalítica del furfural.
Otro método, es la síntesis de Paal-Knorr que consiste en la deshidratación mediante P2O5 (o P4010) de un compuesto 1,4-dicarbonílico dando lugar al heterociclo furano.
Reacciones
Debido a la deslocalización del par de electrones del átomo de oxígeno por el anillo, π-excedente, el furano es más reactivo frente a la sustitución electrófila aromática que el benceno.
El furano tiene carácter de dieno en la reacción de Diels-Alder, reaccionando con dienófilos pobres en electrónes.
En condiciones suaves, en medio acuoso acidificado, el furano hidroliza dando lugar al correspondiente compuesto 1,4-dicarbonílico. Sería la reacción inversa a la de Paal-Knorr.
Aplicaciones
Se usa principalmente como intermedio en la producción industrial de tetrahidrofurano.
Se utiliza en la producción de lacas, como disolvente para resinas y en la síntesis de productos químicos para la agricultura (insecticidas), estabilizantes y productos farmaceúticos (química fina).
Es útil también para sintetizar nitrofuranos, un grupo de fármacos con actividad antibacteriana, antituberculosa e incluso antitumoral.
Referencias
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- W.R. Peterson (1996). Formulación y nomenclatura química orgánica. Barcelona: EDUNSA - Ediciones y distribuciones universitarias S.A. ISBN 84-85257-03-0.