Diferencia entre revisiones de «Cetona (química)»
m Revertidos los cambios de 186.97.59.61 (disc.) a la última edición de Bigsus-bot |
|||
| Línea 24: | Línea 24: | ||
* El nombre del [[hidrocarburo]] del que procede terminado en -ona.Como sustituyente debe emplearse el prefijo oxo-. |
* El nombre del [[hidrocarburo]] del que procede terminado en -ona.Como sustituyente debe emplearse el prefijo oxo-. |
||
* Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona. |
* Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona. |
||
kevi |
|||
== Propiedades físicas == |
== Propiedades físicas == |
||
Revisión del 20:13 20 ago 2010
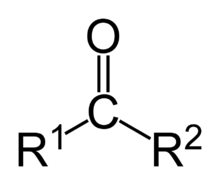
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo. Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno, y además unido a otros dos átomos de carbono.
El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.

Clasificación
Cetonas alifáticas
Resultan de la oxidación moderada de los alcoholes secundarios. Si los radicales alquilo R son iguales la cetona se denomina simétrica, de lo contrario será asimétrica o mixta.
En química, una cetona es un grupo funcional que se rige por un compuesto carboxílico que se mueve por la fusión de dos o más átomos.
Cetonas aromáticas
Se destacan las quinonas, derivadas del benceno.
Para nombrar los cetonas tenemos dos alternativas:
- El nombre del hidrocarburo del que procede terminado en -ona.Como sustituyente debe emplearse el prefijo oxo-.
- Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona.
Propiedades físicas
Los compuestos carbonílicos que presentan puntos de ebullición más bajos y altos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
Síntesis
Ozonólisis de alquenos. Tratamiento con permanganato (KMnO)4 en caliente de alquenos. Este método sólo es válido para la preparación de cetonas. El KMnO4 se usa como agente reoxidante del tetróxido de Os, debido a la elevada toxicidad de éste, así se usa en cantidades catalíticas en síntesis de dioles vecinales.
- Hidratación de alquinos
- Hidroboración-oxidación de alquinos.
- Acilación de Friedel-Crafts del Benceno.
- Oxidación de alcoholes.
- Condensación aldólica.
- Hibridacion de los Alcanos
Reacciones de cetonas
Las reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción.
Adición nucleofílica : Debido a la resonancia del grupo carbonilo la reacción más importante de aldehídos y cetonas es la reacción de adición nucleofílica cuyo mecanismo es el siguiente:
Siguen este esquema la reacción con hidruros ( NaBH4, LiAlH4 ) donde Nu- = H- y la reacción con organometálicos (RMgLi, RLi) donde Nu- = R-.
- Adición nucleofílica de alcoholes.
- Adición de amina primaria.
- Adición de Hidroxilamina.
- Adición de hidracinas.
- Adición de Ácido Cianhídrico.
Oxidación 1
Reducción
Hidruro
Hidrogenación
Reducción de Clemmensen
Reacción de Wolff-Kishner
Las(cet-nase) cetonas que poseen hidrógenos en posición α al grupo carbonilo dan también reacciones de condensación mediante un mecanismo en el que una base fuerte sustrae un hidrógeno α de la cetona generando un enolato, el cual (en su forma carbaniónica) actúa como nucleófilo sobre el grupo carbonilo de otra molécula de la misma cetona o de otro compuesto carbonílico (otra cetona, aldehído, éster, etcétera). Luego de la adición nucleofílica del carbanión al grupo carbonilo se genera un aldol mediante la acidificación del medio, el cual puede deshidratarse por calentamiento de la mezcla de reacción, obteniéndose un compuesto carbonílico α,ß-insaturado. Cabe aclarar que no siempre es necesaria la acidificación del medio de reacción y que en muchas reacciones de condensación se obtiene el producto deshidratado de manera espontánea (esto depende de la estabilidad relativa de los posibles productos de la condensación).
Nomenclatura de Cetonas
Nomenclatura Sustitutiva
En la nomenclatura de cetonas para nombrarlas se toma en cuenta el número de átomos de carbono y se cambia la terminación por ONA, indicando el carbono que lleva el grupo carbonilo (CO). Además se debe tomar como cadena principal la de mayor logitud que contenga el grupo carbonilo y luego se enumera de tal manera que éste tome el localizador más bajo.
EJEMPLOS:

Nomenclatura Radicofuncional
Otro tipo de nomenclatura para las cetonas, consiste en nombrar las cadenas como sustituyentes, ordenándolas alfabéticamente, se nombran los radicales y se aumenta la palabra CETONA. Si los dos radicales son iguales es una cetona simétrica.
EJEMPLOS:

Y si los radicales son diferentes es una cetona asimétrica.
EJEMPLOS:

Nomenclatura-casos especiales
-CASOS EN LOS QUE EXISTEN DOS O MAS GRUPOS CARBONÍLOS (CO) EN UNA MISMA CADENA
Nomenclatura Sustitutiva
En ésta nomenclatura si existen dos o más grupos CO aumentamos los prefijos (di,tri, tetra, etc), antes de la terminación ONA.
EJEMPLOS:

Nomenclatura Radicofuncional
Así como en la nomenclatura sustitutiva, también en la nomenclatura radicofuncional, si exísten dos o más grupos CO en una misma cadena se nombra normalmente los radicales y se antepone el prefijo (di, tri, tetra, etc) a la palabra CETONA.
EJEMPLOS:

-CASOS ESPECIALES DE CETONAS
Para algunos compuestos en los que el grupo carbonilo CO se encuentra directamente unido a un anillo bencénico o naftalénico se puede utilizar las nomenclaturas ya antes nombradas y también este otro tipo de nomenclatura que consiste en indicar los grupos:
CH3-CO-
CH3-CH2-CO-
CH3-CH2-CH2-CO- , etc
mediante los nombres ACETO, PROPIO, BUTIRO, etc. y agregarles la terminación FENONA o NAFTONA.
EJEMPLOS:

Nomenclatura de Cetonas que actúan como radicales dentro de la cadena
La nomenclatura ya antes nombrada se toma para casos considerados en que la función cetona tiene prioridad, pero cuando la cetona no es el grupo funcional principal, si no que hay otra función u otras funciones con mayor preferencia se emplea está nomenclatura: Para indicar al grupo CO se emplea el prefijo OXO:
EJEMPLOS:

REFERENCIAS
- PETERSON, W.R. Formulación y Nomenclatura Quimica Orgánica (6ta edición). Barcelona-España: Eunibar-editorial universitaria de Barcelona. pp. 102-106.
- ARMENDARIS G, Gerardo (2007). Quimica organica 3 (Tercera edición). Quito-Ecuador: Gruleer. pp. 140-141.
