Diferencia entre revisiones de «Fecundación in vitro»
mantenimiento; ortografía |
|||
| Línea 1: | Línea 1: | ||
{{referencias |
{{referencias adicionales}} |
||
[[File:Blausen 0583 InVitroFertilization.png|thumb|200px| Fertilización In Vitro.]] |
[[File:Blausen 0583 InVitroFertilization.png|thumb|200px| Fertilización In Vitro.]] |
||
La '''fecundación ''[[in vitro]]''''' ('''FIV''' o IVF por sus siglas en inglés) es una técnica por la cual la [[fecundación]] de los [[ovocito]]s por los [[espermatozoide]]s se realiza fuera del cuerpo de la madre. La FIV es el principal tratamiento para la [[esterilidad]] cuando otros métodos de [[reproducción asistida]] no han tenido éxito. El proceso implica el control hormonal del proceso ovulatorio, extrayendo uno o varios [[ovocito]]s de los [[ovario]]s maternos, para permitir que sean fecundados por [[espermatozoide]]s en un medio líquido. El ovocito fecundado puede entonces ser transferido al [[útero]] de la mujer, en vistas a que anide en el útero y continúe su desarrollo hasta el parto. |
La '''fecundación ''[[in vitro]]''''' ('''FIV''' o IVF por sus siglas en inglés) es una técnica por la cual la [[fecundación]] de los [[ovocito]]s por los [[espermatozoide]]s se realiza fuera del cuerpo de la madre. La FIV es el principal tratamiento para la [[esterilidad]] cuando otros métodos de [[reproducción asistida]] no han tenido éxito. El proceso implica el control hormonal del proceso ovulatorio, extrayendo uno o varios [[ovocito]]s de los [[ovario]]s maternos, para permitir que sean fecundados por [[espermatozoide]]s en un medio líquido. El ovocito fecundado puede entonces ser transferido al [[útero]] de la mujer, en vistas a que anide en el útero y continúe su desarrollo hasta el parto. |
||
| Línea 40: | Línea 40: | ||
*'''Medios''': durante este proceso se emplean diferentes medios de cultivo con diferente composición: |
*'''Medios''': durante este proceso se emplean diferentes medios de cultivo con diferente composición: |
||
*'''En los tubos''': 0, |
*'''En los tubos''': 0,1 ml de medio tamponado (HEPES) con heparina para evitar la formación de coágulos. |
||
*El medio HEPES (que debe estar desde el día anterior a ser utilizado en una estufa a 37 °C) acumulará |
*El medio HEPES (que debe estar desde el día anterior a ser utilizado en una estufa a 37 °C) acumulará temporalmente los cúmulos mientras se realiza la punción. Además será empleado para lavar y reducir el tamaño de los cúmulos antes de pasar al incubador. |
||
*'''Placas de cultivo''': con un medio simple rico en glucosa (por ejemplo HTF + HSA 10 mg/ml) para mantenerlos en el incubador al 5% dióxido de carbono. El medio debe estar desde el día anterior a ser utilizado en el incubador a 37 °C y 5% de dióxido de corbono. |
*'''Placas de cultivo''': con un medio simple rico en glucosa (por ejemplo HTF + HSA 10 mg/ml) para mantenerlos en el incubador al 5 % dióxido de carbono. El medio debe estar desde el día anterior a ser utilizado en el incubador a 37 °C y 5 % de dióxido de corbono. |
||
Las punciones se programan normalmente cada 30 minutos aunque la búsqueda de los ovocitos no suele durar más de 15 minutos. En estos procesos se utiliza [[anestesia]] local, general o parcial para evitar el dolor producido por la punción. |
Las punciones se programan normalmente cada 30 minutos aunque la búsqueda de los ovocitos no suele durar más de 15 minutos. En estos procesos se utiliza [[anestesia]] local, general o parcial para evitar el dolor producido por la punción. |
||
| Línea 57: | Línea 57: | ||
*'''Morfología''': para observar bien el ovocito habría que colocarlo en muy poca cantidad de medio para esparcir las células de granulosa. De forma que la ventaja de saber el estado madurativo no parta ningún beneficio frente a la manipulación que representa el poder conocerlo. |
*'''Morfología''': para observar bien el ovocito habría que colocarlo en muy poca cantidad de medio para esparcir las células de granulosa. De forma que la ventaja de saber el estado madurativo no parta ningún beneficio frente a la manipulación que representa el poder conocerlo. |
||
Es por ello que actualmente esta clasificación no tiene gran relevancia y no debe dársele mayor importancia, salvo para indicar características que se salgan especialmente de lo considerado como normalidad: cúmulos o coronas de aspecto apoptótico o postmaduro, presencia de sangre |
Es por ello que actualmente esta clasificación no tiene gran relevancia y no debe dársele mayor importancia, salvo para indicar características que se salgan especialmente de lo considerado como normalidad: cúmulos o coronas de aspecto apoptótico o postmaduro, presencia de sangre, etc. |
||
=== Fecundación === |
=== Fecundación === |
||
| Línea 64: | Línea 64: | ||
Una vez en el laboratorio, los complejos cúmulo corona ovocito extraídos se lavan en medio HEPES para mantener el pH, recortando las células de la granulosa que los rodean y preparándolos para la fecundación. Los ovocitos deben permanecer al menos 4 horas en el incubador (medio simple rico en glucosa) hasta su inseminación, es decir, aproximadamente 40 horas tras la inducción de la ovulación que sería el momento de la ovulación espontánea. |
Una vez en el laboratorio, los complejos cúmulo corona ovocito extraídos se lavan en medio HEPES para mantener el pH, recortando las células de la granulosa que los rodean y preparándolos para la fecundación. Los ovocitos deben permanecer al menos 4 horas en el incubador (medio simple rico en glucosa) hasta su inseminación, es decir, aproximadamente 40 horas tras la inducción de la ovulación que sería el momento de la ovulación espontánea. |
||
Al mismo tiempo, el [[semen]] se prepara para la fecundación, eliminando las células inactivas, el fluido seminal y se realiza su capacitado. Los parámetros adecuados de semen capacitado para realizar FIV son: 5-10 millones de espermatozoides por mililitro, más de 75% de espermatozoides móviles progresivos y más de 1% de formas normales. Si la muestra seminal posee valores inferiores a los anteriores, se recurre a ICSI en lugar de FIV. Si el semen proviene de un donante, probablemente habrá sido preparado antes de ser congelado y puesto en cuarentena, y cuando sea descongelado estará listo para usar. |
Al mismo tiempo, el [[semen]] se prepara para la fecundación, eliminando las células inactivas, el fluido seminal y se realiza su capacitado. Los parámetros adecuados de semen capacitado para realizar FIV son: 5-10 millones de espermatozoides por mililitro, más de 75 % de espermatozoides móviles progresivos y más de 1 % de formas normales. Si la muestra seminal posee valores inferiores a los anteriores, se recurre a ICSI en lugar de FIV. Si el semen proviene de un donante, probablemente habrá sido preparado antes de ser congelado y puesto en cuarentena, y cuando sea descongelado estará listo para usar. |
||
Existen distintos protocolos de FIV pero todos se basan en el mismo principio: el esperma y el ovocito se incuban juntos (en un ratio de aproximadamente 75.000:1) en un [[medio de cultivo]] simple con glucosa durante unas 18 horas. Concentraciones superiores de espermatozoides pueden producir fecundaciones anómalas (poliespermia) y una menor concentración de espermatozoides puede producir fallos de fecundación. |
Existen distintos protocolos de FIV pero todos se basan en el mismo principio: el esperma y el ovocito se incuban juntos (en un ratio de aproximadamente 75.000:1) en un [[medio de cultivo]] simple con glucosa durante unas 18 horas. Concentraciones superiores de espermatozoides pueden producir fecundaciones anómalas (poliespermia) y una menor concentración de espermatozoides puede producir fallos de fecundación. |
||
| Línea 176: | Línea 176: | ||
== Tasas de éxito == |
== Tasas de éxito == |
||
En EE.UU. la tasa de nacidos vivos vía FIV es alrededor del 27% por ciclo (con una tasa de embarazo del 33%), pero las posibilidades de éxito varían mucho dependiendo de la edad de la mujer (o más concretamente, de la edad de los ovocitos que se utilizan).[http://ftp.cdc.gov/pub/Publications/art/2004ART508.pdf] Cuando se utilizan los propios ovocitos de la mujer (y no de donante), para mujeres por debajo de los 35 años la tasa de embarazo es alrededor de 43% por ciclo (36,5% de nacidos vivos), mientras que para mujeres por encima de 40 la tasa cae drásticamente, hasta sólo un 4% para mujeres por encima de 42 años.[http://ftp.cdc.gov/pub/Publications/art/2004ART508.pdf] Otros factores que determinan la tasa de éxito incluyen la calidad de los ovocitos y los espermatozoides, la salud del útero y la experiencia de la clínica. Normalmente se transfieren varios embriones simultáneamente, para mejorar la tasa de éxito, lo que tiene como contrapartida el riesgo de embarazo múltiple. |
En EE. UU. la tasa de nacidos vivos vía FIV es alrededor del 27% por ciclo (con una tasa de embarazo del 33%), pero las posibilidades de éxito varían mucho dependiendo de la edad de la mujer (o más concretamente, de la edad de los ovocitos que se utilizan).[http://ftp.cdc.gov/pub/Publications/art/2004ART508.pdf] Cuando se utilizan los propios ovocitos de la mujer (y no de donante), para mujeres por debajo de los 35 años la tasa de embarazo es alrededor de 43% por ciclo (36,5% de nacidos vivos), mientras que para mujeres por encima de 40 la tasa cae drásticamente, hasta sólo un 4% para mujeres por encima de 42 años.[http://ftp.cdc.gov/pub/Publications/art/2004ART508.pdf] Otros factores que determinan la tasa de éxito incluyen la calidad de los ovocitos y los espermatozoides, la salud del útero y la experiencia de la clínica. Normalmente se transfieren varios embriones simultáneamente, para mejorar la tasa de éxito, lo que tiene como contrapartida el riesgo de embarazo múltiple. |
||
Una técnica reciente consiste en sumergir un embrión en un cultivo de nutrientes durante 5 días hasta que alcanza el estadio de [[blastocisto]]. Los médicos determinan entonces qué embriones son los que tienen más posibilidades de desarrollarse. Los de mejor calidad se transfieren al útero de la mujer. De esta manera es posible mejorar la tasa de embarazo sin aumentar el riesgo de embarazo múltiple. Esta es una técnica relativamente nueva y está en fase de experimentación. |
Una técnica reciente consiste en sumergir un embrión en un cultivo de nutrientes durante 5 días hasta que alcanza el estadio de [[blastocisto]]. Los médicos determinan entonces qué embriones son los que tienen más posibilidades de desarrollarse. Los de mejor calidad se transfieren al útero de la mujer. De esta manera es posible mejorar la tasa de embarazo sin aumentar el riesgo de embarazo múltiple. Esta es una técnica relativamente nueva y está en fase de experimentación. |
||
| Línea 258: | Línea 258: | ||
{{AP|Criopreservación}} |
{{AP|Criopreservación}} |
||
=== Criopreservación de embriones === |
=== Criopreservación de embriones === |
||
Cuando se generan embriones múltiples tras la FIV, los pacientes pueden elegir [[criopreservación|congelar los embriones]] que no se transfieren al útero de la mujer. Esos embriones se mantienen en [[nitrógeno líquido]] congelados hasta un máximo de 5 años. Según se publicó en 2006, en EE.UU. había cerca de 500 |
Cuando se generan embriones múltiples tras la FIV, los pacientes pueden elegir [[criopreservación|congelar los embriones]] que no se transfieren al útero de la mujer. Esos embriones se mantienen en [[nitrógeno líquido]] congelados hasta un máximo de 5 años. Según se publicó en 2006, en EE. UU. había cerca de 500 000 embriones congelados.[http://www.motherjones.com/news/feature/2006/07/souls_on_ice.html] La ventaja es que los pacientes que no consiguen concebir tras el primer ciclo pueden reintentarlo utilizando los embriones congelados, sin tener que realizar de nuevo un ciclo de FIV completo: sólo tendrían que realizar la transferencia de dichos embriones, sin pasar de nuevo por la estimulación, la extracción y la fecundación. O, en el caso de pacientes que consiguen un embarazo, pueden mantenerlos para un segundo embarazo posterior. Los embriones restantes procecentes de FIV pueden donarse a otras mujeres o parejas para reproducción o para investigar con ellos. |
||
Existen diferentes técnicas para criopreservar (congelar) embriones, cada una con diferentes posibilidades de lograr la supervivencia. En la actualidad el método más efectivo es la vitrificación (supervivencia de hasta 98%) [http://www.newhopefertility.com/cryopresservation_via_Vitrification.shtml], lo que a su vez ser refleja en una posibilidad de hasta el 50% de embarazo con embriones congelados, según reportes en la literatura médica [http://www.ncbi.nlm.nih.gov/pubmed/16102287]. |
Existen diferentes técnicas para criopreservar (congelar) embriones, cada una con diferentes posibilidades de lograr la supervivencia. En la actualidad el método más efectivo es la vitrificación (supervivencia de hasta 98 %) [http://www.newhopefertility.com/cryopresservation_via_Vitrification.shtml], lo que a su vez ser refleja en una posibilidad de hasta el 50 % de embarazo con embriones congelados, según reportes en la literatura médica [http://www.ncbi.nlm.nih.gov/pubmed/16102287]. |
||
Si, a pesar de todo, siguen existiendo embriones criopreservados que, por el tiempo transcurrido o por otras razones, no vayan a utilizarse para su implantación, las dos alternativas posibles (que normalmente están reguladas por leyes estrictas) son la donación para la investigación y la destrucción. En el caso de donación de embriones para investigación, ésta se debe llevarse a cabo en centros acreditados y sobre la base de proyectos autorizados por las autoridades correspondientes. Normalmente, se establecen plazos postfecundación para la investigación en los embriones y, una vez terminada la investigación, no se permite llevar a cabo una transferencia embrionaria con ellos. La investigación con embriones procedentes de FIV ha permitido hasta el momento la realización de estudios en [[células madre]], de gran importancia en la comprensión del desarrollo embrionario y en el avance de las terapias regenerativas de tejidos. En cuanto a la destrucción de los embriones congelados, se considera como última alternativa, a petición explícita de los progenitores, o bien cuando no los quieran para ellos y no hayan autorizado la donación a otras parejas ni la investigación en ellos. Tanto la utilización de embriones para fines de investigación como su destrucción generan extensos debates éticos entre partidarios y oponentes, que se traducen en leyes que limitan las posibilidades existentes, muy variables dependiendo de los países. |
Si, a pesar de todo, siguen existiendo embriones criopreservados que, por el tiempo transcurrido o por otras razones, no vayan a utilizarse para su implantación, las dos alternativas posibles (que normalmente están reguladas por leyes estrictas) son la donación para la investigación y la destrucción. En el caso de donación de embriones para investigación, ésta se debe llevarse a cabo en centros acreditados y sobre la base de proyectos autorizados por las autoridades correspondientes. Normalmente, se establecen plazos postfecundación para la investigación en los embriones y, una vez terminada la investigación, no se permite llevar a cabo una transferencia embrionaria con ellos. La investigación con embriones procedentes de FIV ha permitido hasta el momento la realización de estudios en [[células madre]], de gran importancia en la comprensión del desarrollo embrionario y en el avance de las terapias regenerativas de tejidos. En cuanto a la destrucción de los embriones congelados, se considera como última alternativa, a petición explícita de los progenitores, o bien cuando no los quieran para ellos y no hayan autorizado la donación a otras parejas ni la investigación en ellos. Tanto la utilización de embriones para fines de investigación como su destrucción generan extensos debates éticos entre partidarios y oponentes, que se traducen en leyes que limitan las posibilidades existentes, muy variables dependiendo de los países. |
||
Revisión del 14:41 1 nov 2015

La fecundación in vitro (FIV o IVF por sus siglas en inglés) es una técnica por la cual la fecundación de los ovocitos por los espermatozoides se realiza fuera del cuerpo de la madre. La FIV es el principal tratamiento para la esterilidad cuando otros métodos de reproducción asistida no han tenido éxito. El proceso implica el control hormonal del proceso ovulatorio, extrayendo uno o varios ovocitos de los ovarios maternos, para permitir que sean fecundados por espermatozoides en un medio líquido. El ovocito fecundado puede entonces ser transferido al útero de la mujer, en vistas a que anide en el útero y continúe su desarrollo hasta el parto.
In vitro
El término in vitro es un término en latín que significa ‘en cristal’. Se utiliza porque en los primeros experimentos biológicos en los que se realizaban cultivos de tejidos fuera de los organismos vivos de los cuales procedían, se realizaban en contenedores de cristal, tales como tubos de ensayo, probetas o placas de Petri. En la actualidad, el término in vitro se refiere a cualquier procedimiento biológico que se realiza fuera del organismo en el que tendría lugar normalmente, para distinguirlo de un experimento in vivo donde el tejido permanece dentro del organismo vivo en el que normalmente se encuentra. Coloquialmente, a los bebés concebidos a través de FIV se les denomina bebés probeta, refiriéndose a contenedores de cristal o plástico denominados probetas, que se utilizan frecuentemente en los laboratorios de química y biología. Sin embargo, normalmente la fecundación in vitro se realiza en placas planas denominadas placas de Petri; las placas de Petri utilizadas más a menudo están producidas en plástico, sin embargo, el nombre FIV sigue conservándose.
Indicaciones
Inicialmente la FIV se desarrolló para superar situaciones de infertilidad debidos a problemas en las trompas de Falopio, pero posteriormente se observó que la técnica tenía éxito también en otros casos de infertilidad. La introducción de la inyección intracitoplasmática de espermatozoides (ICSI) soluciona en gran medida los problemas de infertilidad masculina.
Para que un tratamiento de FIV tenga éxito, es necesario disponer de ovocitos sanos, espermatozoides que puedan fecundarlos y un útero que pueda mantener un embarazo. Aunque en algunos países los tratamientos de FIV están cubiertos por los servicios sanitarios sociales, normalmente se recurre a esta técnica cuando otras opciones han fallado, debido a que la FIV conlleva costos elevados.
La FIV puede utilizarse también en mujeres menopáusicas, utilizando ovocitos procedentes de una donante. Asimismo es una técnica que puede considerarse en pacientes que han sufrido una pérdida total o parcial de fecundidad debido a un tratamiento agresivo frente a una patología grave (como el cáncer).
Método
Estimulación ovárica
Previamente a la fecundación in vitro, generalmente en el tercer día de la menstruación se estimula el desarrollo de folículos múltiples en los ovarios mediante tratamientos hormonales. En la mayoría de las pacientes se emplean inyecciones de gonadotropinas (generalmente análogos de la FSH), realizando controles frecuentes de los niveles de estradiol, y del crecimiento folicular mediante ultrasonografía ginecológica. Normalmente se necesitan 10 días de inyecciones. La ovulación espontánea durante el ciclo se previene por el uso de agonistas GnRH (aGnRH) o antagonistas GnRH (agGnRH), que bloquean el surgimiento natural de la hormona luteinizante (LH). Ambas generan, en otras palabras, lo que se conoce como un hipogonadismo hipogonadotrofo reversible. Sin embargo, los agonistas de la GnRH se diferencian de los antagonistas principalmente porque su efecto no es inmediato, sino que desencadenan en primera instancia un pico de FSH y LH (efecto flare-up), produciéndose un bloqueo posterior en la liberación de gonadotropinas por el desacople de los receptores de GnRH de la cascada de activación. Sin embargo, existen diferentes protocolos de estimulación que varían en el día de inicio, medicamentos empleados y métodos para prevenir e inducir el pico de la hormona luteinizante (LH).
Básicamente, si en el laboratorio el equipo se decanta por un tratamiento con aGnRH, se pueden escoger entre un protocolo corto y uno largo:
- Protocolo largo: los agonistas de la GnRH se suministran a la paciente varios días antes del nuevo ciclo y durante la administración de las gonadotropinas exógenas. Entre sus múltiples ventajas destaca que, con él, se asegura la no liberación prematura de LH, lo que garantiza la invalidación de toda ovulación precoz. A su vez, este hecho permite al embriólogo planificar sin margen de error la fecha de la captación folicular. Por otra parte, se asegura que el desarrollo de los folículos se sincronice. Desgraciadamente, con la aplicación de este protocolo, la probabilidad de que se produzca un síndrome de hiperestimulación ovárica (SHO) se multiplica, y se requiere un soporte de fase lútea (administración de progesterona), así como una mayor cantidad de gonadotropinas.
- Protocolo corto: los agonistas de la GnRH comienzan a suministrarse en los primeros días del ciclo, casi al mismo tiempo que las gonadotropinas exógenas. La principal virtud de este procedimiento es que consigue mejores resultados en mujeres con baja respuesta, aunque este hecho aún no ha sido completamente demostrado. Por contra, la aplicación de este protocolo multiplica el riesgo de que se produzcan picos de LH (induciendo entonces una ovulación precoz) y no posibilita un desarrollo sincrónico de los folículos. En definitiva, se establece control sobre el desarrollo folicular mucho menor.
Por otra parte, cuando se emplean antagonistas de la GnRH, sólo se establece un protocolo, en el cual se administra la sustancia bloqueante varios días después del inicio del ciclo, al mismo tiempo que se suministran gonadotropinas recombinantes o purificadas de la orina.
Los protocolos de estimulación ovárica se han convertido en complejos y costosos. Por esto, parece haber una tendencia a nivel mundial dirigida a reducir la cantidad y la dosis de los medicamentos empleados durante la estimulación con el fin de reducir los riesgos y costos asociados a estos tratamientos [7]. Ejemplo de estos esfuerzos son los tratamientos FIV con Ciclos Naturales, además de los protocolos FIV con mínima estimulación desarrollados por los doctores John Zhang en NY [8], el Dr. O. Kato en Tokyo [9], y el Dr. Chávez-Badiola en México [10].
Extracción de ovocitos
Cuando se considera que la maduración de los folículos es adecuada, se administra a la paciente gonadotropina coriónica humana (β-hCG) o algún agonista de la GnRH. La primera actúa como un análogo de la hormona luteinizante (LH); mientras que la segunda induce un disparo de la propia hormona luteinizante (LH). En cualquiera de los casos, el medicamento provocará la ovulación alrededor de 36 horas después de la inyección, pero el procedimiento de extracción tiene lugar justo antes de que esto ocurra.
La extracción de los ovocitos se programa unas 36 horas después de la inducción de la ovulación y se realiza por vía transvaginal, utilizando una aguja guiada por ultrasonido, que pincha la pared vaginal para alcanzar los ovarios. Un médico aspira los folículos ayudado por un ecógrafo y recoge el líquido folicular en unos tubos que serán introducidos a un termobloque hasta que pasen al laboratorio. El líquido folicular es un fluido amarillento y seroso que contiene linfocitos y células de la granulosa aisladas o formando cúmulos con o sin ovocitos. A medida que se punciona el ovario el líquido folicular se vuelve de color rojo (hemático) debido a la hemorragia provocada por la punción. La sangre es tóxica para el ovocito pues contiene muchos anticuerpos, por lo que una vez que se termine la punción habrá que eliminarla. Este paso se realiza en el laboratorio, donde se procesa el líquido de la punción con el objetivo de recuperar los ovocitos contenidos en el líquido; de esta manera se obtendrán los ovocitos, se hará un lavado de los mismos y se clasificarán según su morfología. Estos tres pasos se tienen que realizar en el menor tiempo posible para evitar el efecto de la temperatura, a la que los ovocitos son muy sensibles, y el daño producido por el líquido hemático.
- Temperatura: el ovocito es el elemento más sensible a la temperatura de todo el laboratorio. Si ésta bajo de 34 °C el huso meiótico despolimerizará, y cuando se vuelva a forma puede crear anomalías cromosómicas, de forma que el ovocito será fecundable pero no dará lugar a un embrión normal.
Se deben aislar los complejos cúmulo-corona-ovocitos que se llegan a observar a simple vista (varios mm de diámetro).
- Medios: durante este proceso se emplean diferentes medios de cultivo con diferente composición:
- En los tubos: 0,1 ml de medio tamponado (HEPES) con heparina para evitar la formación de coágulos.
- El medio HEPES (que debe estar desde el día anterior a ser utilizado en una estufa a 37 °C) acumulará temporalmente los cúmulos mientras se realiza la punción. Además será empleado para lavar y reducir el tamaño de los cúmulos antes de pasar al incubador.
- Placas de cultivo: con un medio simple rico en glucosa (por ejemplo HTF + HSA 10 mg/ml) para mantenerlos en el incubador al 5 % dióxido de carbono. El medio debe estar desde el día anterior a ser utilizado en el incubador a 37 °C y 5 % de dióxido de corbono.
Las punciones se programan normalmente cada 30 minutos aunque la búsqueda de los ovocitos no suele durar más de 15 minutos. En estos procesos se utiliza anestesia local, general o parcial para evitar el dolor producido por la punción.
Existen 3 estadios de maduración en los cúmulos que se extraen por punción folicular, a saber:
- Grado I (Maduración nuclear MII): El cúmulo y la corona del ovocito presentan un aspecto expandido. Es el estado en el cual el ovocito presenta una mayor maduración y sólo los de este tipo son los que se utilizan en técnicas de reproducción asistida más refinadas, como el ICSI.
- Grado III (Maduración nuclear VG): El ovocito destaca por la gran compactación del cúmulo, el cual cuenta con pocas células, muy fijadas a la zona pelúcida (ZP).
- Grado II (Maduración nuclear MI): El ovocito presenta un aspecto intermedio entre los dos estadios anteriores.
Esta clasificación trata de describir el ovocito y su estado de maduranción nuclear estando rodeado de células del cúmulo y la corona.
- Morfología: para observar bien el ovocito habría que colocarlo en muy poca cantidad de medio para esparcir las células de granulosa. De forma que la ventaja de saber el estado madurativo no parta ningún beneficio frente a la manipulación que representa el poder conocerlo.
Es por ello que actualmente esta clasificación no tiene gran relevancia y no debe dársele mayor importancia, salvo para indicar características que se salgan especialmente de lo considerado como normalidad: cúmulos o coronas de aspecto apoptótico o postmaduro, presencia de sangre, etc.
Fecundación
Una vez en el laboratorio, los complejos cúmulo corona ovocito extraídos se lavan en medio HEPES para mantener el pH, recortando las células de la granulosa que los rodean y preparándolos para la fecundación. Los ovocitos deben permanecer al menos 4 horas en el incubador (medio simple rico en glucosa) hasta su inseminación, es decir, aproximadamente 40 horas tras la inducción de la ovulación que sería el momento de la ovulación espontánea.
Al mismo tiempo, el semen se prepara para la fecundación, eliminando las células inactivas, el fluido seminal y se realiza su capacitado. Los parámetros adecuados de semen capacitado para realizar FIV son: 5-10 millones de espermatozoides por mililitro, más de 75 % de espermatozoides móviles progresivos y más de 1 % de formas normales. Si la muestra seminal posee valores inferiores a los anteriores, se recurre a ICSI en lugar de FIV. Si el semen proviene de un donante, probablemente habrá sido preparado antes de ser congelado y puesto en cuarentena, y cuando sea descongelado estará listo para usar.
Existen distintos protocolos de FIV pero todos se basan en el mismo principio: el esperma y el ovocito se incuban juntos (en un ratio de aproximadamente 75.000:1) en un medio de cultivo simple con glucosa durante unas 18 horas. Concentraciones superiores de espermatozoides pueden producir fecundaciones anómalas (poliespermia) y una menor concentración de espermatozoides puede producir fallos de fecundación.
Trascurrido 16-18 horas se comprueba la fecundación, que ya debería haber ocurrido. Como los ovocitos se fecundan en los primeros 20 minutos de exposición. Hay autores que a la media hora lavan los ovocitos para evitar la exposición a ROS, que pude formarse por la presencia de espermatozoides muertos.
El cigoto humano de 15 a 20 horas tras la concepción permanece en el estadio de pronúcleos (PN). Se considera que la fecundación es correcta cuando el cigoto presenta dos PN y dos corpúsculos (CP). A veces es difícil interpretar los CP y se valoran como correctamente fecundado cualquier embrión con dos PN. Cualquier otra combinación se considera anormal y se descarta. La mayoría de las veces aparece primero el PN paterno en la posición central y el materno se acerca más tarde. Para poder valorar correctamente la fecundación, es necesario decumular previamente el cigoto. Es importante que en FIV no se decumule el ovocito antes de la fecundación, ya que conlleva alta probabilidad de polispermia.
El óvulo fecundado se pasa a un medio de cultivo simple (como HTF/HSA) o secuencial (G1 de Vitrolife) y se mantiene durante alrededor de 48h hasta que alcanza el estadio de 6-8 células.

Hay estudios realizados que demuestran que la liofilización del esperma de ratón permite el desarrollo de embriones normales tras la inyección de ovocitos.
Cultivo de embriones
Una vez el óvulo ha sido fecundado y se ha obtenido un cigoto, éste es cultivado para promover su división celular y crecimiento para dar lugar a un embrión. Este cultivo dura entre 2 y 5 días, y es muy importante que se lleve a cabo en las condiciones óptimas para el embrión, ya que de ello dependerá su calidad y la tasa de implantación del mismo cuando sea transferido a un útero. Para que el crecimiento del embrión se lleve a cabo en las mejores condiciones posibles se utilizan distintos tipos de medio de cultivo:
Medios simples: de composición sencilla y fáciles de preparar. La composición de estos medios se determina a partir de la composición teórica del líquido de la trompa (medios HTF o P1) o de la composición de medios de cultivo para el desarrollo de cigotos de ratón (medios KSOM, Earle, M16 y T6), y suelen suplementarse con suero materno o albúmina sérica humana (HSA). Son óptimos para el crecimiento inicial del embrión (hasta los 3 días de cultivo). A partir del día cuatro no garantizan el desarrollo óptimo debido al comienzo de la transcripción activa del embrión, para lo que se requieren sustancias que estos medios no contienen. Los embriones suelen ser cultivados durante 3 días antes de su implantación, periodo tras el cual alcanzarían un estadio de 6-8 células. Ello permite que el embriólogo pueda monitorizar su tasa de división celular y la activación de genes, para asegurarse de que el embrión sea viable y de que se implantará adecuadamente. Tan sólo se adelantará el momento de la implantación, normalmente a los dos días de cultivo, cuando la pareja sometida a FIV cuente con pocos embriones disponibles para ser transferidos o cuando los embriones se desarrollen con lentitud.
Medios complejos: su composición es más compleja, incluye vitaminas, aminoácidos, metales, suero,... Son medios comerciales que han sido diseñados para el cultivo de células somáticas en cultivo, como el medio Ham F10, de modo que aunque mejoran el desarrollo embrionario hasta blastocisto (día 5) en comparación con los medios simples, no están optimizados para el cultivo de embriones. Tras cinco días de cultivo el embrión alcanza el estadio de blastocisto, en el que está compuesto por 12-16 células y posee una alta tasa de implantación. Suelen cultivarse hasta este estadio cuando previamente se han dado abortos o fallos de implantación en la paciente.
Medios secuenciales: tienen en cuenta el hecho de que el embrión atraviesa distintos ambientes desde que es fecundado en la trompa de Falopio hasta que alcanza el útero. Los medios secuenciales se componen de tres tipos de medios: un medio para la preparación de los gametos (medio simple), otro para el desarrollo hasta el día 3 (medio G1) y un tercero para alcanzar la fase de blastocisto (medio G2). Estos medios sí están optimizados para el desarrollo de los embriones hasta blastocisto pero son más sensibles a la temperatura, y por lo tanto más inestables.
Aparte de esto, también es muy importante controlar las condiciones de temperatura, luz y pH.
En algunos casos en reproducción asistida se opta por mantener el embrión en cultivo hasta día 5 o 6 en lugar de transferirlo en día 3. El cultivo largo presenta algunas ventajas como seleccionar mejor al embrión o aumentar la tasa de implantación. Aunque también existen algunos inconvenientes como el alto riesgo de bloqueo embrionario. Así, se observan una serie de cambios continuos en el embrión que se clasifican en estadios:
- Mórula (M): embrión de más de 12 células sin compactar del todo. Presente en día 4.
- Mórula compacta (MC): en día 4 ó 5. Es un embrión con 16 células o más pero en el que ya no se distinguen las células entre sí, ni se diferencia el blastocele o células del trofoectodermo.
- Blastocisto temprano: embrión en día 4 ó 5 en el que se distinguen las células planas del trofoectodermo en la superficie del embrión y una cavidad menor del 50% del volumen del embrión.
- Blastocisto cavitado: es el estadio típico de día 5. Se distingue claramente el trofoectodermo y un blastocele que ocupa al menos la mitad del interior del embrión.
El diámetro del embrión sigue siendo en torno a 140 micras. No siempre de distingue la masa celular interna. - Blastocisto expandido: se aprecia en día 5 ó 6. Se distingue el trofoectodermo, el blastocele y la masa celular interna. El diámetro es mayor de 150 micras y la zona pelúcida se afina.
- Blastocisto inicando eclosión (BHi): es un blastocisto expandido en el que se distingue una hernia por donde está comenzando la eclosión.
- Blastocisto eclosionado (BH): es un blastocisto totalmente fuera de la zona pelúcida, con un diámetro normalmente mayor de 300 micras, más del doble que en el estadio anterior. Es el estadio más tardío que se puede mantener in vitro.
La morfología de la masa celular interna y del trofoectodermo se usa como criterio de calidad del embrión.
Para llevar a cabo el cultivo largo de embriones se usan medios secuenciales o el cocultivo sobre monocapa de células endometriales.
Es el estadio más tardío del embrión que se puede mantener in vitro.
Laboratorio de FIV
No existe un consenso sobre cómo debe ser un laboratorio destinado a la fecundación in vitro. Sería apropiado que fuese una sala blanca con control absoluto de todos los parámetros y con el menor número posible de superficies horizontales, pero actualmente no es así debido a su alto coste. Aun así, es necesario controlar ciertos parámetros, pues aunque los embriones son fuertes y robustos, su tasa de implantación se ve influida por las condiciones ambientales. Los parámetros más habituales controlados en un laboratorio de FIV son:
- -Temperatura: los incubadores deben estar a 37 °C, por lo que hay que mantenerlos siempre encendidos y evitar que las condiciones externas varíen, pues el incubador tenderá a equilibrarse con éstas; para ello será necesario mantener encendido el termostato del laboratorio (condiciones externas) 24 horas con una temperatura estable de unos 21-24 °C (consenso con el personal para ver cómo están más cómodos).
- -pH: Es muy importante incubar los gametos y cultivar los embriones en medios de cultivo con un pH similar a su pH interno (pH=7, 2). Cuando la diferencia entre éstos es muy diferente la tasa de desarrollo disminuye.La mayoría de los medios de cultivo son preparados usando bicarbonato como buffer de pH, controlándolo por equilibrio entre el CO2 atmosférico, el CO2 disuelto, el bicarbonato y los iones hidrógeno en solución. El principal propósito de mantener los niveles de CO2 en la incubadora es mantener el pH del medio. Algunos autores opinan que se puede medir el pH del medio como una medida indirecta de los niveles de CO2. [1]
Se puede hacer con un Analizador de gases sanguíneos o un PHmetro calibrado justo antes de medir una alícuota mantenida dentro de la incubadora. La alícuota de medio utilizada para medir el pH debe ser descartada.
- -Partículas: habría que colocar filtros HEPA en la cabina de flujo laminar, en la climatización y en la salida del laboratorio para evitar la presencia de partículas (inertes o contaminantes) en el ambiente. Se considera que el ambiente es estéril cuando hay menos de 100 partículas/m3 (Clase 100).
- -VOCs: deben reducirse al mínimo los compuestos orgánicos volátiles (VOCs), ya que podrían tener efectos embriotóxicos (dañinos para los embriones). Algunos VOCs no son filtrables por métodos normales, y por tanto hay que emplear filtros de carbón activo con distintas concentraciones de permanganato potásico en la entrada de cualquier gas en el laboratorio. Es necesario recalcar que estos filtros tiene una vida limitada por su capacidad de absorción, por lo que hay que cambiarlos periódicamente.
- -Presión positiva: el laboratorio de FIV debe estar ligeramente presurizado, es decir, la presión del interior debe ser mayor que la exterior, de forma que cuando se abran las puertas sólo saldrá el aire del interior (de una limpieza extrema), evitándose así que entre aire sucio del exterior. Al ser el aire del interior del laboratorio tan limpio, suele haber sistemas de recircularización.
Existen también otros parámetros que pueden ser controlados, aunque no son tan importantes como los anteriores:
- -Luz: por precaución los laboratorios de FIV suelen trabajar a bajas intensidades lumínicas, pues existen embriones que son extremadamente sensibles a la luz, como son los de hámster o conejo; sin embargo, no está demostrado que los embriones humanos también sean sensibles a ella.
- -Humedad relativa (HR): no influye directamente al trabajo, pero sí al crecimiento de hongos. Al ser muy caro su control, sólo los laboratorios que realmente lo necesitan (HR>90%) tienen climatizadores para ello. Por confort, la HR debería estar alrededor del 50%.
En cuanto al diseño y la distribución, estos dos parámetros influyen bastante en las tasas de éxito del laboratorio. Los materiales empleados para el suelo, las paredes y el techo deben ser siempre nobles (acero inoxidable, linóleo, cerámica, etc.), y se debe evitar la presencia de superficies horizontales (para que no se acumule suciedad). Asimismo, debe procurarse tener una esclusa de entrada separada del resto de habitáculos: la sala principal (con la zona quirúrgica, incubadora y de micromanipulación distribuidas), el laboratorio de criopreservación, el laboratorio de preparación, el laboratorio de andrología y el laboratorio de DPI. El equipamiento de un laboratorio destinado a la reproducción, debe constar de una cabina de flujo laminar, un microscopio invertido con 400 aumentos y contraste de fase modular sobre una mesa antivibratoria y un incubador temporal.
Selección

Los laboratorios especializados en FIV han desarrollado métodos de puntuación para juzgar la calidad de los ovocitos y los embriones. Típicamente, los expertos examinan la simetría del embrión, la integridad estructural de sus células y el crecimiento general entre dos y cinco días tras la fecundación. Ahora los científicos están empezando a analizar no sólo el embrión, sino también el medio en el que crece. Algunos centros están utilizando análisis químicos y fórmulas matemáticas para crear una "huella metabólica" de un embrión sano, que podría utilizarse como barómetro para estimar el potencial de supervivencia de un embrión. Otros están intentando analizar las proteínas secretadas por los embriones y a medir la cantidad de oxígeno consumido, que es una señal habitual de crecimiento.[2]
Normalmente, los embriones que han alcanzado el estadio de 6-8 células se transfieren 3 días después de la extracción. En ocasiones, sin embargo, los embriones se mantienen en cultivo por un periodo más largo (unos 6 días), y la transferencia se realiza en el estadio de blastocisto, sobre todo si se observan muchos embriones de 3 días de buena calidad. Pero nunca superando los 14 días tras la fecundación. Las transferencias en estadio de blastocisto muestran mejores tasas de embarazo.[3]
La Asociación para el Estudio de la Biología Reproductiva (ASEBIR) especificó en 2007 una clasificación con las que evaluar los embriones antes de su transferencia, basándose en los resultados obtenidos de estudios realizados en centros de reproducción nacionales y en la literatura científica publicada. Sobre la base de ellas, las cuatro categorías que se establecen son:
- Categoría A: óptimos. Son los que tienen un desarrollo correcto y ninguna característica de mal pronóstico, por lo que serán siempre transferidos o criopreservados. En pacientes de buen pronóstico (mujeres de menos de 36 años y ninguna patología adversa o en receptoras de ovocitos) los embriones tipo A suelen tener un 40-60% de posibilidades de implantar.
- Categoría B: Buenos. Son embriones de buena calidad con elevada capacidad de implantación. Lo habitual es que tengan entre un 20 y un 40% de probabilidad de implantación.
- Categoría C: Subóptimos. Son los embriones que presentan una serie de características que si bien van asociados a una menor viabilidad no son completamente descartables y serán transferidos si no se dispone de otro con mejor morfología, por eso también son conocidos como embriones acompañantes. Suelen tener algo menos de la mitad de posibilidades de implantar (1-20%) aunque siempre dependerá del tipo y extensión de las anomalías morfológicas que presentan.
- Categoría D: No viables. Tienen una capacidad de implantación del 1% o menos, incluso 0,1%. Incluyen tanto los embriones evolutivos in vitro, cuyas características están relacionadas con una falta de potencial implantatorio, como los que están bloqueados. No son transferidos prácticamente en ningún caso.
Evaluación de la calidad embrionaria
El objetivo de la fecundación in vitro es seleccionar y transferir un buen embrión para ello se siguen los Criterios de Valoración Morfológicos de Oocitos, Embriones tempranos y Blastocitos Humanos recogidos en el consenso ASEBIR. Este consenso se ha establecido estudiando características morfológicas de los embriones y determinando su capacidad de implantación. De esta manera, los parámetros morfológicos que ayudan a determinar la calidad embrionaria son los siguientes: número de células, velocidad de división, fragmentación, tamaño y simetría de las blastómeras, multinucleación, aspecto del citoplasma y zona pelúcida. Estudiando todos estos parámetros podemos determinar la calidad del embrión
- Número de células: El número de células es uno de los parámetros más importantes. El número de células óptimo en día 2 es de cuatro células y en día 3 es de siete u ocho células. Generalmente, los embriones que se encuentran dentro de estos límites son clasificados como embriones tipo A. Los embriones que presentan entre seis y diez células pueden ser viables y son embriones tipo B. Los embriones con cinco células o más de 10 se consideran embriones tipo C. No obstante, embriones que presentan un elevado número de células en día 2 y día 3 pueden tener una elevada probabilidad de presentar alteraciones cromosómicas tales como aneuploidías o blastómeras multinucleadas. El potencial de implantación de estos embriones es muy bajo por lo que se consideran embriones tipo D. Por otro lado, embriones con un bajo número de células en día 2 y día 3 se consideran bloqueados y su capacidad de implantación es muy baja (tipo D). En la siguiente tabla se observa la calidad del embrión en función del número de células en día 2 y 3:
| Grupo de calidad | Número de Células en día 2 | Número de Células en día 3 |
|---|---|---|
| A | 4 | 7 - 8 |
| B | 2 - 5 | 7 o más |
| B | 4 | 9 o más |
| C | 2 - 5 | 7 o más |
| C | 2 - 4 | 6 |
| C | 6 | 8 o más |
| C | 3 | 6 o más |
| D | 7 o más | Cualquier valor |
| D | Cualquier número | 5 o menos |
- Velocidad de división: La velocidad de división es otros de los parámetros más importantes. La velocidad de división normal es la que se observa en un embrión que dobla su número de células en 24 horas de día 2 a día 3 y es un pronóstico de viabilidad. Una velocidad mayor está asociada a anomalías cromosómicas, por lo que la calidad del embrión es mínima. Por otro lado una velocidad menor está relacionada con el bloqueo embrionario. Un embrión se considera bloqueado cuando no incrementa su número de células después de un periodo de 24 h. Este tipo de embriones también presenta una tasa de implantación muy baja porque se considera embrión no viable. El bloqueo cromosómico podría estar originado por anomalías cromosómicas del embrión o por condiciones de laboratorio no apropiadas.
- Fragmentación: El tercer parámetro en importancia es la fragmentación. La fragmentación consiste en la generación de porciones de citoplasma rodeadas por membrana sin núcleo. Las causas de aparición de fragmentos no se conocen, se estima que pueda ser una consecuencia de las condiciones del medio de cultivo o bien una propiedad inherente del desarrollo embrionario.El tamaño del fragmento, el número y la localización son elementos relativamente importantes. El tamaño del fragmento se estima como un porcentaje del total del embrión. Tamaños relativamente pequeños no están asociados con un deterioro de la capacidad de implantación, mientras que a medida que se incrementa el tamaño disminuye la calidad del embrión. Los embriones con un porcentaje de fragmentación inferior a 11% son considerados de tipo A; entre 11-25% se consideran embriones tipo B; entre 26-35% son embriones tipo C; cuando el porcentaje de fragmentación es mayor al 35% nos encontramos ante embriones tipo D. El número de fragmentos también es un factor importante, generalmente la presencia de fragmentos aislados no daña la capacidad de implantación del embrión, mientras que la presencia de numerosos fragmentos puede tener un efecto perjudicial sobre la calidad del embrión.
- Tamaño celular y simetría: El tamaño celular se considera normal cuando el tamaño de todas las blastómeras es similar, aunque generalmente existe una ligera asimetría en los embriones. La presencia de una asimetría elevada, con células que difieren entre sí un 20% del volumen total, puede considerarse de mal pronóstico, reduciéndose la calidad del embrión hasta embrión tipo C.
- Multinucleación:La multinucleación, es decir, presencia de uno o más núcleos en el interior de una célula puede estar originada por un error en la división celular, fragmentación del núcleo o una migración incorrecta de los cromosomas durante la anafase. Los embriones pueden mostrar blastómeras multinucleadas tanto en ensayos in vitro como in vivo. La ausencia de multinucleación se correlaciona con una elevada tasa de implantación y viceversa. De esta manera, la presencia de blastómeras multinucleadas en día 2 se asocia con baja capacidad de implantación (embriones tipo D); la presencia de blastómeras multinucleadas en día 2 y día 3 se correlaciona con embriones subóptimos (tipo C); y por último, la aparición de multinucleación en día 3 no afecta tanto a la capacidad implantatoria. La existencia de blastómeras multinucleadas está relacionada con embriones mosaicos y aneuploides.
- Aspecto del citoplasma: En el aspecto del citoplasma podemos evaluar distintos parámetros como la presencia de vesiculación, de vacuolas y de anillos acitoplasmáticos. Generalmente durante los primeros días de desarrollo el citoplasma presenta un aspecto claro, mientras que en el tercer día tiene lugar la activación del genoma embrionario, apareciendo vesículas que originan un aspecto granulado. Este cambio determina el correcto desarrollo del embrión pero presenta una gran relevancia para distinguir la capacidad implantatoria de un embrión. Por otra parte, la aparición de vacuolas y la contracción del citoplasma se correlacionan con la degeneración y lisis del embrión. Por lo que los embriones que presentan estas alteraciones en más de dos blastómeras se consideran anormales (tipo D). Generalmente se prolonga el cultivo de estos embriones hasta blastocito para observar su evolución.
- Zona pelúcida: La zona pelúcida es una capa de 15 a 20 µm de espesor que rodea y protege al ovocito maduro. La presencia de anomalías estructurales o funcionales en las glicoproteínas que forman la zona pelúcida puede originar problemas como la disminución de la viabilidad embrionaria y el descenso de la capacidad de implantación. El grosor de la zona pelúcida es determinante tanto para la viabilidad del embrión, como en su capacidad de eclosionar. Así si la zona pelúcida es delgada, el embrión puede eclosionar fácilmente, aumentándose la capacidad de implantación. Por el contrario, si la zona pelúcida es muy gruesa o presenta tabiques se dificulta la eclosión y la implantación del embrión.
Transferencia de embriones
Los embriones se puntúan por el embriólogo según el número de células, la paridad del crecimiento, el grado de fragmentación, el estado del citoplasma... Normalmente, para mejorar las posibilidades de implantación y embarazo, se transfieren varios embriones simultáneamente. El número de embriones que se transfieren depende del número disponible, la edad de la mujer, consideraciones diagnósticas y limitaciones legales (en algunos países, el número máximo se limita a dos o a tres, en España se pueden transferir un máximo de 3 embriones). Los embriones que se consideran "mejores" se transfieren al útero de la mujer a través de una cánula de plástico muy fino, que se introduce a través de la vagina y el cérvix y se controla mediante su visualización por ultrasonidos o ecoguiada. La cánula puede ser flexible, lo cual resulta más cara pero es el más recomendable ya que reduce el daño al introducirse por la vagina hasta llegar al útero. O cánula rígida, más barata pero menos eficaz. Hay que tener cuidado con estimular el útero al realizar la transferencia. Si se punza el útero con la cánula puede dar lugar a contracciones del útero, perjudiciales para la implantación del embrión tras la transferencia. Por lo tanto no son recomendadas la utilización de la pinzas Pozzi o cualquier instrumento que punce o agreda el cuello del útero ya que provoca contracciones perjudiciales para el embarazo. Para disminuir el riesgo de contracciones se le administra a la mujer receptora de los embriones progesterona, que es una hormona que relaja el músculo liso y evita las contracciones.
Tasas de éxito
En EE. UU. la tasa de nacidos vivos vía FIV es alrededor del 27% por ciclo (con una tasa de embarazo del 33%), pero las posibilidades de éxito varían mucho dependiendo de la edad de la mujer (o más concretamente, de la edad de los ovocitos que se utilizan).[11] Cuando se utilizan los propios ovocitos de la mujer (y no de donante), para mujeres por debajo de los 35 años la tasa de embarazo es alrededor de 43% por ciclo (36,5% de nacidos vivos), mientras que para mujeres por encima de 40 la tasa cae drásticamente, hasta sólo un 4% para mujeres por encima de 42 años.[12] Otros factores que determinan la tasa de éxito incluyen la calidad de los ovocitos y los espermatozoides, la salud del útero y la experiencia de la clínica. Normalmente se transfieren varios embriones simultáneamente, para mejorar la tasa de éxito, lo que tiene como contrapartida el riesgo de embarazo múltiple.
Una técnica reciente consiste en sumergir un embrión en un cultivo de nutrientes durante 5 días hasta que alcanza el estadio de blastocisto. Los médicos determinan entonces qué embriones son los que tienen más posibilidades de desarrollarse. Los de mejor calidad se transfieren al útero de la mujer. De esta manera es posible mejorar la tasa de embarazo sin aumentar el riesgo de embarazo múltiple. Esta es una técnica relativamente nueva y está en fase de experimentación.
Las clínicas con programas de FIV generalmente publican sus tasas de embarazo. Sin embargo, es difícil hacer comparaciones entre clínicas, debido a que los resultados son la consecuencia de muchas variables. Además, los resultados también dependen mucho del tipo de pacientes seleccionados.
Hay muchas razones por las cuales puede no conseguirse un embarazo después de un tratamiento de FIV y transferencia de embriones, entre las cuales se incluyen:
- El momento de la ovulación puede haberse interpretado mal, o tal vez no se pueda predecir, o puede que no ocurra.
- Los intentos de obtener ovocitos que se desarrollen durante el ciclo controlado pueden no tener éxito.
- Los ovocitos obtenidos pueden ser anormales o pueden haber sido dañados durante la extracción.
- Tal vez no se pueda disponer de una muestra de semen adecuada.
- La fecundación de los ovocitos para generar embriones puede no ocurrir.
- La división celular de los ovocitos fecundados puede no tener lugar.
- El embrión puede que no se desarrolle normalmente.
- Puede que la implantación no tenga lugar.
- Fallos con los equipos, infecciones o errores humanos u otros factores imprevistos e incontrolables, que pueden resultar en pérdida o daño de los ovocitos, de la muestra de semen o de los embriones[4]
De acuerdo con un estudio sueco del año 2005 publicado en la revista de Oxford "Human Reproduction",[5] 166 mujeres fueron controladas comenzando un mes antes de sus ciclos de FIV, y los resultados no mostraron correlación significativa entre los resultados de la FIV y el estrés psicológico. El estudio concluía con la recomendación a las clínicas de que si se informaba a los pacientes de FIV de los resultados de dicho estudio, podría ser posible reducir el estrés experimentado durante el protocolo de tratamiento. Aunque tal vez el estrés psicológico experimentado durante un ciclo puede no afectar al resultado de la FIV, es posible que la experiencia de la FIV pueda resultar en estrés que aumente las probabilidades de depresión. Sólo las consecuencias económicas de la FIV (si se recurre a una clínica privada) pueden generar ansiedad y resultar abrumadoras. Sin embargo, para muchas parejas la alternativa es la infertilidad, y la experiencia de la infertilidad en sí misma también puede causar estrés y depresión.
Complicaciones
La mayor complicación de la FIV es el riesgo de embarazo múltiple.[13] Este está relacionado directamente con la práctica de transferir embriones múltiples para aumentar la tasa de embarazo. Los embarazos múltiples están relacionados con un incremento en el riesgo de aborto, complicaciones obstétricas, nacimiento prematuro y morbilidad neonatal con la posibilidad de daño a largo plazo. En muchos países existen límites estrictos al número máximo de embriones que pueden transferirse, para reducir el riesgo de embarazo múltiple (trillizos o más). También puede ocurrir una división espontánea del embrión en el útero (como en un embarazo natural), pero éste es un caso raro, que genera gemelos idénticos. Un estudio clínico randomizado doble ciego siguió los embarazos tras FIV que generaron 73 bebés (33 niños y 40 niñas) y concluyó que el 8.7% de los bebés únicos y el 54.2% de los gemelos tenían un peso al nacer < 2500 gr.[6] En ciclos donde se transfieren dos embriones la probabilidad de tener un embarazo gemelar es del 6%. En ciclos donde se transfieren tres embriones la probabilidad de tener un embarazo gemelar es del 12% y de tener un embarazo triple es del 3%.
Otro riesgo de la estimulación ovárica es el desarrollo del síndrome de hiperestimulación ovárica, con un riesgo para la paciente inferior al 1%.
Si el problema de infertilidad subyacente está relacionado con anormalidades en la espermatogénesis, es posible que la descendencia masculina tenga mayor riesgo de presentar el mismo problema.
Defectos en los bebés
El tema de la presencia de defectos asociados a la técnica de FIV permanece controvertido. La mayoría de los estudios muestran que no existe un incremento significativo tras una FIV, mientras que otros no apoyan este hecho.[7]
Algunos investigadores consideran que manipular gametos y embriones fuera del cuerpo podría estimular la aparición de cambios genéticos (mutaciones) que se pueden manifestar como defectos congénitos en el nacimiento.[8] Aunque no hay evidencia genética que apoye esta idea, algunos estudios epidemiológicos sugieren una posible conexión entre la reproducción asistida y síndromes genéticos poco frecuentes en recién nacidos, como el síndrome de Beckwith-Wiedemann, que se caracteriza por nacimiento prematuro, lengua más grande de lo normal y mayor susceptibilidad a tumores y defectos respiratorios y oratorios.[9] Este síndrome es raro: afecta sólo a 1 de cada 12.000 recién nacidos en todo el mundo, pero algunos estudios sugieren que es más frecuente en niños nacidos con técnicas de reproducción asistida.[10][11]
Sin embargo, el riesgo absoluto de tener un bebé que presente el síndrome de Beckwith-Wiedemann es bajo, por lo que los expertos encuentran difícil aconsejar a una pareja con problemas de fertilidad no seguir adelante con las técnicas de reproducción asistida. Algunos investigadores sugieren que tal vez podrían reducirse los riesgos potenciales si se evitan ciertos procedimientos invasivos cuando no sean estrictamente necesarios, como las biopsias de embriones implantados, el cultivo de embriones en el laboratorio por periodos superiores al mínimo necesario y el uso de ICSI en ausencia de problemas de fertilidad masculina.
Criopreservación
Criopreservación de embriones
Cuando se generan embriones múltiples tras la FIV, los pacientes pueden elegir congelar los embriones que no se transfieren al útero de la mujer. Esos embriones se mantienen en nitrógeno líquido congelados hasta un máximo de 5 años. Según se publicó en 2006, en EE. UU. había cerca de 500 000 embriones congelados.[14] La ventaja es que los pacientes que no consiguen concebir tras el primer ciclo pueden reintentarlo utilizando los embriones congelados, sin tener que realizar de nuevo un ciclo de FIV completo: sólo tendrían que realizar la transferencia de dichos embriones, sin pasar de nuevo por la estimulación, la extracción y la fecundación. O, en el caso de pacientes que consiguen un embarazo, pueden mantenerlos para un segundo embarazo posterior. Los embriones restantes procecentes de FIV pueden donarse a otras mujeres o parejas para reproducción o para investigar con ellos.
Existen diferentes técnicas para criopreservar (congelar) embriones, cada una con diferentes posibilidades de lograr la supervivencia. En la actualidad el método más efectivo es la vitrificación (supervivencia de hasta 98 %) [15], lo que a su vez ser refleja en una posibilidad de hasta el 50 % de embarazo con embriones congelados, según reportes en la literatura médica [16].
Si, a pesar de todo, siguen existiendo embriones criopreservados que, por el tiempo transcurrido o por otras razones, no vayan a utilizarse para su implantación, las dos alternativas posibles (que normalmente están reguladas por leyes estrictas) son la donación para la investigación y la destrucción. En el caso de donación de embriones para investigación, ésta se debe llevarse a cabo en centros acreditados y sobre la base de proyectos autorizados por las autoridades correspondientes. Normalmente, se establecen plazos postfecundación para la investigación en los embriones y, una vez terminada la investigación, no se permite llevar a cabo una transferencia embrionaria con ellos. La investigación con embriones procedentes de FIV ha permitido hasta el momento la realización de estudios en células madre, de gran importancia en la comprensión del desarrollo embrionario y en el avance de las terapias regenerativas de tejidos. En cuanto a la destrucción de los embriones congelados, se considera como última alternativa, a petición explícita de los progenitores, o bien cuando no los quieran para ellos y no hayan autorizado la donación a otras parejas ni la investigación en ellos. Tanto la utilización de embriones para fines de investigación como su destrucción generan extensos debates éticos entre partidarios y oponentes, que se traducen en leyes que limitan las posibilidades existentes, muy variables dependiendo de los países.
Criopreservación de ovocitos
La criopreservación de ovocitos maduros sin fertilizar ha sido llevada a cabo con éxito, por ejemplo en mujeres que tienen alta probabilidad de perder sus reservas de ovocitos debido a que deben ser sometidas a un proceso de quimioterapia.[12]
Criopreservación del tejido ovárico
La criopreservación del tejido ovárico interesa a las mujeres que quieren preservar su función reproductora más allá del límite natural, o cuya capacidad reproductiva está amenazada por una terapia agresiva contra el cáncer, por ejemplo.[13][14] La investigación en este terreno es prometedora.
Intervenciones asociadas
Existen algunas variaciones o mejoras de la FIV, tales como ICSI, IMSI, ZIFT, GIFT y PGD.
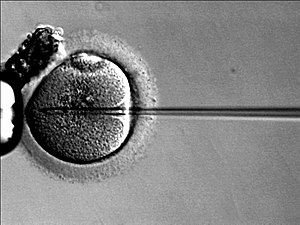
ICSI
La inyección intracitoplasmática de espermatozoides (ICSI) es un desarrollo reciente asociada a la FIV que permite inyectar directamente un espermatozoide en el citoplasma del ovocito utilizando técnicas de micromanipulación. Se utiliza cuando los espermatozoides tienen dificultades para penetrar en el ovocito, y en ese caso se puede utilizar esperma del compañero o de donante. La ICSI también se utiliza cuando el recuento de espermatozoides es muy bajo.
Inyección intra citoplasmática de espermatozoides morfológicamente seleccionados (IMSI)
La IMSI o Inyección intra citoplasmática de espermatozoides morfológicamente seleccionados (del inglés: Intracytoplasmic morphologically-selected sperm injection) es una técnica de fecundación in vitro (FIV). Consiste en realizar una selección morfológica de los espermatozoides antes de inyectarlos en los ovocitos.
Se selecciona un espermatozoide utilizando un microscopio invertido con una magnificación de más de 6000 veces su tamaño con el fin de observar con más precisión la composición de la cabeza de los espermatozoides, detectando posibles anomalías de las vacuolas o los daños de la cadena de ADN de los espermatozoides y escogiendo solo los que no presentan anomalías para proceder a la fertilización con los ovocitos.
Eclosión Asistida (Assisted Hatching)
Antes de la transferencia, los embriones están envueltos por una capa de glicoproteinas y, para lograr un embarazo, los embriones deben romper y salir de esta envoltura antes de implantarse. Está envuelta se llama zona pelúcida y la eclosión asistida (assisted hatching) consiste en realizar un orificio en esta zona para facilitar el proceso de eclosión del embrión y así aumentar la tasa de implantación.
La eclosión asistida(también llamada AHA) es una técnica que se lleva utilizando desde los años 80, cuando se vio que los embriones de PZD (disección parcial de la zona pelúcida)efectivamente parecían tener una tasa de implantación más alta que los embriones normales. Este método se puede realizar cualquier día de desarrollo, aunque normalmente se suele hacer en el tercero.
Existen diferentes formas de hacer Eclosión Asistida, ya sea por el método químico, mecánico o con láser. Este último es el que ha ganado más popularidad por sus buenos resultados. Método químico: consiste en introducir ácido de Tyroide, que es una solución salina tamponada con un pH de 2,5 (con un margen de error de 0,3), en una pipeta de AHA. Al embrión, por otra parte, se le tiene sujetado con una micropioeta de sujeción y en una solución de 20 microlitros de HEPES. Se acerca la pipeta con la solución de Tyrode y se libera en las cercanías del embrión. La zona pelúcida se va degradando, ya que al ser un pH tan bajo, se desnaturalizan las proteínas que la forman, dando lugar a un orificio en esa zona.Una vez formado, se aspira con la pipeta esta solución para que no afecte al interior del embrión, y alejamos al embrión de esta zona. La ventaja de este método es que es económico y los extremos son suaves. Los inconvenientes que tiene este método son: el embrión se expone a una solución ácida incrementando el riesgo de daño de este y, además, la apertura es permanente con lo que puede ser perjudicial por afectar al medio interno del embrión.
Método mecánico: este método se realiza en 20 microlitros de medio con HEPES y consiste en fijar con una pipeta de sujeción el embrión, por otra parte se toma una pipeta (PZD) con la que se atraviesa tangencialmente la zona pelúcida. Una vez atravesado el embrión, se suelta y se rasga la zona contra la pipeta de sujeción. En este caso como resultado final obtenemos un ojal que se mantiene cerrado y por el cual después el embrión le será fácil salir e implantar. El ojal puede tener unas dimensiones de 50 micras aproximadamente. Las ventajas que tiene este método son: que el embrión está más protegido por el efecto que hace el ojal, es más natural que los demás métodos y además es más barato. En cambio su inconveniente es: que es difícil de aprender, además de laborioso.
Método físico(láser): este método se realiza en un medio con HEPES en donde se encuentra el embrión. El láser de diodo infrarrojo (1,48 micras) se apunta y dispara, a través del objetivo, cerca de donde se encuentra el embrión. Se puede variar el tiempo de acción del láser (0,1 a 50 ms). El láser calienta localmente el agua, y al aumentar la temperatura hace que las proteínas que constituyen la zona pelúcida cercanas al láser se desnaturalicen y así se origine un orificio. La forma del orificio del láser es un ojal abierto siempre mayor al que se ve en el plano del microscopio. La ventaja de este método es que es muy rápido además de reproducible, en cambio sus desventajas son: es muy caro, se expone al embrión a un riesgo como es el propio láser, y la abertura es permanente además de que es más grande de lo que parece y esto como hemos dicho antes puede afectar al embrión.
Hay que decir que esta técnica solo ofrece ventajas en los siguientes casos: -mujeres mayores de 37 años. -Fallo de gestación tras FIV/ICSI.
y otras indicaciones propuestas pero aún no demostradas: -Zona pelúcida anormal. -Mala calidad embrionaria. -Baja respuesta ovárica.
Por último, es oportuno decir que también se ha intentado la eclosión total del embrión a través del método químico o con pronasa. Sólo es posible realizarlo en estadio de blastocisto, ya que si se hiciera antes se disgregaría el embrión en sus blastómeras. Pero esta técnica apenas se utiliza en el laboratorio.
Transferencia intrafalopiana de cigotos
En la transferencia intrafalopiana de cigotos (ZIFT en inglés), los ovocitos se extraen de la mujer, fecundados in vitro, y los embriones se sitúan en las trompas de Falopio, en lugar de en el útero.
TGIF
En la TGIF (GIFT en inglés), los ovocitos se extraen de la mujer, y se sitúan en una de las trompas de Falopio, junto con los espermatozoides del varón. Por tanto, esta variación es en realidad una fecundación in vivo y no in vitro.
DGP
El DGP puede realizarse en los embriones previamente a la transferencia. Un test similar pero más general es el haplotipado genético preimplantación o HGP (PGH en inglés). Sin embargo, la tasa de éxito de la DGP es baja.
Mini FIV
También denominada Soft-FIV, o FIV-suave, tiene la particularidad de estimular el ovario de forma muy sutil con el empleo mínimo de medicamentos hormonales. El resto de etapas en las técnicas de mini FIV son exactamente las mismas que en FIV tradicional. Esta técnica está recomendada para mujeres con buen pronóstico, pacientes que no pueden recibir una estimulación de óvulos completa o para mujeres que no desean recibir un tratamiento hormonal más agresivo. En definitiva, es un tratamiento más natural, menos costoso pero que no es válido para todos los casos.
Historia
El primer embarazo conseguido mediante FIV con un ovocito humano fue descrito por el equipo de Monash en la revista The Lancet en 1973, aunque sólo duró algunos días y hoy en día se denominaría un embarazo bioquímico. A continuación se publicó un embarazo ectópico en las trompas por Steptoe y Edwards en 1976,[15] que resultó en el nacimiento de Louise Brown el 25 de julio de 1978 en Oldeham and District General Hospital de Láncashire, cerca de Mánchester (Reino Unido)[16] y de otro bebé desconocido, los primeros bebés FIV. Robert G. Edwards recibió el Premio Nobel de Fisiología y Medicina 2010 por el desarrollo de la fecundación in vitro'.[17]
Después tuvo lugar el nacimiento de Candice Reed en Melbourne en 1980. La utilización del uso de ciclos estimulados con citrato de clomifeno y el uso de gonadotropina coriónica humana (hCG) para controlar el momento de la maduración de los ovocitos, permitiendo así controlar el momento de la extracción, convirtió a la FIV de una herramienta de investigación en un tratamiento clínico.
A continuación se produjeron 14 embarazos, seguidos de 9 nacimientos en 1981 con el equipo universitario de Monash. El equipo de Jones en Norfolk, Virginia, mejoró los ciclos de estimulación incorporando el uso de una hormona estimulante de los folículos (uHMG). Esto se dio a conocer con el nombre de hiperestimulación ovárica controlada (HOC). Otro paso adelante fue el uso de agonistas de la hormona que libera la gonadotropina (GnRH-A), disminuyendo así la necesidad de control al prevenir la ovulación prematura, y más recientemente antagonistas de la hormona que libera la gonadotropina (GnRH-Ant), con una función similar. El uso adicional de contraceptivos orales ha permitido la programación de los ciclos de FIV, lo que hace el tratamiento más fácil de realizar para los médicos y los pacientes.
En la Clínica Dexeus se realizó la primera fecundación in vitro de España el 12 de julio de 1984, por el ginecólogo Pedro Barri y la bióloga Anna Veiga.[18]
La capacidad de congelar y posteriormente descongelar y transferir embriones también ha mejorado significativamente la efectividad de la FIV. Otro momento significativo fue el desarrollo de la inyección intracitoplasmática de espermatozoides (ICSI) por Gianpiero Palermo en Bruselas, en 1992. Esto ha permitido que hombres con una producción mínima de espermatozoides consigan embarazos, a veces conjuntamente con recuperación de esperma, utilizando una aguja testicular fina o una biopsia testicular abierta, de manera que incluso hombres con el síndrome de Klinefelter pueden a veces conseguir un embarazo. Por tanto, la FIV se ha convertido en la solución de la mayoría de los problemas de infertilidad, desde problemas en las trompas hasta factores masculinos, subfertilidad idiopática, endometriosis, edad materna avanzada y anovulación.
Véase también
- Jacques Testart (1939) biólogo francés.
- Louise Brown (1978), primera «bebé probeta».
- Reproducción asistida.
- Donación de esperma
Referencias
- ↑ Urbina MT. Optimización de la eficiencia de la Fecundación in vitro. En: Urbina MT, Lerner J. Fertilidad y Reproducción Asistida. Caracas: Editorial Médica Panamericana. 2008. Disponible en : https://www.researchgate.net/publication/281525794_Optimizacin_de_a_Eficiencia_de_la_Fecundacin_in_vitro
- ↑ Ballantyne C. (2008). «Better tests boost IVF success.». Nature Medicine 14 (1169). [1]
- ↑ Papanikolaou EG, Camus M, Kolibianakis EM, Van Landuyt L, Van Steirteghem A, Devroey P (2006). «In Vitro Fertilization with Single Blastocyst-Stage versus Single Cleavage-Stage Embryos». N Engl J Med 354: 1139. PMID 16540614. doi:10.1056/NEJMoa053524.
- ↑ Abington Reproductive Medicine, In Vitro Fertilization (IVF): Why Pregnancy May Not Occur. (2006)
- ↑ Anderheim L, Holter H, Bergh C, Möller A. (2005). «Does psychological stress affect the outcome of in vitro fertilization?». Hum Reprod. 20 (10). 2969-75. [2]
- ↑ Olivennes F, Mannaerts B, Struijs M, Bonduelle M, Devroey P (2001). «Perinatal outcome of pregnancy after GnRH antagonist (ganirelix) treatment during ovarian stimulation for conventional IVF or ICSI: a preliminary report». Hum. Reprod. 16 (8): 1588-91. PMID 11473947. doi:10.1093/humrep/16.8.1588.
- ↑ Kurinczuk JJ (2003). «Safety issues in assisted reproduction technology. From theory to reality--just what are the data telling us about ICSI offspring health and future fertility and should we be concerned?». Hum Reprod 18 (5): 925-31. PMID 12721163. doi:10.1093/humrep/deg217.
- ↑ Nayr P. (2008). «As IVF becomes more common, some concerns remain.». Nature Medicine 14 (1171). [3]
- ↑ Lucifero, Diana; Chaillet, J.Richard; Trasler, Jacquetta M. (2004), «Potential significance of genomic imprinting defects for reproduction and assisted reproductive technology», Human Reproduction Update 10 (1): 3-18, PMID 15005460, doi:10.1093/humupd/dmh002.
- ↑ Debaun, M.R.; Niemitz, E.L.; Feinberg, A.P. (2003), «Association of in Vitro Fertilization with Beckwith-Wiedemann Syndrome and Epigenetic Alterations of …», The American Journal of Human Genetics 72 (1): 156-160, doi:10.1086/346031.
- ↑ Maher, E. R.; Brueton, L. A.; Bowdin, S. C.; Luharia, A.; Cooper, W.; Cole, T. R.; MacDonald, F.; Sampson, J. R.; Barratt, C. L.; Reik, W.; Hawkins, M. M. (2003), «Beckwith-Wiedemann syndrome and assisted reproduction technology (ART)», Journal of Medical Genetics 40 (1): 62-64, PMID 12525545, doi:10.1136/jmg.40.1.62.
- ↑ Porcu E, Fabbri R, Damiano G, Fratto R, Giunchi S, Venturoli S (2004). «Oocyte cryopreservation in oncological patients». Eur J Obstet Gynecol Reprod Biol. 113 Suppl 1: S14-6. PMID 15041124. doi:10.1016/j.ejogrb.2003.11.004.
- ↑ Donnez J, Dolmans MM, Demylle D, Jadoul P, Pirard C, Squifflet J, Martinez-Madrid B, van Langendonckt A. (2004). «Livebirth after orthotopic transplantation of cryopreserved ovarian tissue.». Lancet 364 (9443). 1405-10. [4]
- ↑ Sánchez M, Novella-Maestre E, Teruel J, Ortiz E, Pellicer A. (2008). «The Valencia programme for fertility preservation». Clin Transl Oncol. 10. doi:10.1007/s12094-008-0227-4. 433-438. []
- ↑ Steptoe PC, Edwards RG. (1976). «Reimplantation of a human embryo with subsequent tubal pregnancy.». Lancet 1 (7965). 880-2. [5]
- ↑ Fernández Crehuet, Joaquín y Gómez García, Enrique. 1994. “Fecundación in vitro y transferencia de embriones (FIVET)”. Anuario Filosófico. 163-177.
- ↑ [6], La página web oficial de los Premios Nobel.
- ↑ La primera niña probeta cumple 25 años, El Mundo, 9 de julio de 2009.
Bibliografía adicional
- George, Robert P.; Tollefsen, Christopher (2012). Embrión: una defensa de la vida humana. Ediciones Rialp. ISBN 9788432142345.
Enlaces externos
- En MedlinePlus hay más información sobre Fecundación in vitro
