2-Pirona
| 2-Piranona, α-Pirona | ||
|---|---|---|
 [1] [1] | ||
| Nombre IUPAC | ||
| Piran-2-ona | ||
| General | ||
| Fórmula semidesarrollada | C5H4O2 | |
| Fórmula estructural |
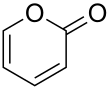 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 504-31-4[2] | |
| ChEBI | 37965 | |
| ChEMBL | CHEMBL1934663 | |
| ChemSpider | 61462 | |
| PubChem | 68154 | |
| UNII | 8WW45I202V | |
| Propiedades físicas | ||
| Densidad | 1,197 kg/m³; 0,001197 g/cm³ | |
| Masa molar | 96,08 g/mol | |
| Punto de fusión | 153/−154 °C (426/119 K) | |
| Índice de refracción (nD) | 1,5298 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La 2-pirona (α-pirona o piran-2-ona) es un compuesto insaturado heterocíclico. Puede ser considerado químicamente como un derivado del pirano o una lactona insaturada de cinco carbonos. Es utilizada en síntesis orgánica como precursor de diversos compuestos.
Síntesis
[editar]Las 2-pironas se pueden sintetizar por diversos métodos:
- Por descarboxilación del ácido cumálico, sintetizado a partir del tratamiento del ácido málico en ácido sulfúrico caliente:[3]

- Por condensación de alquinil cetonas con aniones del malonato de etilo:[4]

- Por una reacción de Prins entre el ácido buten-3-enoico con lactonización subsecuente, en donde primero se obtiene 5,6-dihidro-2-pirona. Esta es bromada con NBS en posición alílica, para después eliminar ácido bromhídrico:[5]

- Por esterificación de un 1,3-cetoaldehído en su forma de enol con un ácido dietoxifosfinilalcanoico. En el paso final se produce un cierre de anillo por una reacción de Horner-Wadsworth-Emmons intramolecular.[6]

Reacciones
[editar]Halogenación
[editar]La bromación se lleva a cabo por sustitución electrófila aromática en la posición 3 utilizando bromo y tetracloruro de carbono como solvente:[7]

Nitración
[editar]La nitración de la 2-pirona se lleva a cabo en la posición 5 utilizando tetrafluoroborato de nitroilo en presencia de nitrometano:[8]

Amonólisis
[editar]La 2-pirona reacciona con amoniaco acuoso para productir 2-piridinona:[9]
Reacciones pericíclicas
[editar]La 2-pirona puede reaccionar con un dienófilo para dar un aducto Diels-Alder en el cual, por extrusión de bióxido de carbono se pueden formar derivados del benceno (Con alquinos) o del ciclohexeno.[10]

Se han reportado cicloadiciones intramoleculares durante la síntesis de vitaminas D.[11]

Alquilaciones y acilaciones
[editar]La síntesis de Gogte es un método de alquilación y acilación de 2-pironas, en donde se utilizan halogenuros de acilo en presencia de piridina.[12]

Presencia en la naturaleza
[editar]El sistema 2-pirona está presente en los bufanólidos y las kavalactonas.
Referencias
[editar]- ↑ 2H-Pyran-2-one at Sigma-Aldrich
- ↑ Número CAS
- ↑ Wiley, R. H. and Smith, N. R., Org. Synth., Coll. Vol. IV, 1963, 201.
- ↑ Anker, R. M. and Cook, A. H., J. Chem. Soc, 1945, 311.
- ↑ Nakagawa, M., Saegusa, J., Tonozuka, M., Obi, M., Kiuchi, M., Hino, T., and Ban, Y., Org, Synth., Coll. Vol. VI, 1988, 462.
- ↑ Stetter, H. and Kogelnik, H.-J., Synthesis, 1986, 140.
- ↑ Pirkle, W. H. and Dines, M., J. Org. Chem., 1969, 34, 2239.
- ↑ Pirkle, W. H. and Dines, M., J. Heterocycl. Chem., 1969, 6, 313.
- ↑ Collie, J. N. and Wilsmore, N. T. M., J. Chem. Soc, 1896, 293.
- ↑ Woodard BT, Posner G H. "Recent Advances in Diels-Alder Cycloadditions Using 2-Pyrones." Advances in Cycloaddition. 1999, 5, 47-83.
- ↑ Cheon-Gyu Cho, Gary H. Posner (1998). «Asymmetric Intramolecular Diels-Alder Cycloadditions of 2-Pyrone-3-carboxylates and synthesis of vitamin D 3. A ring phosphine oxide.». Bull.Korean Chem. Soc. 19 (9): 957-961.
- ↑ C. R. Gogte, Proc. Indian Acad. Sci. 7A, 214 (1938)

