Autoinmunidad
| Autoinmunidad | ||
|---|---|---|
 | ||
| Especialidad | Inmunología | |
La autoinmunidad es el sistema de respuestas inmunitarias de un organismo contra sus propias células y tejidos sanos. Cualquier enfermedad que resulte de una respuesta inmune tan aberrante se denomina "enfermedad autoinmune". Ejemplos destacados incluyen celiaquía, IBS postinfecciosa, diabetes mellitus tipo 1, púrpura de Schönlein-Henoch (HSP), sarcoidosis, lupus eritematoso sistémico (SLE), síndrome de Sjögren, Síndrome de Churg-Strauss, tiroiditis de Hashimoto, Enfermedad de Graves-Basedow, púrpura trombocitopénica idiopática, enfermedad de Addison, artritis reumatoide (AR), espondilitis anquilosante, polimiositis (PM), dermatomiositis (DM) y esclerosis múltiple (EM). Las enfermedades autoinmunes se tratan muy a menudo con esteroides.[1]
Historia
[editar]A finales del siglo XIX se creía que el sistema inmunológico no podía reaccionar contra los propios tejidos del cuerpo. Paul Ehrlich, a principios del siglo XX, propuso el concepto de horror autotoxicus. Más tarde, Ehrlich ajustó su teoría para reconocer la posibilidad de ataques de tejido autoinmune, pero creía que ciertos mecanismos de protección innatos evitarían que la respuesta autoinmune se volviera patológica.
En 1904 esta teoría fue desafiada por el descubrimiento de una sustancia en el suero de pacientes con hemoglobinuria paroxística fría que reaccionaba con los glóbulos rojos. Durante las siguientes décadas, una serie de condiciones podrían estar relacionadas con las respuestas autoinmunes. Sin embargo, el estatus de autoridad del postulado de Ehrlich obstaculizó la comprensión de estos hallazgos. La inmunología se convirtió en una disciplina bioquímica más que clínica.[2] En la década de 1950, la comprensión moderna de los autoanticuerpos y las enfermedades autoinmunes comenzó a extenderse. Más recientemente se ha aceptado que las respuestas autoinmunes son una parte integral del sistema inmunológico de los vertebrados (autoinmunidad natural).[3]
Autoinmunidad de bajo nivel
[editar]Si bien un alto nivel de autoinmunidad no es saludable, un bajo nivel de autoinmunidad en realidad puede ser beneficioso. Llevando más allá la experiencia de un factor beneficioso en la autoinmunidad, se podría plantear la hipótesis con la intención de demostrar que la autoinmunidad es siempre un mecanismo de autodefensa del sistema de los mamíferos para sobrevivir. El sistema no pierde aleatoriamente la capacidad de distinguir entre lo propio y lo no propio, el ataque a las células puede ser la consecuencia de los procesos metabólicos cíclicos necesarios para mantener la química sanguínea en homeostasis.
En segundo lugar, la autoinmunidad puede tener un papel al permitir una respuesta inmune rápida en las primeras etapas de una infección cuando la disponibilidad de antígenos extraños limita la respuesta (es decir, cuando hay pocos patógenos presentes). En un estudio, se inyectó inhibidores de anticuerpos MHC de clase II en ratones que expresan un solo tipo de molécula de MHC de clase II (H-2b) para prevenir temporalmente la interacción T CD4+ - células MHC. Las células T CD4 + inexpertas (aquellas que no han encontrado ningún antígeno antes) recuperadas de estos ratones 36 horas después de la administración de anti-MHC mostraron una menor capacidad de respuesta al antígeno de péptido de citocromo c de paloma, según lo determinado por la fosforilación, proliferación y producción de interleucina 2 de ZAP70. Demostrando que el auto-reconocimiento del MHC (que, si es demasiado fuerte, puede contribuir a la enfermedad autoinmune) mantiene la capacidad de respuesta de las células T CD4 + cuando no hay antígenos extraños.[4]
Tolerancia inmunológica
[editar]El trabajo de Noel Rose y Ernst Witebsky (Nueva York) junto a Ivan Roitt y Deborah Doniach (University College de Londres) proporcionó evidencia clara de que, al menos en términos de células B productoras de anticuerpos (linfocitos B), enfermedades como la artritis reumatoide y la tirotoxicosis están asociadas con pérdida de tolerancia inmunológica, que es la capacidad de un individuo de ignorar su "yo", mientras reacciona a lo "no-yo". Esta ruptura lleva a que el sistema inmunológico desarrolle una respuesta inmunitaria eficaz y específica contra los autodeterminantes. La génesis exacta de la tolerancia inmunológica aún es difícil de alcanzar, pero se han propuesto varias teorías desde mediados del siglo XX para explicar su origen.
Tres hipótesis han ganado una amplia atención entre los inmunólogos:
- Teoría de la deleción clonal, propuesta por Frank Macfarlane Burnet, según la cual las células linfoides autorreactivas se destruyen durante el desarrollo del sistema inmunológico de un individuo. Por su trabajo, Frank M. Burnet y Peter B. Medawar fueron galardonados con el Premio Nobel de Fisiología o Medicina de 1960 "por el descubrimiento de la tolerancia inmunológica adquirida".
- Teoría de la anergia clonal, propuesta por Gustav Nossal, en la que las células T o B autorreactivas se inactivan en el individuo normal y no pueden amplificar la respuesta inmune.[5]
- Teoría de la red de idiotipos, propuesta por Jerne, en la que una red de anticuerpos capaces de neutralizar los anticuerpos autorreactivos existe naturalmente dentro del cuerpo.[6]
Además, otras dos teorías están bajo investigación:
- Teoría de la ignorancia clonal, según la cual las células T autorreactivas que no están representadas en el timo madurarán y migrarán a la periferia, donde no encontrarán el antígeno apropiado por tratarse de tejidos inaccesibles. En consecuencia, las células B autorreactivas, que escapan a la deleción, no pueden encontrar el antígeno o la célula T colaboradora específica.[7]
- Población supresora o teoría de células T reguladoras, en la que los linfocitos T reguladores (comúnmente células CD4+ FoxP3+, entre otras) funcionan para prevenir, regular a la baja o limitar las respuestas inmunitarias autoagresivas en el sistema inmunológico.
La tolerancia también se puede diferenciar en tolerancia "central" y "periférica", dependiendo de si los mecanismos de control antes mencionados operan o no en los órganos linfoides centrales (timo y médula ósea) o en los órganos linfoides periféricos (ganglio linfático, bazo, etc., donde las células B autorreactivas pueden destruirse). Debe enfatizarse que estas teorías no son mutuamente excluyentes, y se ha ido acumulando evidencia que sugiere que todos estos mecanismos pueden contribuir activamente a la tolerancia inmunológica de los vertebrados.
Una característica desconcertante de la pérdida documentada de tolerancia observada en la autoinmunidad humana espontánea es que está casi totalmente restringida a las respuestas de autoanticuerpos producidas por los linfocitos B. La pérdida de tolerancia por parte de las células T ha sido extremadamente difícil de demostrar, y cuando hay evidencia de una respuesta anormal de las células T, generalmente no es frente al antígeno reconocido por los autoanticuerpos. Por tanto, en la artritis reumatoide hay autoanticuerpos contra IgG Fc pero aparentemente no hay una respuesta de células T correspondiente. En el lupus sistémico existen autoanticuerpos contra el ADN, que no pueden provocar una respuesta de las células T, y la evidencia limitada de las respuestas de las células T implica a los antígenos de nucleoproteínas. En la enfermedad celíaca existen autoanticuerpos contra la transglutaminasa tisular, pero la respuesta de las células T es a la proteína extraña gliadina. Esta disparidad ha llevado a la idea de que la enfermedad autoinmune humana en la mayoría de los casos (con probables excepciones, incluida la diabetes tipo I) se basa en una pérdida de tolerancia de las células B que hace uso de las respuestas normales de las células T a los antígenos extraños en una variedad de formas aberrantes.[8]
Inmunodeficiencia y autoinmunidad
[editar]Existe una gran cantidad de síndromes de inmunodeficiencia que presentan características clínicas y de laboratorio de autoinmunidad. La capacidad disminuida del sistema inmunológico para eliminar infecciones en estos pacientes puede ser responsable de causar autoinmunidad a través de la activación perpetua del sistema inmunológico.[9]
Un ejemplo es la Inmunodeficiencia común variable (IDCV) donde se observan múltiples enfermedades autoinmunes, por ejemplo: enfermedad inflamatoria intestinal, trombocitopenia autoinmune y enfermedad tiroidea autoinmune.
La linfohistiocitosis hemofagocítica familiar, una inmunodeficiencia primaria autosómica recesiva, es otro ejemplo. En estos individuos se observan con frecuencia pancitopenia, erupciones cutáneas, inflamación de los ganglios linfáticos y agrandamiento del hígado y el bazo. Se cree que la causa es la presencia de múltiples infecciones virales no eliminadas debido a la falta de perforina.
Además de las infecciones crónicas y/o recurrentes, también se observan en la agammaglobulinemia ligada al cromosoma X (XLA) muchas enfermedades autoinmunes, como artritis, anemia hemolítica autoinmune, esclerodermia y diabetes mellitus tipo 1. Las infecciones bacterianas y fúngicas recurrentes y la inflamación crónica del intestino y los pulmones también se observan en la enfermedad granulomatosa crónica (EGC). La CGD es causada por la disminución de la producción de nicotinamida adenina dinucleótido fosfato (NADPH) oxidasa por los neutrófilos. Se observan mutaciones hipomórficas de RAG en pacientes con enfermedad granulomatosa de la línea media; un trastorno autoinmune que se observa comúnmente en pacientes con granulomatosis con poliangeítis y linfomas de células T/NK.
Los pacientes con síndrome de Wiskott-Aldrich (WAS) también presentan eccema, manifestaciones autoinmunes, infecciones bacterianas recurrentes y linfoma.
En la poliendocrinopatía autoinmune-candidiasis-distrofia ectodérmica (APECED) también coexisten autoinmunidad e infecciones: manifestaciones autoinmunes específicas de órganos (por ejemplo, hipoparatiroidismo e insuficiencia adrenocortical) y candidiasis mucocutánea crónica.
Finalmente, la deficiencia de IgA también se asocia a veces con el desarrollo de fenómenos autoinmunitarios y atópicos.
Factores genéticos
[editar]Ciertos individuos son genéticamente susceptibles a desarrollar enfermedades autoinmunes. Esta susceptibilidad está asociada con múltiples genes más otros factores de riesgo. Los individuos con predisposición genética no siempre desarrollan enfermedades autoinmunes.
Se sospechan tres conjuntos principales de genes en muchas enfermedades autoinmunes. Estos genes están relacionados con:
Los dos primeros, que participan en el reconocimiento de antígenos, son inherentemente variables y susceptibles de recombinación. Estas variaciones permiten que el sistema inmunológico responda a una variedad muy amplia de invasores, pero también pueden dar lugar a linfocitos capaces de auto-reactividad.
- El HLA DR2 se correlaciona de forma muy positiva con el lupus eritematoso sistémico, la narcolepsia[10] y la esclerosis múltiple, y se correlaciona negativamente con la DM tipo 1.
- HLA DR3 está fuertemente correlacionado con el síndrome de Sjögren, miastenia gravis, LES y DM tipo 1.
- HLA DR4 se correlaciona con la génesis de la artritis reumatoide, la diabetes mellitus tipo 1 y el pénfigo vulgar.
Existen menos correlaciones con las moléculas de MHC de clase I. La más notable y consistente es la asociación entre HLA B27 y espondiloartropatías como la espondilitis anquilosante y la artritis reactiva. Pueden existir correlaciones entre los polimorfismos dentro de los promotores del MHC de clase II y la enfermedad autoinmune. Las contribuciones de genes fuera del complejo MHC siguen siendo objeto de investigación.
La PTPN22 se ha asociado con múltiples enfermedades autoinmunes que incluyen diabetes tipo I, artritis reumatoide, lupus eritematoso sistémico, tiroiditis de Hashimoto, enfermedad de Graves, enfermedad de Addison, miastenia grave, vitiligo, esclerosis sistémica, artritis idiopática juvenil y artritis psoriásica.[11]
Sexo
[editar]| Relación de incidencia mujer/hombre
de enfermedades autoinmunes | |
|---|---|
| Tiroiditis de Hashimoto | 10:1[12] |
| Enfermedad de Graves-Basedow | 7:1 |
| Esclerosis múltiple (EM) | 2:1 |
| Miastenia gravis | 2:1 |
| Lupus eritematoso sistémico (LES) | 9:1 |
| Artritis reumatoide | 5:2 |
| Colangitis esclerosante primaria | 1:2 |
Existe alguna evidencia de que el sexo de una persona también puede tener algún papel en el desarrollo de la autoinmunidad; es decir, la mayoría de las enfermedades autoinmunes están relacionadas con el sexo. Algunas enfermedades autoinmunes que los hombres tienen tanto o más probabilidades de desarrollar que las mujeres incluyen: espondilitis anquilosante, diabetes mellitus tipo 1, granulomatosis con poliangitis, enfermedad de Crohn, colangitis esclerosante primaria y psoriasis.
Las razones del papel del sexo en la autoinmunidad varían. Las mujeres parecen generar respuestas inflamatorias más grandes que los hombres cuando se activa su sistema inmunológico, lo que aumenta el riesgo de autoinmunidad. La participación de los esteroides sexuales está indicada por el hecho de que muchas enfermedades autoinmunes tienden a fluctuar de acuerdo con los cambios hormonales, por ejemplo: durante el embarazo, en el ciclo menstrual o cuando se usan anticonceptivos orales. Un historial de embarazo también parece dejar un aumento persistente del riesgo de enfermedad autoinmune. Se ha sugerido que el ligero intercambio directo de células entre las madres y sus hijos durante el embarazo puede inducir autoinmunidad.[13] Esto inclinaría el equilibrio de género en la dirección de la mujer.
Otra teoría sugiere que la alta tendencia femenina a tener autoinmunidad se debe a una inactivación desequilibrada del cromosoma X.[14] La teoría del sesgo de inactivación de X, propuesta por Jeff Stewart de la Universidad de Princeton, se confirmó de forma experimental en la esclerodermia y la tiroiditis autoinmune.[15] También se han propuesto otros mecanismos complejos de susceptibilidad genética ligados al cromosoma X.
Factores ambientales
[editar]Enfermedades infecciosas y parásitos
[editar]Existe una interesante relación inversa entre enfermedades infecciosas y enfermedades autoinmunes. En áreas donde múltiples enfermedades infecciosas son endémicas, las enfermedades autoinmunes son muy raras. Lo contrario, hasta cierto punto, parece ser cierto. La hipótesis de la higiene atribuye estas correlaciones a las estrategias de manipulación inmunológica de los patógenos. Si bien tal observación ha sido calificada de diversas formas como falsa e ineficaz, según algunos estudios, la infección por parásitos está asociada con una actividad reducida de la enfermedad autoinmune.[16][17][18]
El supuesto mecanismo es que el parásito atenúa la respuesta inmune del huésped para protegerse a sí mismo. Esto puede proporcionar un beneficio fortuito a un huésped que también padece una enfermedad autoinmune. Los detalles de la modulación inmunitaria del parásito aún no se conocen, pero pueden incluir la secreción de agentes antiinflamatorios o la interferencia con la señalización inmunitaria del huésped.
Una observación paradójica ha sido la fuerte asociación de ciertos organismos microbianos con enfermedades autoinmunes. Por ejemplo, Klebsiella pneumoniae y coxsackievirus B se han correlacionado fuertemente con la espondilitis anquilosante y la diabetes mellitus tipo 1, respectivamente. Esto se ha explicado por la tendencia del organismo infectante a producir superantígenos que son capaces de activar policlonalmente los linfocitos B y producir grandes cantidades de anticuerpos de diferentes especificidades, algunos de los cuales pueden ser autorreactivos.
Agentes químicos y drogas
[editar]Ciertos agentes químicos y fármacos también pueden estar asociados con la génesis de afecciones autoinmunes o afecciones que simulan enfermedades autoinmunes. El más sorprendente de ellos es el lupus eritematoso inducido por fármacos. Por lo general, la suspensión del fármaco causante cura los síntomas en un paciente.
El tabaquismo está ahora establecido como un factor de riesgo importante tanto para la incidencia como para la gravedad de la artritis reumatoide. Esto puede estar relacionado con la citrulinación anormal de proteínas, ya que los efectos del tabaquismo se correlacionan con la presencia de anticuerpos contra péptidos citrulinados.
Patogenia de la autoinmunidad
[editar]Se cree que varios mecanismos intervienen en la patogenia de las enfermedades autoinmunes, en un contexto de predisposición genética y modulación ambiental. Va más allá del alcance de este artículo discutir cada uno de estos mecanismos de manera exhaustiva, pero se ha descrito un resumen de algunos de los mecanismos importantes:
- Bypass de células T: un sistema inmunológico normal requiere la activación de las células B por las células T antes de que las primeras puedan diferenciarse en células B plasmáticas y posteriormente producir anticuerpos en grandes cantidades. Este requisito de una célula T se puede evitar en casos raros, como la infección por organismos que producen superantígenos, que son capaces de iniciar la activación policlonal de las células B, o incluso de las células T, al unirse directamente a la subunidad β. de los receptores de células T de una manera no específica.
- Discordancia entre células T y células B: se supone que una respuesta inmune normal implica respuestas de células B y T al mismo antígeno, incluso si sabemos que las células B y las células T reconocen cosas muy diferentes: conformaciones en la superficie de una molécula para Células B y fragmentos peptídicos preprocesados de proteínas para células T. Sin embargo, hasta donde sabemos, no hay nada que lo requiera. Todo lo que se requiere es que una célula B que reconoce el antígeno X endocitose y procese una proteína Y (normalmente = X) y la presente a una célula T. Se demostró que las células B que reconocen IgGFc podrían obtener ayuda de cualquier célula T que responda a un antígeno co-endocitosado con IgG por la célula B como parte de un complejo inmunológico. En la enfermedad celíaca, parece probable que las células B que reconocen la transglutamina tisular sean ayudadas por las células T que reconocen la gliadina.
- Retroalimentación mediada por receptores de células B aberrantes: una característica de la enfermedad autoinmune humana es que está restringida en gran medida a un pequeño grupo de antígenos, varios de los cuales tienen funciones de señalización conocidas en la respuesta inmune (ADN, C1q, IgGFc, Ro, receptor Con. A, receptor de aglutinina de Peanut (PNAR)). Este hecho dio lugar a la idea de que puede producirse una autoinmunidad espontánea cuando la unión del anticuerpo a ciertos antígenos conduce a señales aberrantes que se realimentan a las células B parentales a través de ligandos unidos a la membrana. Estos ligandos incluyen el receptor de células B (para el antígeno), los receptores de IgG Fc, CD21, que se une al complemento C3d, los receptores tipo Toll 9 y 7 (que pueden unirse al ADN y nucleoproteínas) y PNAR. También puede contemplarse una activación aberrante más indirecta de las células B con autoanticuerpos contra el receptor de acetilcolina (en las células mioides del timo) y hormonas y proteínas de unión a hormonas. Junto con el concepto de discordancia entre células T y células B, esta idea forma la base de la hipótesis de las células B autorreactivas que se perpetúan a sí mismas.[19] Se considera que las células B autorreactivas en autoinmunidad espontánea sobreviven debido a la subversión tanto de la vía de ayuda de las células T como de la señal de retroalimentación a través del receptor de células B, superando así las señales negativas responsables de la auto-tolerancia de las células B sin necesariamente requerir la pérdida de tolerancia de la propia célula-T.
- Mimetismo molecular: un antígeno exógeno puede compartir similitudes estructurales con ciertos antígenos del huésped; por tanto, cualquier anticuerpo producido contra este antígeno (que imita los autoantígenos) también puede, en teoría, unirse a los antígenos del hospedador y amplificar la respuesta inmunitaria. La idea del mimetismo molecular surgió en el contexto de la fiebre reumática, que sigue a la infección por estreptococos beta-hemolíticos del grupo A. Aunque la fiebre reumática se ha atribuido al mimetismo molecular durante medio siglo, no se ha identificado formalmente ningún antígeno (si es que se han propuesto demasiados). Además, la compleja distribución tisular de la enfermedad (corazón, articulaciones, piel, ganglios basales) se opone a un antígeno cardíaco específico. Sigue siendo totalmente posible que la enfermedad se deba, por ejemplo, a una interacción inusual entre los complejos inmunes, los componentes del complemento y el endotelio.
- Reacción cruzada de idiotopos: los idiotopos son epítopos antigénicos que se encuentran en la porción de unión al antígeno (Fab) de la molécula de inmunoglobulina. Se presentaron pruebas de que la autoinmunidad puede surgir como resultado de una reacción cruzada entre el idiotipo de un anticuerpo antiviral y un receptor de la célula huésped para el virus en cuestión. En este caso, el receptor de la célula huésped se concibe como una imagen interna del virus, y los anticuerpos anti-idiotipo pueden reaccionar con las células huésped.
- Desregulación de citocinas: las citocinas se han dividido recientemente en dos grupos según la población de células cuyas funciones promueven: Células T auxiliares tipo 1 o tipo 2. La segunda categoría de citocinas, que incluye IL-4, IL-10 y TGF-β, parece tener un papel en la prevención de la exageración de las respuestas inmunitarias proinflamatorias.
- Apoptosis de células dendríticas: las células del sistema inmunológico llamadas células dendríticas presentan antígenos a los linfocitos activos. Las células dendríticas que presentan defectos en la apoptosis pueden provocar una activación de linfocitos sistémica inadecuada y la consiguiente disminución de la auto-tolerancia.[20]
- Difusión de epítopos o deriva de epítopos: cuando la respuesta inmune cambia de dirigirse al epítopo primario a dirigirse también a otros epítopos. En contraste con el mimetismo molecular, los otros epítopos no necesitan ser estructuralmente similares al primario.
- Modificación del epítopo o exposición del epítopo críptico: este mecanismo de enfermedad autoinmune es único en el sentido de que no es el resultado de un defecto en el sistema hematopoyético. En cambio, la enfermedad es el resultado de la exposición de enlaces crípticos N-glucanos (polisacárido) comunes a eucariotas inferiores y procariotas en las glucoproteínas de células y órganos no hematopoyéticos de mamíferos.[21] Esta exposición de glucanos filogenéticamente primitivos activa una o más células inmunes innatas de mamíferos receptores para inducir un estado inflamatorio estéril crónico. En presencia de daño celular crónico e inflamatorio, se activa el sistema inmunológico adaptativo y se pierde la auto-tolerancia con una mayor producción de autoanticuerpos. En esta forma de la enfermedad, la ausencia de linfocitos puede acelerar el daño de los órganos y la administración de IgG intravenosa puede ser terapéutica. Aunque esta ruta a la enfermedad autoinmune puede ser la base de varios estados de enfermedad degenerativa, en la actualidad no existen diagnósticos para este mecanismo de enfermedad y, por lo tanto, se desconoce su papel en la autoinmunidad humana.
Se están investigando las funciones de los tipos de células inmunorreguladoras especializadas, como las células T reguladoras, las células NKT y las células T γδ en la patogenia de las enfermedades autoinmunes.
Clasificación
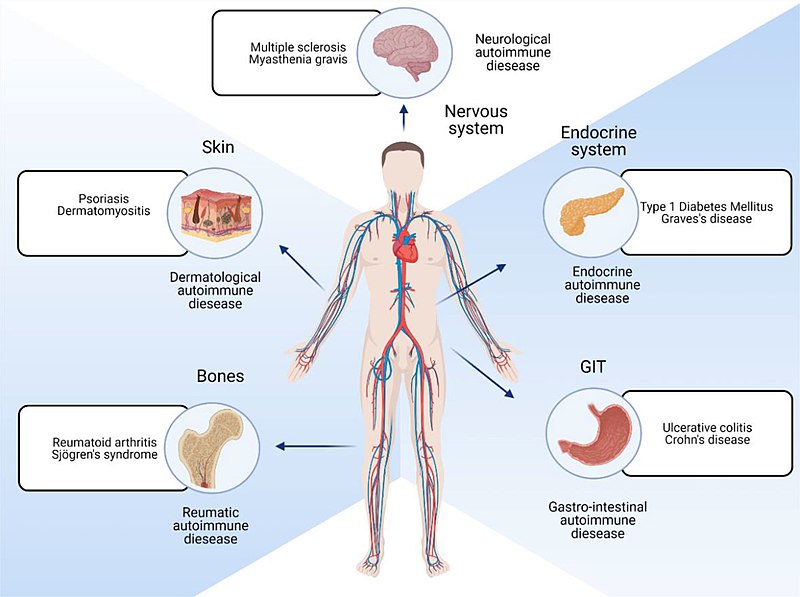
[editar]Las enfermedades autoinmunes se pueden dividir ampliamente en trastornos autoinmunitarios sistémicos y específicos de órganos o localizados, según las principales características clínico-patológicas de cada enfermedad.
- Enfermedades autoinmunes sistémicas incluyen: celiaquía, lupus eritematoso, síndrome de Sjögren, sarcoidosis, esclerodermia, artritis reumatoide, vasculitis crioglobulinémica y dermatomiositis. Estas condiciones tienden a asociarse con autoanticuerpos contra antígenos que no son específicos de tejido. Por tanto, aunque la polimiositis tiene una presentación más o menos específica de tejido, puede incluirse en este grupo porque los autoantígenos son a menudo ARN-t sintetasas ubicuas.
- Síndromes locales que afectan a un órgano o tejido específico:
- Endocrinológico: diabetes mellitus tipo 1, tiroiditis de Hashimoto, enfermedad de Addison
- Gastrointestinal: enfermedad de Crohn, anemia perniciosa
- Dermatológico: pénfigo vulgar, vitiligo
- Hematológico: anemia hemolítica autoinmune, púrpura trombocitopénica idiopática
- Neurológicos: esclerosis múltiple, miastenia gravis, encefalitis autoinmune, ataxia por gluten
Utilizando el esquema de clasificación tradicional de “órgano específico” y “órgano no-específico”, muchas enfermedades se han agrupado bajo el paraguas de enfermedades autoinmunes. Sin embargo, muchos trastornos humanos inflamatorios crónicos carecen de las asociaciones reveladoras de la inmunopatología impulsada por las células B y T. Se ha establecido firmemente que la "inflamación contra uno mismo" del tejido no depende necesariamente de respuestas anormales de las células T y B.[22]
Esto ha llevado a la reciente propuesta de que el espectro de la autoinmunidad debe considerarse a lo largo de un “continuo de enfermedades inmunológicas”, con las enfermedades autoinmunes clásicas en un extremo y las enfermedades impulsadas por el sistema inmunológico innato en el otro extremo. Dentro de este esquema, se puede incluir el espectro completo de autoinmunidad. Se puede ver que muchas enfermedades autoinmunes humanas comunes tienen una inmunopatología mediada por inmunidad innata sustancial usando este nuevo esquema. Esteesquema de clasificación tiene implicaciones para comprender los mecanismos de la enfermedad y para el desarrollo de la terapia.[22]
Diagnóstico
[editar]El diagnóstico de trastornos autoinmunitarios se basa en gran medida en la historia y el examen físico precisos del paciente y en un alto índice de sospecha. en un contexto de ciertas anomalías en las pruebas de laboratorio de rutina (por ejemplo, proteína C reactiva elevada).
En varios trastornos sistémicos, pueden emplearse ensayos serológicos que pueden detectar autoanticuerpos específicos. Los trastornos localizados se diagnostican mejor mediante inmunofluorescencia de muestras de biopsia.
Los autoanticuerpos se utilizan para diagnosticar muchas enfermedades autoinmunes. Los niveles de autoanticuerpos se miden para determinar el progreso de la enfermedad.
Tratamientos
[editar]Los tratamientos para las enfermedades autoinmunes han sido tradicionalmente inmunosupresores, antiinflamatorios o paliativos.[7] El manejo de la inflamación es fundamental en las enfermedades autoinmunes.[23] Las terapias no inmunológicas, como el reemplazo hormonal en la tiroiditis de Hashimoto o la diabetes mellitus tipo 1, tratan los resultados de la respuesta autoagresiva, por lo que estos son tratamientos paliativos. La manipulación dietética limita la gravedad de la enfermedad celíaca. El tratamiento con esteroides o AINE limita los síntomas inflamatorios de muchas enfermedades. La IVIG se utiliza para CIDP y GBS. Se ha demostrado que las terapias inmunomoduladoras específicas, como los antagonistas del TNFα (por ejemplo, etanercept), el agente reductor de células B rituximab, el receptor anti-IL-6 tocilizumab y el bloqueador de coestimulación abatacept, son útiles en el tratamiento de la AR. Algunas de estas inmunoterapias pueden estar asociadas con un mayor riesgo de efectos adversos, como la susceptibilidad a las infecciones.
La terapia con helmintos es un enfoque experimental que implica la inoculación del paciente con nematodos intestinales parásitos específicos (helmintos). Actualmente existen dos tratamientos estrechamente relacionados disponibles, la inoculación con Necator americanus (anquilostomas), o Trichuris Suis Ova.[24][25][26][27][28]
La vacunación con células T también se está explorando como una posible terapia futura para los trastornos autoinmunes.
Nutrición y autoinmunidad
[editar]Vitamina D/Luz solar
[editar]- Debido a que la mayoría de las células y tejidos humanos tienen receptores para la vitamina D, incluidas las células T y B, los niveles adecuados de vitamina D pueden ayudar en la regulación del sistema inmunológico.[29] La vitamina D juega un papel en la función inmunológica al actuar sobre células T y células asesinas naturales.[30] La investigación ha demostrado una asociación entre la vitamina D sérica baja y las enfermedades autoinmunes, que incluyen: esclerosis múltiple,diabetes mellitus tipo 1 y lupus eritematoso sistémico.[31][32] Sin embargo, desde fotosensibilidad ocurre en el lupus, se aconseja a los pacientes que eviten la luz solar, que puede ser responsable de la deficiencia de vitamina D observada en esta enfermedad. Polimorfismos en el receptor de vitamina D. Los genes se encuentran comúnmente en personas con enfermedades autoinmunes, lo que proporciona un mecanismo potencial para el papel de la vitamina D en la autoinmunidad. Existe evidencia mixta sobre el efecto de la suplementación con vitamina D en la diabetes tipo 1, el lupus y la esclerosis múltiple
Ácidos grasos omega-3
[editar]- Los estudios han demostrado que el consumo adecuado de ácidos grasos omega-3 contrarresta los efectos de los ácidos araquidónicos, que contribuyen a los síntomas de las enfermedades autoinmunes. Los ensayos en humanos y animales sugieren que el omega-3 es una modalidad de tratamiento eficaz para muchos casos de artritis reumatoide, enfermedad inflamatoria intestinal, asma y psoriasis.[33]
- Si bien la depresión mayor no es necesariamente una enfermedad autoinmune, algunos de sus síntomas fisiológicos son de naturaleza inflamatoria y autoinmune. El omega-3 puede inhibir la producción de interferón gamma y otras citocinas que causan los síntomas fisiológicos de la depresión. Esto puede deberse al hecho de que un desequilibrio en los ácidos grasos omega-3 y omega-6, que tienen efectos opuestos, es fundamental en la etiología de la depresión mayor.
Probiótico/Microflora
[editar]- Se ha demostrado que varios tipos de bacterias y microflora presentes en los productos lácteos fermentados, especialmente Lactobacillus casei, estimulan la respuesta inmune a los tumores en ratones y regulan la función inmune, retrasando o previniendo la aparición de diabetes no obeso. Esto es particularmente cierto para la cepa Shirota de L. casei (LcS). La cepa LcS se encuentra principalmente en yogur y productos similares en Europa y Japón, y rara vez en otros lugares.[34]
- Se ha teorizado que los radicales libres contribuyen a la aparición de diabetes tipo 1 en bebés y niños pequeños y, por lo tanto, el riesgo podría reducirse con una alta ingesta de sustancias antioxidantes durante el embarazo. Sin embargo, un estudio realizado en un hospital de Finlandia entre 1997 y 2002 concluyó que no había una correlación estadísticamente significativa entre la ingesta de antioxidantes y el riesgo de diabetes.[35] Este estudio involucró el monitoreo de la ingesta de alimentos a través de cuestionarios y la ingesta estimada de antioxidantes sobre esta base, en lugar de mediante mediciones exactas o el uso de suplementos.
Véase también
[editar]Referencias
[editar]- ↑ Bandgar, Tushar; Lila, Anurag; Shah, Nalini; Patt, Hiren (2013). «Management issues with exogenous steroid therapy». Indian Journal of Endocrinology and Metabolism 17 (9): 612. ISSN 2230-8210. PMC 4046616. PMID 24910822. doi:10.4103/2230-8210.123548.
- ↑ Arthur M. Silverstein: Autoimmunity: A History of the Early Struggle for Recognition, in: Ian R. Mackay, Noel R Rose: The Autoimmune Diseases (chapter 2), Academic Press, 2013
- ↑ Poletaev, A. B.; Churilov, L. P.; Stroev, Yu. I.; Agapov, M. M. (1 de junio de 2012). «Immunophysiology versus immunopathology: Natural autoimmunity in human health and disease». Pathophysiology (en inglés) 19 (3): 221-231. ISSN 0928-4680. doi:10.1016/j.pathophys.2012.07.003.
- ↑ Stefanova I.; Dorfman J. R.; Germain R. N. (2002). «Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes». Nature 420 (6914): 429-434. PMID 12459785. doi:10.1038/nature01146.
- ↑ Pike, B. L.; Boyd, A. W.; Nossal, G. J. (1 de marzo de 1982). «Clonal anergy: the universally anergic B lymphocyte». Proceedings of the National Academy of Sciences (en inglés) 79 (6): 2013-2017. ISSN 0027-8424. PMC 346112. PMID 6804951. doi:10.1073/pnas.79.6.2013.
- ↑ Jerne, N. K. (1974-01). «Towards a network theory of the immune system». Annales D'immunologie. 125C (1-2): 373-389. ISSN 0300-4910. PMID 4142565.
- ↑ a b «Pathology, Microbiology and Immunology - School of Medicine | University of South Carolina». sc.edu. Consultado el 3 de octubre de 2020.
- ↑ Edwards; Cambridge; Abrahams (1999). «Do self-perpetuating B lymphocytes drive human autoimmune disease?». Immunology (en inglés) 97 (2): 188-196. ISSN 1365-2567. PMC 2326840. PMID 10447731. doi:10.1046/j.1365-2567.1999.00772.x.
- ↑ «Immunodeficiency and autoimmunity: lessons from systemic lupus erythematosus». Trends in Molecular Medicine 18 (2): 101-108. 2012. PMC 3278563. PMID 22177735. doi:10.1016/j.molmed.2011.10.005.
- ↑ Klein, Jan (20 de agosto de 2009). «The HLA System». http://dx.doi.org/10.1056/NEJM200009143431106 (en inglés). doi:10.1056/nejm200009143431106.
- ↑ Gregersen, Peter K.; Olsson, Lina M. (1 de enero de 2009). «Recent Advances in the Genetics of Autoimmune Disease». Annual Review of Immunology 27: 363-391. PMC 2992886. PMID 19302045. doi:10.1146/annurev.immunol.021908.132653.
- ↑ Everyday Health > Women and Autoimmune Disorders By Krisha McCoy. Medically reviewed by Lindsey Marcellin, MD, MPH. Last Updated: 12/02/2009
- ↑ Ainsworth, Claire (Nov. 15, 2003). The Stranger Within. New Scientist
- ↑ Theory: High autoimmunity in females due to imbalanced X chromosome inactivation:
- ↑ Uz, Elif; Loubiere, Laurence S.; Gadi, Vijayakrishna K.; Ozbalkan, Zeynep; Stewart, Jeffrey; Nelson, J. Lee; Ozcelik, Tayfun (1 de junio de 2008). «Skewed X-Chromosome Inactivation in Scleroderma». Clinical Reviews in Allergy & Immunology (en inglés) 34 (3): 352-355. ISSN 1559-0267. PMC 2716291. PMID 18157513. doi:10.1007/s12016-007-8044-z.
- ↑ Saunders, Karin A.; Raine, Tim; Cooke, Anne; Lawrence, Catherine E. (1 de enero de 2007). «Inhibition of Autoimmune Type 1 Diabetes by Gastrointestinal Helminth Infection». Infection and Immunity (en inglés) 75 (1): 397-407. ISSN 0019-9567. PMC 1828378. PMID 17043101. doi:10.1128/IAI.00664-06. Archivado desde el original el 29 de abril de 2021. Consultado el 3 de octubre de 2020.
- ↑ «Parasite Infection May Benefit Multiple Sclerosis Patients». sciencedaily.com.
- ↑ Wållberg, Maja; Harris, Robert A. (1 de junio de 2005). «Co-infection with Trypanosoma brucei brucei prevents experimental autoimmune encephalomyelitis in DBA/1 mice through induction of suppressor APCs». International Immunology (en inglés) 17 (6): 721-728. ISSN 0953-8178. doi:10.1093/intimm/dxh253.
- ↑ Edwards, Jonathan C. W.; Cambridge, Geraldine (2006-05). «B-cell targeting in rheumatoid arthritis and other autoimmune diseases». Nature Reviews Immunology (en inglés) 6 (5): 394-403. ISSN 1474-1741. doi:10.1038/nri1838.
- ↑ «Dendritic cells: sentinels of immunity and tolerance». International Journal of Hematology 81 (3): 197-203. 2005. PMID 15814330. doi:10.1532/IJH97.04165.
- ↑ Green R.S.; Stone E.L.; Tenno M.; Lehtonen E.; Farquhar M.G.; Marth J.D. (2007). «Mammalian N-glycan branching protects against innate immune self-recognition and inflammation in autoimmune disease pathogenesis». Immunity 27 (2): 308-320. PMID 17681821. doi:10.1016/j.immuni.2007.06.008.
- ↑ a b McGonagle, D; McDermott, MF (Aug 2006). «A proposed classification of the immunological diseases.». PLOS Medicine 3 (8): e297. PMC 1564298. PMID 16942393. doi:10.1371/journal.pmed.0030297.
- ↑ Nikoopour, Enayat (31 de agosto de 2008). «Therapeutic Benefits of Regulating Inflammation in Autoimmunity». Inflammation & Allergy - Drug Targets (Discontinued) (en inglés). doi:10.2174/187152808785748155.
- ↑ Zaccone, P.; Fehervari, Z.; Phillips, J. M.; Dunne, D. W.; Cooke, A. (2006). «Parasitic worms and inflammatory diseases». Parasite Immunology (en inglés) 28 (10): 515-523. ISSN 1365-3024. PMC 1618732. PMID 16965287. doi:10.1111/j.1365-3024.2006.00879.x.
- ↑ Dunne, David W.; Cooke, Anne (2005-05). «A worm's eye view of the immune system: consequences for evolution of human autoimmune disease». Nature Reviews Immunology (en inglés) 5 (5): 420-426. ISSN 1474-1741. doi:10.1038/nri1601.
- ↑ Dittrich, Anna M.; Erbacher, Annika; Specht, Sabine; Diesner, Felix; Krokowski, Martin; Avagyan, Angela; Stock, Philippe; Ahrens, Birgit et al. (1 de febrero de 2008). «Helminth Infection with Litomosoides sigmodontis Induces Regulatory T Cells and Inhibits Allergic Sensitization, Airway Inflammation, and Hyperreactivity in a Murine Asthma Model». The Journal of Immunology (en inglés) 180 (3): 1792-1799. ISSN 0022-1767. PMID 18209076. doi:10.4049/jimmunol.180.3.1792.
- ↑ Wohlleben, Gisela; Trujillo, Claudia; Müller, Justus; Ritze, Yvonne; Grunewald, Susanne; Tatsch, Ursula; Erb, Klaus J. (1 de abril de 2004). «Helminth infection modulates the development of allergen‐induced airway inflammation». International Immunology (en inglés) 16 (4): 585-596. ISSN 0953-8178. doi:10.1093/intimm/dxh062.
- ↑ Quinnell, R. J.; Bethony, J.; Pritchard, D. I. (2004). «The immunoepidemiology of human hookworm infection». Parasite Immunology (en inglés) 26 (11-12): 443-454. ISSN 1365-3024. doi:10.1111/j.0141-9838.2004.00727.x.
- ↑ Holick, Michael F. (1 de diciembre de 2004). «Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease». The American Journal of Clinical Nutrition (en inglés) 80 (6): 1678S-1688S. ISSN 0002-9165. doi:10.1093/ajcn/80.6.1678S.
- ↑ Yang, Chen-Yen; Leung, Patrick S. C.; Adamopoulos, Iannis E.; Gershwin, M. Eric (1 de octubre de 2013). «The Implication of Vitamin D and Autoimmunity: a Comprehensive Review». Clinical Reviews in Allergy & Immunology (en inglés) 45 (2): 217-226. PMC 6047889. PMID 23359064. doi:10.1007/s12016-013-8361-3.
- ↑ Dankers, Wendy; Colin, Edgar M.; Hamburg, Van; Piet, Jan; Lubberts, Erik (2017). «Vitamin D in Autoimmunity: Molecular Mechanisms and Therapeutic Potential». Frontiers in Immunology (en inglés) 7: 697. PMC 5247472. PMID 28163705. doi:10.3389/fimmu.2016.00697.
- ↑ Agmon-Levin, Nancy; Theodor, Emanuel; Segal, Ramit Maoz; Shoenfeld, Yehuda (1 de octubre de 2013). «Vitamin D in Systemic and Organ-Specific Autoimmune Diseases». Clinical Reviews in Allergy & Immunology (en inglés) 45 (2): 256-266. ISSN 1559-0267. doi:10.1007/s12016-012-8342-y.
- ↑ Simopoulos, Artemis P. (1 de diciembre de 2002). «Omega-3 Fatty Acids in Inflammation and Autoimmune Diseases». Journal of the American College of Nutrition 21 (6): 495-505. ISSN 0731-5724. PMID 12480795. doi:10.1080/07315724.2002.10719248.
- ↑ Matsuzaki, Takeshi; Takagi, Akimitsu; Ikemura, Haruo; Matsuguchi, Tetsuya; Yokokura, Teruo (1 de marzo de 2007). «Intestinal Microflora: Probiotics and Autoimmunity». The Journal of Nutrition (en inglés) 137 (3): 798S-802S. ISSN 0022-3166. doi:10.1093/jn/137.3.798S.
- ↑ Uusitalo, Liisa; Kenward, Mike G.; Virtanen, Suvi M.; Uusitalo, Ulla; Nevalainen, Jaakko; Niinistö, Sari; Kronberg-Kippilä, Carina; Ovaskainen, Marja-Leena et al. (1 de agosto de 2008). «Intake of antioxidant vitamins and trace elements during pregnancy and risk of advanced β cell autoimmunity in the child». The American Journal of Clinical Nutrition (en inglés) 88 (2): 458-464. ISSN 0002-9165. doi:10.1093/ajcn/88.2.458.
Enlaces externos
[editar]- Asociación Estadounidense de Enfermedades Autoinmunes Relacionadas: una defensa sin fines de lucro
- Immune Tolerance Network: un recurso orientado a la investigación
- Premio Nobel - El Premio Nobel de Fisiología o Medicina de 1960 fue otorgado a Frank M. Burnet y Peter B Medawar "por el descubrimiento de la tolerancia inmunológica adquirida".
- El portal de análisis y base de datos de inmunología : un recurso de base de datos financiado por el NIAID de datos de referencia y experimentos que cubre todo el dominio de la inmunología
- Comprensión de las enfermedades autoinmunes - Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel de EE. UU.
