Chalcona
| Chalcona[1] | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,3-Difenil-2-propen-1-ona | ||
| General | ||
| Otros nombres |
Chalcone Chalkone Benzylideneacetophenone Phenyl styryl ketone | |
| Fórmula estructural |
 | |
| Fórmula molecular |
C 15H 12O 1 | |
| Identificadores | ||
| Número CAS | 614-47-1[2] | |
| ChEBI | 27618 | |
| ChemSpider | 6921 | |
| PubChem | 637760 | |
| UNII | 5S5A2Q39HX | |
| KEGG | C01484 | |
|
O=C(C=Cc1ccccc1)c2ccccc2
| ||
| Propiedades físicas | ||
| Masa molar | 208,26 g/mol | |
| Punto de fusión | 328 K (55 °C) | |
| Punto de ebullición | 618 K (345 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Chalcona o Calcona es una cetona aromática y un enona que forma el núcleo central para una variedad de compuestos biológicos importantes, que se conocen colectivamente como chalconas o chalconoides. Benzylideneacetofenona es el miembro principal de la serie calcona. El nombre alternativo dado a calcona son fenil cetona estirilo, benzalacetofenona, β -phenylacrylophenone, ɣ -oxo- α , ɣ -diphenyl- α propileno y α -fenil- β -benzoylethyleno.
Propiedades químicas
[editar]Chalconas tienen dos máximos de absorción a 280 nm y 340 nm.[3]
Las reacciones químicas
[editar]- Síntesis
Las chalconas se pueden preparar por una condensación aldólica entre el benzaldehído y acetofenona en presencia de hidróxido de sodio como catalizador.
Esta reacción se ha encontrado para trabajar sin ningún tipo de disolvente en absoluto - un estado sólido.[4] La reacción entre benzaldehıdos y las acetofenonas sustituidas se ha utilizado para demostrar la química verde en la educación química de pregrado.[5] En un estudio de investigación de la química verde de síntesis, las chalconas también se sintetizaron a partir de los mismos materiales de partida en agua a alta temperatura (200 a 350 °C).[6]
Alternativamente, las chalconas sustituidas fueron sintetizados por la condensación mediada por piperidina para evitar reacciones secundarias tales como múltiples condensaciones, polimerizaciones, y reordenamientos.[7]
Otra reacción
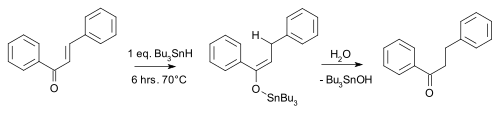
[editar]Un ejemplo es la reducción de carbonilo de chalcona por hidruro de tributilestaño:[8]
Un versión enantioselectiva de esta reacción también se ha desarrollado.[9]
Referencias
[editar]- ↑ Merck Index, 11th Edition, 2028.
- ↑ Número CAS
- ↑ Photochemistry of chalcone and the application of chalcone-derivatives in photo-alignment layer of liquid crystal display. Dong-mee Song, Kyoung-hoon Jung, Ji-hye Moon and Dong-myung Shin, Optical Materials, 2002, volume 21, pages 667–671, doi 10.1016/S0925-3467(02)00220-3
- ↑ Toda, F., et al., J. Chem. Soc. Perkin Trans. I, 1990, 3207.
- ↑ Palleros, D. R., J. Chem. Educ., 81, 1345 (2004).
- ↑ Comisar, C. M. and Savage, P. E. Green Chem., 6 (2004), 227 - 231. doi 10.1039/b314622g
- ↑ P Venkatesan and S Sumathi, "Piperidine Mediated Synthesis of N-Heterocyclic Chalcones and Their Antibacterial Activity", J. Heterocyclic Chem., 47, 81 (2010).
- ↑ Leusink, A.J.; Noltes, J.G. (1966). «Reaction of organotin hydrides with α,β-unsaturated ketones». Tetrahedron Letters 7 (20): 2221. doi:10.1016/S0040-4039(00)72405-1.
- ↑ Moritani, Yasunori; Appella, Daniel H.; Jurkauskas, Valdas; Buchwald, Stephen L. (2000). «Synthesis of β-Alkyl Cyclopentanones in High Enantiomeric Excess via Copper-Catalyzed Asymmetric Conjugate Reduction». Journal of the American Chemical Society 122 (28): 6797. doi:10.1021/ja0009525.
Enlaces externos
[editar]- Chalcone on reference.md Archivado el 25 de septiembre de 2020 en Wayback Machine.
- Esta obra contiene una traducción derivada de «Chalcone» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.