Combustible neutro en carbono
Un combustible neutro en carbono, también llamado combustible ecológico, ecocombustible o combustible renovable, es un combustible que, debido a la manera en que se ha obtenido, resulta en emisiones nulas de gases de efecto invernadero cuando se utiliza. O dicho de otra forma, que tiene huella de carbono cero. Un tipo de combustible neutro en carbono es el combustible sintético (como metano, gasolina,[1][2][3] diésel, queroseno o amoníaco) producido con energía renovable o nuclear.
No se pueden considerar combustibles cero emisiones porque aún no emitiendo Co2, o siendo neutros en emisiones de este gas, siguen emitiendo gases contaminantes como óxidos de nitrógeno y partículas.
Tipos principales
[editar]Hay dos tipos de combustibles neutros en carbono: los que no llevan carbono (C), como el hidrógeno (H2) o el amoníaco (NH3), y los que sí lo llevan, como el metano (CH4) o el etanol (C2H6O). Los del segundo tipo solo son neutros en carbono si, al producirlos, el carbono que llevan se extrae del dióxido de carbono (CO2) directamente capturado del aire (direct air capture, DAC por sus siglas en inglés), del CO2 de los gases de combustión de una central termoeléctrica de ciclo convencional, de los gases de escape de una refinería de petróleo[4] o del ácido carbónico (H2CO3) del agua de mar.
Electrocombustibles
[editar]Los electrocombustibles o electrocarburantes son combustibles sintéticos neutros en carbono que se fabrican almacenando la energía eléctrica de fuentes renovables en los enlaces químicos de combustibles líquidos o gaseosos. Hay algunos combustibles neutros en carbono (por ejemplo los obtenidos de algas) que no son electrocombustibles.
Utilización de la energía
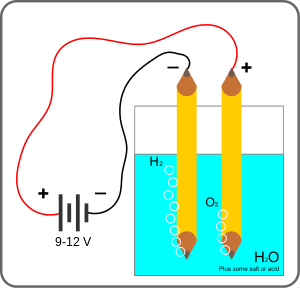
[editar]En los combustibles del primer tipo la energía se emplea para electrolizar el agua (H2O) en hidrógeno (H2) y oxígeno (O2) y, en el caso del amoníaco, para combinar ese hidrógeno con el nitrógeno (N2) del aire. En los combustibles del segundo tipo la energía se emplea, además, para extraer el carbono de las fuentes citadas, para hidrogenarlo y para el conjunto de reacciones químicas que dan como resultado el combustible, pues en balance total estas reacciones son endotérmicas, es decir, absorben energía.
Las fuentes de energía renovable pueden ser turbinas eólicas, paneles solares o centrales hidroeléctricas.[5][6][7][8]
Biocombustibles y neutralidad de carbono
[editar]Cuando surgieron los biocarburantes (también llamados biocombustibles) se los consideró un tipo de energía renovable,[9] pero posteriormente se ha visto que no es así.[10] En principio son neutros en carbono porque el dióxido de carbono que se emite al quemarlos ha sido previamente retirado de la atmósfera al crecer la planta de la que se extrae el biocombustible.[11][12] Sin embargo, para calcular estrictamente las emisiones netas de un biocombustible, también hay que tener en cuenta las que se producen al cultivar esa planta y procesarla hasta obtener el producto final.[10]
Los combustibles neutros en carbono fabricados combinando hidrógeno obtenido mediante electrólisis con dióxido de carbono que se resta al medio se denominan también "generación 4G de gasolinas"[13] (aunque técnicamente no sean todos gasolinas). La 1G eran los biocarburantes, pero desviaban terrenos para cultivos alimenticios y hacían aumentar los precios[13] o depredaban el medio ambiente (aceite de palma). La 2G utilizaba restos forestales, pero no llegó a ser rentable. La 3G utilizaba las algas como fuente de materia orgánica, pero tampoco ha conseguido despegar,[13] aunque para usos distintos el cultivo de algas sí ha logrado ser rentable.[14]
Requisitos para que los combustibles neutros en carbono sean eficaces contra el calentamiento mundial
[editar]Si los combustibles neutros en carbono sustituyeran a los combustibles fósiles, o si se produjeran a partir de dióxido de carbono residual o ácido carbónico en el agua de mar, y se utilizaran con captura de carbono en la chimenea o el tubo de escape, entonces resultarían en emisiones negativas de dióxido de carbono y en extracción neta de dióxido de carbono de la atmósfera. Constituirían así una forma de mitigación del cambio climático.[15][16][17][18] Pero en 2020 sigue sin ser viable la captura y almacenamiento de dióxido de carbono de un vehículo de combustible, y tampoco se ve la captura y almacenamiento de carbono como la solución al calentamiento mundial.[19] Sí que sería viable, en cambio, por ejemplo, fabricar con energía renovable metano sintético, quemarlo en una central de ciclo combinado y capturar y almacenar los gases producidos. En funcionamiento continuo resultaría ineficiente respecto a aprovechar directamente la energía renovable. Pero si se emplea la energía renovable cuando la hay (eólica cuando sopla viento, por ejemplo) para fabricar combustible sintético y almacenarlo, se puede luego utilizar ese combustible cuando la energía renovable no está disponible (cuando no sopla viento, siguiendo con el ejemplo).[20]
Tal esquema de energía a combustible y combustibles negativos en carbono puede realizarse por la electrólisis del agua para producir hidrógeno. A través de la reacción de Sabatier puede obtenerse metano, el cual se puede almacenar (también es posible almacenar el hidrógeno directamente, pero puede resultar más costoso) para utilizarlo posteriormente en centrales eléctricas (en la forma de gas natural sintético, de propiedades análogas al extraído de yacimientos), transportarlo por tubería, camión cisterna o buque metanero, o emplearse en procesos de conversión del gas natural en combustibles líquidos, como el proceso Fischer-Tropsch, y así conseguir combustibles de propiedades análogas a las de los convencionales para transporte o calefacción.[21][22][23]
Otro proceso para obtener combustibles sintéticos es el Pott-Broche (licuefacción directa del carbón), pero no es neutro en emisiones, sino que las aumenta.
Lo mismo que los biocombustibles habituales, los combustibles sintéticos solo son negativos en carbono (es decir, solo reducen la cantidad de gases de efecto invernadero en la atmósfera) mientras no se utilicen. Pero claro, no se van a fabricar para no utilizarlos. Cuando se queman, el carbono que contienen es emitido nuevamente a la atmósfera en forma de dióxido de carbono, anulando el beneficio medioambiental. De esta forma el tiempo entre la producción del combustible y su combustión (el tiempo que el dióxido de carbono permanece almacenado, y no en la atmósfera elevando la temperatura del planeta) puede ser bastante corto (mucho más corto que los 100 años de almacenamiento establecidos por el Protocolo de Kioto para proyectos de forestación o reforestación. Incluso más corto que el del almacenamiento de carbono subterráneo.[24]
Los combustibles neutros en carbono se utilizan en Alemania e Islandia para almacenamiento distribuido de energía renovable, minimizando los problemas de intermitencia de las energías solar o eólica, y permitiendo la transmisión (en forma de gas natural) de esas energías a través de los gasoductos existentes.[25] Estos combustibles renovables podrían aliviar los costes y la dependencia que ocasionan los combustibles fósiles importados sin requerir ni la electrificación de la flota de vehículos ni su adaptación para funcionar con hidrógeno u otros combustibles.[21] Aunque para ello es necesario construir todas las plantas (todavía caras)[26] de fabricación de estos combustibles sintéticos que proporcionen los millones de litros de combustibles fósiles que actualmente se consumen. No está claro si esto será más barato que electrificar el parque de vehículos. Una planta de 250 kW de metano sintético ha sido construida en Alemania y está siendo escalada hasta 10 MW.[27] Diversas tecnologías de captura directa del dióxido de carbono y conversión en combustibles están avanzando rápidamente y reduciendo sus costes.[28]
Los bonos de carbono también podrían desempeñar una función importante para los combustibles negativos en carbono, financiándolos si realmente llegan a ponerse en práctica.[29]
Producción
[editar]Una parte de los combustibles neutros en carbono son hidrocarburos sintéticos. Pueden producirse con reacciones químicas entre dióxido de carbono (capturado de las chimeneas de centrales térmicas o directamente del aire), e hidrógeno, el cual se produce por electrólisis del agua utilizando energía renovable. Estos combustibles, a veces denominados electrofueles o electrocombustibles, almacenan la energía que se utilizó para producir el hidrógeno.[30] También es posible recuperar esta energía combinando directamente el hidrógeno con oxígeno en una pila de combustible. Asimismo puede utilizarse carbón mineral como la fuente del carbono que se combina con el hidrógeno, pero este proceso no sería neutro en carbono.
El almacenaje de energía renovable en combustibles de cero emisiones es solo una forma de almacenamiento de energía. Existen muchas otras, con diversos costes de instalación, costes de funcionamiento, rendimiento (porcentaje de la energía almacenada que permiten recuperar), peligrosidad, capacidad (megavatios hora que pueden almacenar) o potencia (velocidad a la cual pueden absorber la energía que se les introduce, y velocidad a la que pueden liberarla, no necesariamente iguales),[31] por citar solo algunos parámetros, que además cambian con el tiempo por el avance tecnológico. Debido a ello la solución de almacenamiento energético óptima para una empresa, una región o un país puede no ser una sola tecnología, sino una combinación estudiada de varias.
Teóricamente el dióxido de carbono puede ser capturado y enterrado, haciendo a los combustibles fósiles neutros en carbono, aunque no renovables. Si se captura el dióxido de carbono de los gases de escape de combustibles sintéticos, en teoría todo el proceso resulta en emisiones negativas. En la práctica la captura consume mucha energía y la estabilidad del dióxido de carbono almacenado no está tecnológicamente resuelta.[19] También es posible fraccionar hidrocarburos de cadena larga para producir hidrógeno y dióxido de carbono, el cual entonces podría ser almacenado, mientras que el hidrógeno se utilizaría para energía o combustible. Este método sería, asimismo, neutro en carbono.[32]
El hidrógeno es el combustible sintético que se puede producir con mayor eficiencia energética y con el mínimo número de pasos. Luego puede ser utilizado en vehículos de célula de combustible,[33] si bien es 3 veces menos eficiente que la propulsión de vehículos totalmente eléctricos mediante baterías.[34]
Hay unos cuantos más combustibles que pueden producirse a partir del hidrógeno. Por ejemplo puede fabricarse ácido fórmico (CH2O2) haciendo reaccionar el hidrógeno con CO2. El ácido combinado con más CO2 puede formar isobutanol.[35]
El metanol puede producirse haciendo reaccionar una molécula de dióxido de carbono con 3 de hidrógeno para producir metanol y agua. La energía almacenada puede recuperarse quemando el metanol en un motor de combustión, lo que libera dióxido de carbono, agua y calor. Con una reacción similar puede producirse metano. Deben tomarse precauciones especiales para evitar que, en la producción o en el transporte hasta su destino final, algo de metano escape a la atmósfera, porque su potencial de calentamiento global es 21 veces superior al del CO2.
Se puede utilizar más energía para combinar metanol o metano en hidrocarburos combustibles de cadena más larga,[21][33] como el etanol[36]
Los investigadores también han sugerido utilizar metanol para producir éter dimetílico (C2H6O). Este combustible podría ser utilizado como sustituto del diésel debido a su capacidad de autoignición a temperatura y presión altas. En algunas zonas ya se está utilizando para calefacción y generación de energía. No es tóxico, pero debe almacenarse a presión.[37]
Todos los hidrocarburos sintéticos se producen generalmente a temperaturas de 200–300 °C y presiones de 20 a 50 bar. Normalmente se emplean catalizadores para mejorar la eficiencia de las diversas reacciones. Tales reacciones son endotérmicas en balance global y utilizan aproximadamente 3 moles de hidrógeno por mol de dióxido de carbono. También producen grandes cantidades de agua como subproducto.[5]
Fuentes de dióxido carbono para reciclarlo en combustibles neutros
[editar]La fuente más barata de dióxido de carbono para reciclarlo en combustibles neutros en carbono son los gases de combustión de una central termoeléctrica de ciclo convencional, donde puede obtenerse a unos 7,50 dólares norteamericanos ($) por tonelada.[7][38] Sin embargo este proceso no es neutro en carbono, porque ese CO2 es de origen fósil, y por tanto se traslada CO2 de la geosfera a la atmósfera. Capturar los gases de escape de los automóviles también se ha visto, en principio, como barato, pero requeriría extensos cambios de diseño para las nuevas unidades o grandes adaptaciones de las que ya están en servicio.[39] Otra fuente es el ácido carbónico disuelto en el agua de mar: como está en equilibrio químico con el dióxido de carbono atmosférico (esto quiere decir que, si se extrae una cantidad de CO2 del agua de mar, la misma cantidad pasa de forma natural de la atmósfera al mar; y viceversa: si se emite CO2 a la atmósfera, una parte se disuelve en el mar en forma de ácido carbónico, por lo que el mar se está acidificando a medida que aumenta el CO2 en la atmósfera), se ha estudiado la extracción de CO2 del agua marina. Los investigadores han estimado que esta extracción costaría unos 50 $ por tonelada.[8] También se está utilizando la extracción de CO2 de los gases de una refinería en proyectos de fabricación de combustibles de cero emisiones.[4] La captura de dióxido de carbono directamente del aire ambiental tenía en 2018 unos costes superiores, entre 94 y 232 $ por tonelada, y se consideraba poco práctica para síntesis de combustible o captura y almacenamiento de carbono.[40] Esta extracción directa se ha desarrollado menos que otros métodos. Las propuestas para este método implican utilizar una sustancia química cáustica para reaccionar con el dióxido de carbono en el aire y producir carbonatos. Estos entonces pueden ser descompuestos para liberar CO2 puro en forma de gas y regenerar la sustancia química cáustica. Este proceso requiere más energía que otros métodos, porque el dióxido de carbono se encuentra en la atmósfera en concentraciones mucho más bajas que en otras fuentes.[21]
Los investigadores también han sugerido utilizar biomasa como fuente de dióxido de carbono para producir combustibles. Añadir hidrógeno a la biomasa reduciría (en el sentido químico) su carbono y daría combustibles como resultado. Este método tiene la ventaja de utilizar materia prima vegetal para capturar el dióxido de carbono de forma barata. Las plantas también añaden algo de energía química al combustible de moléculas biológicas. Esto puede ser un uso más eficaz de la biomasa que los biocombustibles convencionales, porque utiliza toda la planta, mientras que los biocombustibles tradicionales solo aprovechan una parte (por ejemplo, para fabricar etanol a partir de caña de azúcar solo se emplea la savia). Su desventaja principal es, al igual que los biocombustibles tradicionales, que los cultivos destinados a esta biomasa compiten con los destinados a alimentación por las escasas tierras disponibles.[5] Esta desventaja puede superarse si la biomasa que se hidrogena es de residuos de un cultivo alimentario.
Costes de las energías renovables y nuclear
[editar]La energía eólica nocturna se considera la energía eléctrica más barata con la que sintetizar combustibles, porque el perfil de carga de la red eléctrica asciende bruscamente en los momentos más cálidos del día (que son los de más luz, cuando hay más actividad), pero el viento tiende a soplar ligeramente más por la noche que durante el día. Por tanto, el precio de la energía eólica nocturna es a menudo mucho menos caro que cualquier otro. Los precios de la energía eólica en horas valle en áreas de alta penetración de viento de los EE. UU. fueron en promedio de 1,64 centavos por kilovatio hora (kWh) en 2009, pero solo 0,71 centavos/kWh durante las 6 horas más baratas del día.[21] Típicamente, la electricidad mayorista cuesta de 2 a 5 centavos/kWh durante el día.[41] Algunas empresas de síntesis de combustible sugieren que pueden producir gasolina a menor coste que la del petróleo si el precio del barril supera los 55 $.[42]
En 2010, un equipo de químicos dirigido por Heather Willauer, de la Armada de los Estados Unidos, estimó que 100 megavatios (MW) de electricidad pueden producir 160 metros cúbicos (m³, 41 000 galones estadounidenses) de queroseno para reactores por día, y que la producción a bordo de una nave equipada con un reactor nuclear para su propulsión costaría unos 1 600 $/m³ (6 $/galón). Aunque este precio era aproximadamente el doble de lo que costaba en 2010 el queroseno procedente del petróleo, se esperaba que fuera inferior a lo que costaría en 2015 si continuaban las tendencias del mercado en 2010 (luego no fue así y el precio del petróleo bajó). Además, como el suministro de combustible a un portaaviones y sus naves auxiliares cuesta unos 2 100 $/m³ (8 $/galón), producir el queroseno a bordo es ya mucho menos caro.
Willauer afirmó que el agua de mar es la "mejor opción" para una fuente de queroseno sintético.[43][44] En abril de 2014, el equipo de Willauer aún no había conseguido fabricar combustible con el estándar requerido para los aviones militares, pero en septiembre de 2013 si lograron propulsar un avión miniatura controlado por radio e impulsado por un motor de combustión interna de dos tiempos.[45][46][47] Como el proceso requiere mucha electricidad, si se pone en marcha sería para un portaaviones nuclear estadounidense (clase Nimitz o clase Gerald R. Ford).[48] La marina estadounidense espera desplegar esta tecnología en la década 2020-2030.
Proyectos de demostración y desarrollo comercial
[editar]Se construyó una planta de síntesis de metano de 250 kW en el Centro para la Investigación sobre Energía Solar e Hidrógeno (ZSW por sus siglas en alemán) de la Fraunhofer-Gesellschaft en Baden-Wurtemberg (Alemania), y empezó operar en 2010. Se esperaba concluir su escalado a 10 MW en otoño de 2012.[49][50]
Desde 2011 la planta de reciclaje de dióxido de carbono George A. Olah, operada por Carbon Recycling International en Grindavík, Islandia, ha producido 2 millones de litros anuales de metanol como combustible para vehículos aprovechando los gases de escape de la central térmica de Svartsengi.[51] Tiene una capacidad de 5 millones de litros anuales.
Audi ha construido una planta de licuefacción de gas natural neutra en carbono en Werlte, Alemania.[52] Se pretende que la planta produzca combustible de transporte para compensar el gas natural licuado (GNL) utilizado en sus automóviles Un3 Sportback g-tron. Esta planta puede mantener 2 800 toneladas anuales de CO2 fuera de la atmósfera en su capacidad inicial.[53]
Columbia (Carolina del Sur),[54] Camarillo (California)[55] y Darlington (Inglaterra),[56] albergan desarrollos comerciales. Un proyecto de demostración en Berkeley, California, propone sintetizar tanto combustibles como grasas alimentarias a partir de gases de escape.[57]
Mitigación del efecto invernadero
[editar]Los combustibles neutros en carbono pueden contribuir a que no aumente el efecto invernadero (mayor cuanta más cantidad de dióxido de carbono haya en la atmósfera) porque pueden evitar la quema de combustibles fósiles. Por ejemplo, si se produce hidrógeno cuando la energía renovable es abundante[58] y, cuando es escasa, se quema en una turbina eléctrica, puede evitarse recurrir a una central de gas natural fósil, que aumenta la cantidad de CO2 en la atmósfera. Si se capturara el CO2 que emiten las centrales térmicas, estas no aumentarían el CO2 en la atmósfera, pero cuando se quemaran en vehículos los combustibles sintéticos fabricados con ese CO2 capturado, el CO2 en la atmósfera sí que aumentaría, porque no hay manera económica de capturar las emisiones de vehículos.[21] La captura de centrales sí es posible, pero muy cara, y resulta más rentable sustituirlas por energías renovables.[59] En 2012 se evaluó que la mayoría de centrales térmicas de carbón y de gas natural pueden ser viablemente equipadas con filtros (scrubbers) de CO2 para captura de carbono y así reciclar los gases de escape, o bien almacenar subterráneamente el CO2.[16] En 2012 se esperaba no solo que este reciclaje costara menos que los impactos económicos del calentamiento mundial provocado por el efecto invernadero, sino que produjera combustibles más baratos que los fósiles, debido al crecimiento de la demanda mundial de combustible y el esperado pico petrolero que se preveía aumentaran los precios del petróleo y el gas natural fungible.[15][17] Pero el fuerte descenso de los precios de las energías renovables ha convertido en errónea esta evaluación. En 2019 muchos países ya han establecido 2050 como fecha límite en que su balance de emisiones de gases de efecto invernadero debe ser nulo.[60] Para ello toda la tecnología que actualmente genera emisiones y para la que exista una alternativa sin emisiones deberá ser sustituida. Las pocas emisiones restantes se compensarán.[61]
Capturar con energías renovables el CO2 del aire o del agua marina para sintetizar combustibles que luego se quemarían en vehículos crearía un ciclo cerrado de carbono.[5] A suficiente escala, esta captura eliminaría enteramente la necesidad de combustibles fósiles, suponiendo que se dispusiera de bastante energía renovable. Por otra parte, utilizar hidrocarburos sintéticos para producir materiales como plásticos podría resultar en una reducción permanente del CO2 atmosférico.[21]
Tecnologías
[editar]Combustibles tradicionales, metanol o etanol
[editar]Algunas autoridades han recomendado producir metanol en vez de combustibles de transporte tradicionales (gasolina y diésel). El metanol es líquido a temperaturas normales y tóxico si se ingiere. Tiene un índice de octano mayor que la gasolina, pero menor densidad de energía, y puede mezclarse con algunos combustibles (por ejemplo, la propia gasolina) o utilizarse puro. En ambos casos el motor tiene que estar diseñado para admitir ese combustible; alimentar con metanol un motor diseñado para gasolina lo estropeará.
También puede utilizarse metanol en la producción de hidrocarburos más complejos y de polímeros. Células de combustible de metanol directas han sido desarrolladas por el Laboratorio de Propulsión a Reacción de California para convertir metanol y oxígeno en electricidad.[37] Es posible convertir metanol en gasolina, queroseno u otros hidrocarburos, pero eso requiere energía adicional e instalaciones de producción más complejas.[21] El metanol es ligeramente más corrosivo que los combustibles tradicionales, por lo que utilizarlo en un automóvil de gasolina adaptable requiere modificaciones del orden de 100 $.[5]
En 2016 se desarrolló un método que utiliza nitrógeno, espículas de carbono y nanopartículas de cobre para convertir el dióxido de carbono en etanol, de propiedades parecidas al metanol.[62]
Microalgas
[editar]Las microalgas son una fuente potencial de combustibles neutros en carbono, pero los esfuerzos para aprovechar dicho potencial no han dado fruto por el momento. Son organismos unicelulares acuáticos que viven en un grupo grande y diverso y que no tienen estructuras celulares complejas, al revés que las plantas pluricelulares. Sin embargo siguen siendo foto-autótrofos, capaces de utilizar la energía solar para convertir unas sustancias en otras a través de la fotosíntesis. Se encuentran típicamente en sistemas de agua dulce y salada, y se han hallado aproximadamente 50 000 especies.[63]
Se ha pronosticado (pero aún está por ver) que las microalgas serán un buen sustituto del petróleo para las necesidades de combustible en la era del calentamiento mundial. Las microalgas convierten el CO2 en biomasa a mayor velocidad[64] que los cultivos terrestres de biocombustibles, y además no compiten por las tierras de cultivo, pero es más complicado cosecharlas.
Por ello el interés en cultivar microalgas ha aumentado en los últimos años. Se ven como potencial materia prima para la producción de biocombustibles por su capacidad de producir polisacáridos y triglicéridos (azúcares y grasas), los cuales son precursores del bioetanol y el biodiésel.[65] Las microalgas también pueden utilizarse para alimentar al ganado debido a sus proteínas. Más aún, algunas especies de microalgas producen compuestos valiosos como pigmentos o medicamentos.[64] En 2020 una empresa productora de microalgas, que aprovecha parte del CO2 emitido por una central de ciclo combinado, está duplicando anualmente el volumen de negocio, pero no produciendo biocombustibles, como tenía planeado inicialmente (esa línea de negocio no ha sido exitosa), sino fertilizantes.[14]
Producción
[editar]
Las dos maneras principales de cultivar microalgas son los estanques de flujo continuo y los fotobiorreactores. Estos estanques constan de un canal en bucle ovalado con una rueda de paletas para que circule agua e impedir la sedimentación. El canal está abierto al aire y su profundidad oscila entre 0,25 y 0,4 m (0,82–1,31 pies).[65] Es necesario que el canal sea superficial porque el autosombreado (las algas de las capas superiores quitan luz a las de las inferiores) y la absorción de la luz por el agua pueden limitar la penetración de la luz solar (de la que se nutren las algas) en el medio de cultivo.
Un fotobiorreactor está constituido por un conjunto de tubos transparentes cerrados, con un depósito central que impulsa el líquido. Es más fácil de gestionar que un estanque de flujo continuo, pero sus costes de producción globales son superiores.[66]
Las emisiones de gases de efecto invernadero (GEI) de la producción de combustibles con microalgas pueden compararse con las emisiones de la producción de biocombustibles convencionales. Las emisiones de la producción de combustibles con microalgas en fotobiorreactores podrían superar las emisiones del diésel fósil convencional, con lo cual esta forma de producción no tendría sentido si lo que se quiere es reducir las emisiones. La ineficiencia se debe a la cantidad de electricidad utilizada para bombear el medio de cultivo por todo el sistema. Utilizar subproductos del cultivo o energías renovables para generar la electricidad son estrategias que pueden mejorar el balance total de emisiones. También debe tenerse en cuenta el impacto ambiental de la gestión del agua y los nutrientes de las algas. Pero, en general, los estanques de flujo continuo arrojan un balance de emisiones mejor que el de los fotobiorreactores.[14]
Economía
[editar]Los costes de producción de biocombustibles mediante cultivo de microalgas en estanques de flujo continuo están dominados por los costes de operación, que comprenden mano de obra, materias primas, agua y electricidad. En estos estanques, durante el proceso de cultivo, la electricidad supone la mayor parte (del 22 al 79 %) de las necesidades energéticas totales.[65] Se usa para mantener en circulación el cultivo de microalgas. En cambio, si se utilizan fotobiorreactores, el coste de capital es lo que domina. Utilizar fotobiorreactores supone unos costes de construcción altos, pero unos costes de operación menores que los estanques.[14]
La producción de biocombustibles con microalgas costaba en 2011 mucho más dinero (alrededor de 3,1 $/litro u 11,57 $/galón),[67] que producir combustibles con petróleo (0,48 $/litro o 1,820 $/galón en octubre de 2018[68] según el dato proporcionado por la Comisión de Energía de California. Esta proporción de precio lleva a muchos a escoger combustibles fósiles por razones económicas, incluso si esto provoca un aumento de las emisiones de dióxido de carbono y otros gases de efecto invernadero.
Impacto ambiental
[editar]Se conocen varios impactos medioambientales derivados del cultivo de microalgas:
Agua
[editar]En la zona donde se realiza el cultivo puede producirse una mayor demanda de agua dulce, porque las microalgas son organismos acuáticos. El agua dulce se emplea para compensar la evaporación en los estanques de flujo continuo. También se utiliza para refrigeración. Recircular el agua podría reducir la necesidad de este líquido, pero supone un mayor riesgo de infección de las microalgas o inhibición de su crecimiento por bacterias, hongos o virus. Estos inhibidores se encuentran en mayores concentraciones en las aguas recicladas, junto con inhibidores no patogénicos como sustancias químicas orgánicas e inorgánicas o metabolitos resultantes de la muerte natural de algunas de las microalgas que se cultivan.
Toxicidad de las algas
[editar]Muchas especies de microalgas pueden producir toxinas (desde amoníaco hasta polisacáridos y polipéptidos fisiológicamente activos) en algún punto de su ciclo de vida. Estas toxinas pueden ser productos importantes y valiosos por sus aplicaciones en biomedicina, toxicología e investigación química. Sin embargo también pueden producir efectos negativos. Estas toxinas pueden ser agudas (se liberan en una cantidad significativa en un momento determinado) o crónicas (se liberan en pequeñas concentraciones a lo largo de toda la vida del alga). Un ejemplo de toxina aguda es la intoxicación paralizante por marisco,[69] que puede causar la muerte de la persona que ingiera el marisco contaminado. Un ejemplo de toxina crónica son los lentos cambios ulcerativos y carcinogénicos en los tejidos causados por los carragenanos tóxicos que producen las mareas rojas. Dada la alta variabilidad de las toxinas producidas por las microalgas, en un estanque donde se cultivan no siempre es posible pronosticar la presencia o ausencia de toxinas. Todo depende del entorno y las condiciones del ecosistema.[66]
Diésel de agua y dióxido de carbono
[editar]Audi ha codesarrollado el E-diésel, un combustible neutro en carbono con un alto índice de cetano. También está trabajando en la E-gasolina, fabricada mediante un proceso similar.[70]
Producción
[editar]Se electroliza agua a alta temperatura para producir hidrógeno y oxígeno gaseosos. La energía necesaria se extrae de fuentes renovables, como el viento. Entonces se hace reaccionar el hidrógeno con dióxido de carbono comprimido capturado directamente del aire. La reacción produce el llamado "crudo azul" (en realidad es un líquido transparente; se llama así para contrastar su diferencia con el petróleo, que es negro o marrón muy oscuro), compuesto de hidrocarburos. El crudo azul se refina entonces para producir E-diésel de alta eficacia.[71][72] Sin embargo este método es todavía discutible, porque con la capacidad de producción actual solo se pueden fabricar 3 000 litros en unos cuantos meses, el 0,0002 % de la producción diaria de combustible en los EE. UU.[73] Además, la viabilidad termodinámica y económica de esta tecnología ha sido cuestionada. Un artículo sugiere que esta tecnología no crea una alternativa a los combustibles fósiles, sino que simplemente convierte energía renovable en combustible líquido. El artículo también afirma que para conseguir un litro de E-diésel se necesita 18 veces más energía que para obtener un litro de diésel fósil convencional.[74]
Historia
[editar]La investigación de combustibles neutros en carbono lleva décadas en marcha. Un informe de 1965 sugirió sintetizar metanol a partir del dióxido de carbono del aire y energía nuclear para crear así una instalación móvil de aprovisionamiento de carburante.[75] La producción de combustible sintético a bordo de naves propulsadas con energía nuclear se estudió en 1977 y 1995.[76][77] Un informe de 1984 estudió la captura de dióxido de carbono de centrales térmicas y su conversión en combustible.[78] Un informe de 1995 comparaba la conversión de flotas de vehículos para que pudieran utilizar metanol neutro en carbono con la más complicada síntesis de gasolina, pero que no requeriría ninguna adaptación de los vehículos.[79]
Véase también
[editar] Portal:Energía. Contenido relacionado con Energía.
Portal:Energía. Contenido relacionado con Energía. Portal:Ecología. Contenido relacionado con Ecología.
Portal:Ecología. Contenido relacionado con Ecología.
Referencias
[editar]- ↑ Air Fuel Synthesis shows petrol from air has future
- ↑ The AFS Process - turning air into a sustainable fuel
- ↑ Leighty and Holbrook (2012) "Running the World on Renewables: Alternatives for Trannd Low-cost Firming Storage of Stranded Renewable as Hydrogen and Ammonia Fuels via Underground Pipelines" Proceedings of the ASME 2012 International Mechanical Engineering Congress & Exposition November 9–15, 2012, Houston, Texas
- ↑ a b Monforte, Carmen (15 de junio de 2020). «Repsol se alía con Aramco y el EVE para producir combustibles sintéticos». Cinco Días (12.266) (España). p. 10. Consultado el 16 de junio de 2020.
- ↑ a b c d e Zeman, Frank S.; Keith, David W. (2008). «Carbon neutral hydrocarbons». Philosophical Transactions of the Royal Society A 366 (1882): 3901-18. Bibcode:2008RSPTA.366.3901Z. PMID 18757281. doi:10.1098/rsta.2008.0143. Archivado desde el original el 25 de mayo de 2013. Consultado el 7 de septiembre de 2012.
- ↑ Wang, Wei; Wang, Shengping; Ma, Xinbin; Gong, Jinlong (2011). «Recent advances in catalytic hydrogenation of carbon dioxide». Chemical Society Reviews 40 (7): 3703-27. PMID 21505692. doi:10.1039/C1CS15008A. (Review.)
- ↑ a b MacDowell, Niall (2010). «An overview of CO2 capture technologies». Energy and Environmental Science 3 (11): 1645-69. doi:10.1039/C004106H. (Review.)
- ↑ a b Eisaman, Matthew D. (2012). «CO2 extraction from seawater using bipolar membrane electrodialysis». Energy and Environmental Science 5 (6): 7346-52. doi:10.1039/C2EE03393C. Consultado el 6 de julio de 2013.
- ↑ Biomass and the Environment – Basics
- ↑ a b David G.Artés (6 de octubre de 2011). «Biocombustibles: ¿problema o solución para el transporte?». Archivado desde el original el 22 de abril de 2017. Consultado el 6 de febrero de 2020.
- ↑ Graves, Christopher; Ebbesen, Sune D.; Mogensen, Mogens; Lackner, Klaus S. (2011). «Sustainable hydrocarbon fuels by recycling CO2 and H2O with renewable or nuclear energy». Renewable and Sustainable Energy Reviews 15 (1): 1-23. doi:10.1016/j.rser.2010.07.014. (Review.)
- ↑ Conference on Carbon Dioxide as Feedstock for Chemistry and Polymers (Essen, Germany, October 10–11, 2012; post-conference program Archivado el 15 de mayo de 2019 en Wayback Machine.)
- ↑ a b c Patiño, Miguel Ángel (16 de junio de 2020). «Así es la generación 4G de gasolinas». Expansión (10.295) (España). p. 11. Consultado el 16 de junio de 2020.
- ↑ a b c d Díaz, Tomás (25 de mayo de 2020). «AlgaEnergy alcanza el millón de clientes en unos 20 países». El Economista (España). Consultado el 25 de mayo de 2020.
- ↑ a b Goeppert, Alain; Czaun, Miklos; Prakash, G.K. Surya; Olah, George A. (2012). «Air as the renewable carbon source of the future: an overview of CO2 capture from the atmosphere». Energy and Environmental Science 5 (7): 7833-53. doi:10.1039/C2EE21586A. (Review.)
- ↑ a b House, K.Z.; Baclig, A.C.; Ranjan, M.; van Nierop, E.A.; Wilcox, J.; Herzog, H.J. (2011). «Economic and energetic analysis of capturing CO2 from ambient air». Proceedings of the National Academy of Sciences 108 (51): 20428-33. PMC 3251141. PMID 22143760. doi:10.1073/pnas.1012253108. Consultado el 7 de septiembre de 2012. (Review.)
- ↑ a b Lackner, Klaus S. (2012). «The urgency of the development of CO2 capture from ambient air». Proceedings of the National Academy of Sciences of the United States of America 109 (33): 13156-62. Bibcode:2012PNAS..10913156L. PMC 3421162. PMID 22843674. doi:10.1073/pnas.1108765109.
- ↑ Kothandaraman, Jotheeswari; Goeppert, Alain; Czaun, Miklos; Olah, George A.; Prakash, G. K. Surya (27 de enero de 2016). «Conversion of CO2 from Air into Methanol Using a Polyamine and a Homogeneous Ruthenium Catalyst». Journal of the American Chemical Society 138 (3): 778-781. ISSN 0002-7863. PMID 26713663. doi:10.1021/jacs.5b12354.
- ↑ a b Planelles, Manuel (1 de febrero de 2018). «La captura del CO2 no será la solución al cambio climático». El País. Consultado el 15 de febrero de 2018.
- ↑ «Gas renovable, clave para llegar a la economía climática neutra». EL INDEPENDIENTE (España). 5 de septiembre de 2019. Consultado el 6 de febrero de 2020.
- ↑ a b c d e f g h Pearson, R.J.; Eisaman, M.D. (2012). «Energy Storage via Carbon-Neutral Fuels Made From CO2, Water, and Renewable Energy». Proceedings of the IEEE 100 (2): 440-60. doi:10.1109/JPROC.2011.2168369. Archivado desde el original el 8 de mayo de 2013. Consultado el 7 de septiembre de 2012. (Review.)
- ↑ Pennline, Henry W. (2010). «Separation of CO2 from flue gas using electrochemical cells». Fuel 89 (6): 1307-14. doi:10.1016/j.fuel.2009.11.036.
- ↑ Graves, Christopher; Ebbesen, Sune D.; Mogensen, Mogens (2011). «Co-electrolysis of CO2 and H2O in solid oxide cells: Performance and durability». Solid State Ionics 192 (1): 398-403. doi:10.1016/j.ssi.2010.06.014.
- ↑ forestry projects: permanence, credit accounting and lifetime
- ↑ «Alemania proyecta la primera gran planta de producción de hidrógeno». 27 de febrero de 2019.
- ↑ «¿Serán los combustibles sintéticos la solución del futuro?». ABC (España). 30 de agosto de 2017. Consultado el 6 de febrero de 2020.
- ↑ Fraunhofer-Gesellschaft (5 de mayo de 2010). «Storing green electricity as natural gas». fraunhofer.de. Consultado el 9 de septiembre de 2012.
- ↑ James Temple (7 de mayo de 2019). «Captura de carbono: de ciencia marginal a bum de negocio». MIT Technology Review.
- ↑ «Carbon-negative biofuels; 6:The role of carbon credits». Energy Policy 36 (3): 940-945. March 2008. doi:10.1016/j.enpol.2007.11.029.
- ↑ Pearson, Richard; Eisaman (2011). «Energy Storage Via Carbon-Neutral Fuels Made From Carbon dioxide, Water, and Renewable Energy». Proceedings of the IEEE 100 (2): 440-460. doi:10.1109/jproc.2011.2168369. Archivado desde el original el 8 de mayo de 2013. Consultado el 18 de octubre de 2012.
- ↑ «COSTO DE TECNOLOGÍAS PARA ALMACENAMIENTO DE ENERGÍA».
- ↑ Kleiner, kurt (17 de enero de 2009). «Carbon Neutral Fuel; a new approach». The Globe and Mail: F4. Consultado el 23 de octubre de 2012.
- ↑ a b «Integration of Power to Gas/Power to Liquids into the ongoing transformation process». June 2016. Consultado el 10 de agosto de 2017.
- ↑ Javier Costas (7 de mayo de 2016). «Hidrógeno contra eléctrico, ¿quién es más eficiente?». Motor.
- ↑ «Extracting energy from air - is this the future of fuel?» (en inglés). Archivado desde el original el 3 de octubre de 2020. Consultado el 21 de octubre de 2020.
- ↑ «Technical Overview». Archivado desde el original el 9 de mayo de 2019. Consultado el 6 de febrero de 2020.
- ↑ a b Olah, George; Alain Geoppert; G. K. Surya Prakash (2009). «Chemical recycling of Carbon Dioxide to Methanol and Dimethyl Ether: From Greenhouse Gas to Renewable, Environmentally Carbon Neutral Fuels and Synthetic Hydrocarbons». Journal of Organic Chemistry 74 (2): 487-98. PMID 19063591. doi:10.1021/jo801260f.
- ↑ name="Pennline2010">Pennline, Henry W. (2010). «Separation of CO2 from flue gas using electrochemical cells». Fuel 89 (6): 1307-14. doi:10.1016/j.fuel.2009.11.036.
- ↑ Musadi, M.R.; Martin, P.; Garforth, A.; Mann, R. (2011). «Carbon neutral gasoline re-synthesised from on-board sequestrated CO2». Chemical Engineering Transactions 24: 1525-30. doi:10.3303/CET1124255.
- ↑ Keith, David W.; Holmes, Geoffrey; St. Angelo, David; Heidel, Kenton (2018). «A Process for Capturing CO2 from the Atmosphere». Joule 2 (8): 1573-1594. doi:10.1016/j.joule.2018.05.006.
- ↑ Electricity Price Archivado el 16 de enero de 2019 en Wayback Machine. NewFuelist.com (compare to off-peak wind power price graph.) Retrieved September 7, 2012.
- ↑ . 4th International Conference on Energy Sustainability, May 17–22, 2010. 2010.
- ↑ Tozer, Jessica L. (11 de abril de 2014). «Energy Independence: Creating Fuel from Seawater». Armed with Science. U.S. Department of Defense.
- ↑ Koren, Marina (13 de diciembre de 2013). «Guess What Could Fuel the Battleships of the Future?». National Journal.
- ↑ Tucker, Patrick (10 de abril de 2014). «The Navy Just Turned Seawater Into Jet Fuel». Defense One.
- ↑ Ernst, Douglas (10 de abril de 2014). «U.S. Navy to turn seawater into jet fuel». The Washington Times.
- ↑ Parry, Daniel (7 de abril de 2014). «Scale Model WWII Craft Takes Flight With Fuel From the Sea Concept». Archivado desde el original el 22 de agosto de 2017. Consultado el 6 de febrero de 2020.
- ↑ Putic, George (21 de mayo de 2014). «US Navy Lab Turns Seawater Into Fuel». VOA News.
- ↑ Center for Solar Energy and Hydrogen Research Baden-Württemberg (2011). «Verbundprojekt 'Power-to-Gas'». zsw-bw.de (en alemán). Archivado desde el original el 16 de febrero de 2013. Consultado el 9 de septiembre de 2012.
- ↑ Center for Solar Energy and Hydrogen Research (24 de julio de 2012). «Bundesumweltminister Altmaier und Ministerpräsident Kretschmann zeigen sich beeindruckt von Power-to-Gas-Anlage des ZSW». zsw-bw.de (en alemán). Archivado desde el original el 27 de septiembre de 2013. Consultado el 9 de septiembre de 2012.
- ↑ "George Olah CO2 to Renewable Methanol Plant, Reykjanes, Iceland" (Chemicals-Technology.com)
- ↑ Okulski, Travis (26 de junio de 2012). «Audi's Carbon Neutral E-Gas Is Real And They're Actually Making It». Jalopnik (Gawker Media). Consultado el 29 de julio de 2013.
- ↑ Rousseau, Steve (25 de junio de 2013). «Audi's New E-Gas Plant Will Make Carbon-Neutral Fuel». Popular Mechanics. Consultado el 29 de julio de 2013.
- ↑ Doty Windfuels
- ↑ CoolPlanet Energy Systems
- ↑ Air Fuel Synthesis, Ltd.
- ↑ Kiverdi, Inc. (5 de septiembre de 2012). «Kiverdi Receives Energy Commission Funding for Its Pioneering Carbon Conversion Platform» (press release). Consultado el 12 de septiembre de 2012.
- ↑ Raso, Concha (30 de enero de 2020). «El hidrógeno reclama un plan para fomentar su desarrollo». El Economista (España). Consultado el 10 de febrero de 2020.
- ↑ Esteller, Rubén (28 de septiembre de 2019). «Endesa cierra el carbón e invertirá más de 12.000 millones en renovables». El Economista (España). Consultado el 7 de febrero de 2020.
- ↑ EFE (11 de diciembre de 2019). «Los líderes de la UE fijarán el 2050 fecha límite para neutralidad climática». La Vanguardia (Barcelona, España). Consultado el 7 de febrero de 2020.
- ↑ «UNIÓN EUROPEA: OBJETIVO 'CERO EMISIONES' EN 2050».
- ↑ Johnston, Ian (19 de octubre de 2016). «Scientists accidentally turn pollution into renewable energy». The Independent. Archivado desde el original el 19 de octubre de 2016. Consultado el 19 de octubre de 2016.
- ↑ Adenle, Ademola A.; Haslam, Gareth E.; Lee, Lisa (1 de octubre de 2013). «Global assessment of research and development for algae biofuel production and its potential role for sustainable development in developing countries». Energy Policy (en inglés) 61: 182-195. ISSN 0301-4215. doi:10.1016/j.enpol.2013.05.088.
- ↑ a b Soto, Elena (24 de febrero de 2009). «Microalgas que capturan el dióxido de carbono y lo convierten en biodiésel». El Mundo (España). Consultado el 7 de febrero de 2020.
- ↑ a b c Slade, Raphael; Bauen, Ausilio (1 de junio de 2013). «Micro-algae cultivation for biofuels: Cost, energy balance, environmental impacts and future prospects». Biomass and Bioenergy (en inglés) 53: 29-38. ISSN 0961-9534. doi:10.1016/j.biombioe.2012.12.019.
- ↑ a b García Cubero, Rafael (2014). «Introducción». PRODUCCIÓN DE BIOMASA DE MICROALGAS RICA EN CARBOHIDRATOS ACOPLADA A LA ELIMINACIÓN FOTOSINTÉTICA DE CO2. Sevilla, España. p. 45. Consultado el 7 de febrero de 2020.
- ↑ Sun, Amy; Davis, Ryan; Starbuck, Meghan; Ben-Amotz, Ami; Pate, Ron; Pienkos, Philip T. (1 de agosto de 2011). «Comparative cost analysis of algal oil production for biofuels». Energy (en inglés) 36 (8): 5169-5179. ISSN 0360-5442. doi:10.1016/j.energy.2011.06.020.
- ↑ Commission, California Energy. «Estimated 2018 Gasoline Price Breakdown & Margins Details». www.energy.ca.gov (en inglés). Archivado desde el original el 9 de diciembre de 2018. Consultado el 30 de noviembre de 2018.
- ↑ Consuelo Ibáñez Martí (12 de noviembre de 2007). «Intoxicación Paralizante por mariscos: (PSP) Paralytic Shellfish Poisoning por Saxitoxina».
- ↑ Audi advances e-fuels technology: new “e-benzin” fuel being tested
- ↑ «How to Make Diesel Fuel from Water and Air - Off Grid World» (en inglés estadounidense). 25 de mayo de 2015. Consultado el 30 de noviembre de 2018.
- ↑ MacDonald, Fiona. «Audi Has Successfully Made Diesel Fuel From Carbon Dioxide And Water» (en inglés británico). Consultado el 30 de noviembre de 2018.
- ↑ «Reality check: Audi making e-diesel from air and water won't change the car industry». Alphr (en inglés). Archivado desde el original el 1 de septiembre de 2015. Consultado el 7 de diciembre de 2018.
- ↑ Mearns, Euan (12 de mayo de 2015). «The Thermodynamic and Economic Realities of Audi's E Diesel». Energy Matters (en inglés estadounidense). Consultado el 7 de diciembre de 2018.
- ↑ Beller, M.; Steinberg, M. (noviembre de 1965). Liquid fuel synthesis using nuclear power in a mobile energy depot system. Upton, Nueva York: Brookhaven National Laboratory, under contract with the U.S. Atomic Energy Commission. Consultado el 7 de septiembre de 2012.
- ↑ Bushore, U.S. Navy Lieutenant Robin Paul (mayo de 1977). Synthetic Fuel Generation Capabilities of Nuclear Power Plants with Applications to Naval Ship Technology (Tesis). Cambridge, Massachusetts: Department of Ocean Engineering, Massachusetts Institute of Technology. Consultado el 7 de septiembre de 2012.
- ↑ Terry, U.S. Navy Lieutenant Kevin B. (junio de 1995). Synthetic Fuels for Naval Applications Produced Using Shipboard Nuclear Power (Tesis). Cambridge, Massachusetts: Department of Nuclear Engineering, Massachusetts Institute of Technology. Consultado el 7 de septiembre de 2012.
- ↑ Steinberg, M. (1984). A Systems Study for the Removal, Recovery and Disposal of Carbon Dioxide from Fossil Power Plants in the U.S.. Washington, D.C.: U.S. Department of Energy, Office of Energy Research, Carbon Dioxide Research Division. Consultado el 8 de septiembre de 2012.
- ↑ Steinberg, Meyer (agosto de 1995). The Carnol Process for CO2 Mitigation from Power Plants and the Transportation Sector. Upton, New York: Department of Advanced Technology, Brookhaven National Laboratory. Consultado el 7 de septiembre de 2012.
Lectura adicional
[editar]- McDonald, Thomas M.; Lee, Woo Ram; Mason, Jarad A.; Wiers, Brian M.; Hong, Chang Seop; Long, Jeffrey R. (2012). «Capture of Carbon Dioxide from Air and Flue Gas in the Alkylamine-Appended Metal–Organic Framework mmen-Mg2(dobpdc)». Journal of the American Chemical Society 134 (16): 7056-65. PMID 22475173. doi:10.1021/ja300034j. — en septiembre de 2012 tiene 10 artículos que lo citan, muchos de los cuales hablan de la eficiencia y el coste de la captura de dióxido de carbono, del aire o de los gases de combustión.
- Kulkarni, Ambarish R.; Sholl, David S. (2012). «Analysis of Equilibrium-Based TSA Processes for Direct Capture of CO2 from Air». Industrial and Engineering Chemistry Research 51 (25): 8631-45. doi:10.1021/ie300691c. — afirma que puede extraer CO2 del aire con un coste de solo 100 $/tonelada, sin contar los gastos de capital.
- Holligan, Anna (1 de octubre de 2019). «Jet fuel from thin air: Aviation's hope or hype?». BBC News. Consultado el 24 de octubre de 2019.
Enlaces externos
[editar]- Doty Windfuels (Columbia, Carolina del Sur)
- Sistemas de Energía CoolPlanet (Camarillo, California)
- Modelo de coste para la producción de combustible sintético en la marina estadounidense a partir de energía nuclear y agua de mar John Morgan (enero de 2013)
- Entrevista con Kathy Lewis, del Laboratorio de Investigación Naval de Estados Unidos
