Cronología de la esclerosis tuberosa

La historia de la investigación sobre la esclerosis tuberosa (TSC, por sus siglas en inglés) abarca menos de 200 años. La TSC es una enfermedad genética rara y multisistémica que puede causar el crecimiento de tumores benignos en el cerebro u otros órganos vitales como los riñones, el corazón, los ojos, los pulmones y la piel. Una combinación de síntomas puede incluir convulsiones, discapacidad intelectual, problemas de comportamiento y anomalías cutáneas, así como enfermedades pulmonares y renales. La TSC se causa por mutaciones en uno de dos genes, TESK1 que codifica la proteína hamartina y TESK2 que codifica la tuberina. Estas proteínas actúan como supresores del crecimiento tumoral y regulan la proliferación y diferenciación celular.[1] Originalmente considerada una curiosidad patológica rara, ahora es un enfoque importante de investigación en la formación y supresión de tumores.
La historia de la investigación sobre la TSC se divide comúnmente en cuatro períodos.[2] A finales del siglo XIX, médicos notables que trabajaban en hospitales de enseñanza europeos describieron por primera vez las manifestaciones corticales y dermatológicas; estos primeros investigadores han sido reconocidos con epónimos como «enfermedad de Bourneville»[3] y «adenoma sebáceo de Pringle».[4] A principios del siglo XX, se reconoció que estos síntomas pertenecían a una única condición médica. Se descubrió la participación de otros órganos, junto con la realización de que la condición era muy variable en su gravedad. A finales del siglo XX, se produjeron grandes mejoras en las técnicas de imagen craneal y el descubrimiento de los dos genes. Finalmente, a principios del siglo XXI, comenzó a desarrollarse una comprensión molecular de la enfermedad, junto con posibles tratamientos terapéuticos no quirúrgicos.
Siglo XIX[editar]
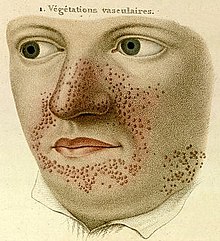
- 1835
- El dermatólogo francés Pierre François Olive Rayer publicó un atlas de enfermedades de la piel, el cual ontiene 22 grandes láminas coloreadas con 400 figuras presentadas en un orden sistemático. En la página 20, figura 1, hay un dibujo que se considera la descripción más antigua de la esclerosis tuberosa.[5] Titulado végétations vasculaires, Rayer señaló que eran «pequeños crecimientos vasculares, de apariencia papulosa, distribuidos en la nariz y alrededor de la boca».[6] No se mencionó ninguna condición médica asociada con el trastorno cutáneo.
- 1850
- Los dermatólogos ingleses Thomas Addison y William Gull describieron, en Guy’s Hospital Reports, el caso de una niña de cuatro años con una «erupción peculiar que se extendía por la nariz y afectaba levemente ambas mejillas», a la que llamaron «vitiligoidea tuberosa».[7]
- 1862
- El médico alemán Friedrich Daniel von Recklinghausen, que trabajaba como asistente de Rudolf Virchow en el Instituto de Anatomía Patológica de Berlín,[8] presentó un caso a la Sociedad Obstétrica de la ciudad.[9] El corazón de un bebé que «murió después de tomar unos pocos alientos» tenía varios tumores. Llamó a estos tumores «miomas», uno de los cuales tenía «el tamaño de un huevo de paloma».[7] También observó que el cerebro tenía «un gran número de esclerosis».[5] Estos eran casi con certeza los rabdomiomas cardíacos y los tubérculos corticales de la esclerosis tuberosa. No logró reconocer una enfermedad distinta, considerándola una curiosidad patológica-anatómica.[10] El nombre de Von Recklinghausen se asociaría en cambio con la neurofibromatosis después de un artículo clásico en 1881.[8]
- 1864
- El patólogo alemán Rudolf Virchow publicó una obra en tres volúmenes sobre tumores que describía a un niño con esclerosis tuberosa cerebral y rabdomioma del corazón. Su descripción contenía el primer indicio de que podría ser una enfermedad hereditaria: la hermana del niño había muerto de un tumor cerebral.[11]
- 1880
- El neurólogo francés Désiré-Magloire Bourneville tuvo un encuentro fortuito con la enfermedad que llevaría su nombre. Trabajaba como asistente no oficial de Jean Martin Charcot en La Salpêtrière.[10] Mientras sustituía a su maestro, Louis J.F. Delasiauve,[12] atendió a Marie, una niña de 15 años con retraso psicomotor, epilepsia y una «erupción vascular-papulosa confluyente en la nariz, las mejillas y la frente». Tenía antecedentes de convulsiones desde la infancia y fue llevada al hospital infantil a los tres años y declarada un caso sin esperanza. Tenía dificultades de aprendizaje y no podía ni caminar ni hablar. Mientras estaba bajo el cuidado de Bourneville, Marie tuvo un número cada vez mayor de convulsiones, que venían en racimos. Fue tratada con quinina, bromuro de alcanfor, nitrito de amilo y la aplicación de sanguijuelas detrás de las orejas. El 7 de mayo de 1879, Marie murió en su cama del hospital. La autopsia reveló tubérculos duros y densos en las circunvoluciones cerebrales, que Bourneville llamó Sclérose tubéreuse des circonvolutions cérébrales («esclerosis tuberosa de las circunvoluciones cerebrales»). Concluyó que eran la fuente (foco) de sus convulsiones. Además, se encontraron masas duras y blanquecinas, una «del tamaño de una nuez», en ambos riñones.[13]
- 1881
- El médico alemán Hartdegen describió el caso de un bebé de dos días que murió en estado epiléptico. La autopsia reveló pequeños tumores en los ventrículos laterales del cerebro y áreas de esclerosis cortical, que llamó «glioma gangliocelular cerebri congénito».[14][15]

- 1881
- Bourneville y Édouard Brissaud examinaron a un niño de cuatro años en el hospital Bicêtre. Al igual que antes, este paciente tenía tubérculos corticales, epilepsia y dificultades de aprendizaje. Además, tenía un soplo cardíaco y, en la autopsia, se encontraron pequeños tumores duros en las paredes ventriculares del cerebro (nódulos subependimarios) y pequeños tumores en los riñones (angiomiolipomas).[16]
- 1885
- Los médicos franceses Félix Balzer y Pierre Eugène Ménétrier informaron sobre un caso de adénomes sébacés de la face et du cuir (adenoma de las glándulas sebáceas de la cara y el cuero cabelludo).[17] El término ha resultado ser incorrecto, ya que no son ni adenomas ni derivados de las glándulas sebáceas. La erupción papular es ahora conocida como angiofibroma facial.[18]
- 1885
- Los dermatólogos franceses François Henri Hallopeau y Émile Leredde publicaron un caso de adenoma sebáceo que era de naturaleza dura y fibrosa. Describieron por primera vez las placas de zapa y más tarde notarían una asociación entre la erupción facial y la epilepsia.[7][19]
- 1890
- El dermatólogo escocés John James Pringle, que trabajaba en Londres, describió a una mujer de 25 años con inteligencia inferior a la normal, lesiones rugosas en los brazos y piernas, y una erupción facial papular. Pringle llamó la atención sobre cinco informes previos, dos de los cuales no fueron publicados.[20] El adenoma sebáceo de Pringle se convertiría en un epónimo común para la erupción facial.
Principios del siglo XX[editar]


- 1901
- El médico italiano GB Pellizzi estudió la patología de las lesiones cerebrales. Notó su naturaleza displásica, la heterotopía cortical y la mielinización defectuosa. Pellizzi clasificó los tubérculos en tipo 1 (superficie lisa) y tipo 2 (con depresiones centrales).[21][22]
- 1903
- El médico alemán Richard Kothe describió los fibromas periungueales, que fueron redescubiertos más tarde por el médico holandés Johannes Koenen en 1932 (conocidos como tumores de Koenen).[23]
- 1906
- El neurólogo australiano Alfred Walter Campbell, que trabajaba en Inglaterra, consideró que las lesiones en el cerebro, la piel, el corazón y el riñón eran causadas por una sola enfermedad. También describió por primera vez la patología en el ojo. Su revisión de 20 casos reportados lo llevó a sugerir una tríada diagnóstica de síntomas que se atribuye más comúnmente a Vogt.[24]
- 1908
- El neurólogo pediátrico alemán Heinrich Vogt estableció los criterios diagnósticos para la TSC, asociando firmemente la erupción facial con las consecuencias neurológicas de los tubérculos corticales.[25][26] La tríada de Vogt de epilepsia, idiocia y adenoma sebáceo se mantuvo durante 60 años hasta que la investigación de Manuel Gómez descubrió que menos de un tercio de los pacientes con TSC tenían los tres síntomas.[5]
- 1910
- J. Kirpicznick fue el primero en reconocer que la TSC era una condición genética. Describió casos de gemelos idénticos y fraternales, así como una familia con tres generaciones sucesivas afectadas.[27]
- 1911
- Edward Sherlock, abogado y conferenciante en biología, informó de nueve casos en su libro sobre los «débiles mentales». Acuñó el término epiloia, un acrónimo de epilepsia y anoia (sin mente).[28] La palabra ya no se usa ampliamente como sinónimo de TSC. El genetista Robert James Gorlin sugirió en 1981 que podría ser un acrónimo útil para epilepsia, baja inteligencia y adenoma sebáceo.[29]
- 1913
- A H. Berg se le atribuye haber declarado por primera vez que la TSC era un trastorno hereditario, señalando su transmisión a través de dos o tres generaciones.[30]
- 1914
- P. Schuster describió a un paciente con adenoma sebáceo y epilepsia, pero con inteligencia normal.[7] Esta expresión fenotípica reducida se llama forme fruste.[31]
- 1918
- El médico francés René Lutembacher publicó el primer informe de enfermedad pulmonar quística en un paciente con TSC. La mujer de 36 años murió de neumotórax bilateral. Lutembacher creía que los quistes y nódulos eran metástasis de un fibrosarcoma renal. Esta complicación, que solo afecta a las mujeres, ahora se conoce como linfangioleiomiomatosis (LAM).[32][33]
- 1920
- El oftalmólogo holandés Jan van der Hoeve describió los hamartomas retinianos (fákoma). Agrupó tanto la TSC como la neurofibromatosis como «fakomatosis» (más tarde llamadas síndromes neurocutáneos).[34]
- 1924
- H. Marcus señaló que las características distintivas de la TSC, como las calcificaciones intracraneales, eran visibles en radiografías.[35]

Mediados del siglo XX[editar]
- 1932
- MacDonald Critchley y Charles J.C. Earl estudiaron a 29 pacientes con TSC que estaban en instituciones mentales. Describieron comportamientos —movimientos inusuales de las manos, actitudes extrañas y movimientos repetitivos (estereotipias)— que hoy serían reconocidos como autistas. Sin embargo, pasarían 11 años antes de que Leo Kanner sugiriera el término «autismo». También notaron las manchas blancas asociadas en la piel (máculas hipomelánicas).[36]
- 1934
- N.J. Berkwitz y L.G. Rigler mostraron que era posible diagnosticar la esclerosis tuberosa utilizando la neumoencefalografía para resaltar los nódulos subependimarios no calcificados. Estos se asemejaban a «las gotas de cera de una vela encendida» en los ventrículos laterales.[37]
- 1942
- Sylvan E. Moolten propuso «el complejo de esclerosis tuberosa», que ahora es el nombre preferido. Esto reconoce la naturaleza multiorgánica de la enfermedad. Moolten introdujo tres palabras para describir su patología: «La lesión básica es hamartial, convirtiéndose a su vez en tumoral (hamartoma) o verdaderamente neoplásica (hamartoblastoma)».[38]
- 1954
- El patólogo noruego Reidar Eker crió una línea de ratas pardas predispuestas a adenomas renales. La rata Eker se convirtió en un importante modelo de cáncer hereditario dominante.[39]
- 1966
- Phanor Perot y Bryce Weir fueron pioneros en la intervención quirúrgica para la epilepsia en TSC. De los siete pacientes que se sometieron a resección del tubérculo cortical, dos quedaron libres de convulsiones. Antes de esto, solo cuatro pacientes habían sido tratados quirúrgicamente para la epilepsia en TSC.[40]
- 1967
- J.C. Lagos y Manuel Rodríguez Gómez revisaron 71 casos de TSC y encontraron que el 38% de los pacientes tenía inteligencia normal.[14][41]
- 1971
- El genetista estadounidense Alfred Knudson desarrolló su hipótesis para explicar la formación del retinoblastoma tanto en niños como en adultos. Los niños tenían una mutación congénita en la línea germinal que se combinaba con una mutación somática temprana en la vida para causar un tumor. Este modelo se aplica a muchas condiciones que involucran genes supresores de tumores como TSC.[42] En la década de 1980, los estudios de Knudson sobre la rata Eker fortalecieron esta hipótesis.[43]
- 1975
- Giuseppe Pampiglione y E. Pugh, en una carta a The Lancet, señalaron que hasta el 69% de los pacientes presentaban espasmos infantiles.[44]
- 1975
- Riemann utilizó por primera vez el ultrasonido para examinar los riñones afectados por TSC en el caso de una mujer de 35 años con insuficiencia renal crónica.[45][45]
Finales del siglo XX[editar]


- 1976
- La tomografía computarizada craneal (TC, inventada en 1972) demostró ser una excelente herramienta para diagnosticar neoplasias cerebrales en niños, incluidas las encontradas en la esclerosis tuberosa.[46]
- 1977
- Ann Mercy Hunt MBE y otros fundaron la Tuberous Sclerosis Association en el Reino Unido para brindar autoayuda y financiar la investigación.[47]
- 1979
- Manuel Gómez publicó la monografía Tuberous Sclerosis, que siguió siendo el libro de texto estándar durante tres ediciones durante dos décadas. El libro describió por primera vez el espectro clínico completo de la TSC y estableció un nuevo conjunto de criterios diagnósticos para reemplazar la tríada de Vogt.[14][48]
- 1982
- Kenneth Arndt trató con éxito el angiofibroma facial con un láser de argón.[49]
- 1983
- La tomografía por emisión de positrones (TEP, inventada en 1981) se comparó con la electroencefalografía (EEG) y la TC. Se encontró que era capaz de localizar tubérculos corticales epilépticos que de otro modo se habrían pasado por alto.[50]
- 1984
- Se descubrió que el grupo de espasmos infantiles en TSC estaba precedido por una descarga focal de EEG.[51]
- 1985
- La resonancia magnética (RM, inventada en 1980) se utilizó por primera vez en TSC para identificar regiones afectadas en el cerebro de una niña con esclerosis tuberosa.[52]
- 1987
- La resonancia magnética se consideró superior a la TC en cuanto a sensibilidad y especificidad. En un estudio de quince pacientes, identificó nódulos subependimarios que proyectaban hacia los ventrículos laterales en doce pacientes, distorsión de la arquitectura cortical normal en diez pacientes (correspondiente a tubérculos corticales), ventrículos dilatados en cinco pacientes, y distinguió un astrocitoma conocido de nódulos subependimarios benignos en un paciente.[53]
- 1987
- Se encontró que la imagen por RM era capaz de predecir la gravedad clínica de la enfermedad (epilepsia y retraso del desarrollo). Un estudio de 25 pacientes encontró una correlación con el número de tubérculos corticales identificados. En contraste, la TC no fue un predictor útil, pero fue superior en la identificación de lesiones calcificadas.[54]
- 1987
- El análisis de ligamiento en 19 familias con TSC localizó un probable gen en el cromosoma 9.[55]
- 1988
- Los tubérculos corticales encontrados en las imágenes por RM correspondían exactamente a la ubicación de los focos persistentes de EEG, en un estudio de seis niños con TSC. En particular, los tubérculos corticales frontales se asociaron con convulsiones más intratables.[56]
- 1990
- Se encontró que la vigabatrina era un tratamiento antiepiléptico altamente efectivo para los espasmos infantiles, particularmente en niños con TSC.[57] Tras el descubrimiento en 1997 de una posible constricción visual persistente como efecto secundario, la monoterapia con vigabatrina ahora se restringe en gran medida a este grupo de pacientes.[58]
- 1992
- El análisis de ligamiento localizó un segundo gen en el cromosoma 16p13.3, cerca del gen de la enfermedad renal poliquística tipo 1 (PKD1).[59]
- 1993
- El Consorcio Europeo de Cromosoma 16 para la Esclerosis Tuberosa anunció la clonación de TSC2; su producto se llama tuberina.[60]
- 1994
- Se descubrió que la rata Eker era un modelo animal para la esclerosis tuberosa; tiene una mutación en el equivalente del gen TSC2 en ratas.[61]
- 1995
- Se informó que la RM con secuencias de recuperación de la inversión atenuada de fluido (FLAIR) era significativamente mejor que las imágenes ponderadas en T2 estándar para resaltar pequeños tubérculos, especialmente los subcorticales.[62][63]
- 1997
- El Consorcio TSC1 anunció la clonación de TSC1; su producto se llama hamartina.[64]
- 1997
- El gen PKD1, que conduce a la enfermedad renal poliquística autosómica dominante (ADPKD), y el gen TSC2 se descubrieron adyacentes en el cromosoma 16p13.3. Un equipo con sede en el Instituto de Genética Médica en Gales estudió a 27 pacientes no relacionados con TSC y enfermedad quística renal. Concluyeron que la enfermedad renal grave en aquellos con TSC generalmente se debe a deleciones contiguas de genes de TSC2 y PKD1. También notaron que la enfermedad era diferente (más temprana y más grave) que ADPKD y que los pacientes con TSC1 no sufrían una enfermedad quística significativa.[65]
- 1997
- Patrick Bolton y Paul Griffiths examinaron a 18 pacientes con TSC, la mitad de los cuales tenían alguna forma de autismo. Encontraron una fuerte asociación entre los tubérculos en los lóbulos temporales y los pacientes con autismo.[66]
- 1998
- La Conferencia de Consenso sobre Esclerosis Tuberosa emitió criterios de diagnóstico revisados.[67]
- 1998
- Un equipo italiano utilizó la magnetoencefalografía (MEG) para estudiar a tres pacientes con TSC y epilepsia parcial. Combinado con la RM, pudieron estudiar la asociación entre áreas tuberosas del cerebro, el mal funcionamiento neuronal y las áreas epileptógenas.[68] Estudios posteriores confirmarían que la MEG es superior a la EEG en la identificación del tubérculo epiléptico, que puede ser candidato para la resección quirúrgica.[69]
Siglo XXI[editar]

- 2001
- Un grupo de cohorte multicéntrico de 224 pacientes fue examinado por mutaciones y gravedad de la enfermedad. Aquellos con TSC1 estaban menos gravemente afectados que aquellos con TSC2. Tenían menos convulsiones y menos deterioro mental. Algunos síntomas de TSC eran raros o ausentes en aquellos con TSC1. Una conclusión es que «tanto las mutaciones germinales como las somáticas parecen ser menos comunes en TSC1 que en TSC2».[70]
- 2002
- Varios grupos de investigación investigaron cómo los productos de los genes TSC1 y TSC2 (tuberina y hamartina) trabajan juntos para inhibir la señalización mediada por la diana de rapamicina en células de mamífero (mTOR). Esta importante vía regula la proliferación celular y la supresión de tumores.[71]
- 2002
- Se encontró que el tratamiento con rapamicina (sirolimus) reducía los tumores en el modelo de rata Eker (TSC2)[72] y en el modelo de ratón (TSC1)[73] de esclerosis tuberosa.
- 2006
- Pequeños ensayos mostraron resultados prometedores en el uso de la rapamicina para reducir el angiomiolipoma[74] y los astrocitomas.[75] Comenzaron varios ensayos clínicos multicéntricos más grandes: la linfangioleiomiomatosis (LAM)[76] y el angiomiolipoma renal (AML)[77] fueron tratados con rapamicina; los astrocitomas de células gigantes fueron tratados con el derivado de la rapamicina everolimus.[78]
2012
Se llevó a cabo una conferencia de consenso y se publicaron directrices revisadas para el diagnóstico y manejo de la esclerosis tuberosa.[79][80]
Referencias[editar]
- ↑ «Tuberous Sclerosis Fact Sheet» (en inglés). 11 de abril de 2006. NINDS. Consultado el 9 de enero de 2007.
- ↑ Rott, 2005, p. 2: Introducción
- ↑ Enersen, O. D. «Désiré-Magloire Bourneville». Who Named It? (en inglés). Consultado el 30 de abril de 2007.
- ↑ Enersen, O. D. «John James Pringle». Who Named It? (en inglés). Consultado el 30 de abril de 2007.
- ↑ a b c Curatolo, 2003, capítulo: Historical Background
- ↑ Rayer, P. F (1835). Traité des maladies de la peau / atlas (en francés). Paris: J.B. Baillière. p. 20. Consultado el 9 de diciembre de 2006.
- ↑ a b c d Jay, V (2004). «Tuberous sclerosis». Pediatric and Developmental Pathology (en inglés) 2 (2): 197-8. PMID 9949228. doi:10.1007/s100249900110.
- ↑ a b Enersen, O. D. «Friedrich Daniel von Recklinghausen». Who Named It? (en inglés). Consultado el 10 de diciembre de 2006.
- ↑ von Recklinghausen, F (1862). «Ein Herz von einem Neugeborene welches mehrere theils nach aussen, theils nach den Höhlen prominirende Tumoren (Myomen) trug». Monatschr Geburtsheilkd (en alemán) 20: 1-2.
- ↑ a b Jansen, F. E; van Nieuwenhuizen, O; van Huffelen, A. C (2004). «Tuberous sclerosis complex and its founders». Journal of Neurology, Neurosurgery, and Psychiatry (en inglés) 75 (5): 770. PMC 1763558. PMID 15090576. doi:10.1136/jnnp.2003.027524.
- ↑ Virchow, R (1863). Die Krankhaften Geschwülste II. Berlín: August Hirschwald. p. 148. (Citado en Acierno, 1994)
- ↑ Wilkins, Robert H; Brody, Irwin A. «XXXI Tuberous Sclerosis». Neurological Classics (en inglés). American Association of Neurological Surgeons. pp. 149-52. ISBN 978-1-879284-49-4.
- ↑ Bourneville, D. «Sclérose tubéreuse des circonvolutions cérébrales: Idiotie et épilepsie hemiplégique». Archives de Neurologie (en francés) 1: 81-91. Consultado el 22 de agosto de 200.
- ↑ a b c Sancak, Ö (2005). Tuberous Sclerosis Complex: Mutations, Functions and Phenotypes (en inglés). Stichting Tubereuze Sclerose Nederland. pp. 11-2. ISBN 978-90-902019-3-1.
- ↑ Hartdegen, A (1881). «"Ein Fall von multipler Verhärtung des Grosshirns nebst histologisch eigenartigen harten Geschwülsten der Seitenventrikel ("Glioma gangliocellulare") bei einem Neugeborenen». European Archives of Psychiatry and Clinical Neuroscience (en inglés) 11 (1): 117-31. doi:10.1007/BF02054825.
- ↑ Bourneville, D; Brissaud, E (1881). «Encéphalite ou sclérose tubéreuse des circonvolutions cérébrales». Archives de Neurologie 1: 390-412. (Citado en Curatolo, 2003)
- ↑ Balzer, F; Ménétrier, P (1885). «Étude sur un cas d'adénomes sébacés de la face et du cuir». Archives de Physiologie Normale et Pathologique (en inglés) 6: 564-76. (Citado en Curatolo, 2003)
- ↑ Sanchez, N. P; Wick, M. R; Perry, H. O (1981). «Adenoma sebaceum of Pringle: a clinicopathologic review, with a discussion of related pathologic entities». Journal of Cutaneous Pathology (en inglés) 8 (6): 395-403. PMID 6278000. doi:10.1111/j.1600-0560.1981.tb01028.x.
- ↑ Hallopeau, F; Leredde, É (1885). «Sur un cas d'adenomes sébacés à forme sclereuse». Ann Dermatol Syph (en inglés) 6: 473-9. (Citado en Curatolo, 2003)
- ↑ Pringle, J. J (1890). «A case of congenital adenoma sebaceum». British Journal of Dermatology (en inglés) 2: 1-14. Consultado el 22 de agosto de 2009.
- ↑ Pellizzi, G. B (1901). «Contributo allo studio dell'idiozia: rivisita sperimentale di freniatria e medicina legale delle alienazioni mentali». Riv Sper Freniat (en inglés) 27: 265-9. (Citado en Curatolo, 2003)
- ↑ Braffman, B. H; Bilaniuk, L. T; Naidich, T. P; Altman, N. R; Post, M. J; Quencer, R. M; Zimmerman, R. A; Brody, B. A (1992). «MR imaging of tuberous sclerosis: pathogenesis of this phakomatosis, use of gadopentetate dimeglumine, and literature review». Radiology 183 (1): 227-38. PMID 1549677. doi:10.1148/radiology.183.1.1549677.
- ↑ Kothe, R (1903). «Zur Lehre der Talgdrüsengeschwülste». Archiv für Dermatologie und Syphilis (en alemán) 68 (3): 273-8. doi:10.1007/BF01829939. (Citado en Rott, 2005
- ↑ Campbell, A. W (1906). «Cerebral sclerosis». Brain (en inglés) 28 (3–4): 382-96. doi:10.1093/brain/28.3-4.367.
- ↑ Enersen, O. D. «Heinrich Vogt». Who Named It? (en inglés). Consultado el 11 de diciembre de 2006.
- ↑ Vogt, H (1908). «Zur Diagnostik der tuberösen Sklerose». Zeitschrift für die Erforschung und Behandlung des Jugendlichen Schwachsinns Auf Wissenschaftlicher Grundlage (en alemán) 2. Jena. pp. 1-16. (Citado en Curatolo, 2003)
- ↑ Kirpicznik, J (1910). «Ein Fall von Tuberoser Sklerose und gleichzeitigen multiplen Nierengeschwùlsten». Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medizin (en alemán) 202 (3): 358-376. doi:10.1007/BF01993975. (Citado en Curatolo, 2003)
- ↑ Sherlock, E. B (1911). The Feeble-minded, A Guide to Study and Practice (en inglés). Macmillan & Co. (Citado en Jay, 2004)
- ↑ Online Mendelian Inheritance in Man (OMIM). «Tuberous Sclerosis - 191100» (en inglés).
- ↑ Berg, H (1913). «Vererbung der tuberösen Sklerose durch zwei bzw. drei Generationen». Z Ges Neurol Psychiatr (en alemán) (19): 528-39. doi:10.1007/BF02909909. (Citado en Curatolo, 2003)
- ↑ Schuster, P (1914). «Beiträge zur Klinik der tuberösen Sklerose des Gehirns». Dtsch Z Nervenheilkd (en alemán) 50: 96-133. (Citado en Curatolo, 2003)
- ↑ Lutembacher, R (1918). «Dysembryomes métatypique des reins. Carcinose submiliaire aigue du poumon avec emphysème généralisé et double pneumothorax». Annals of Medicine (en francés) 5: 435-50. (Citado en Curatolo, 2003)
- ↑ Abbott, G. F; Rosado-de-Christenson, M. L; Frazier, A. A; Franks, T. J; Pugatch, R. D; Galvin, J. R (2005). «From the archives of the AFIP: lymphangioleiomyomatosis: radiologic-pathologic correlation». Radiographics (en inglés) 25 (3): 803-28. PMID 15888627. doi:10.1148/rg.253055006.
- ↑ Van der Hoeve, J (1920). «Eye symptoms in tuberous sclerosis of the brain». Trans Ophthalmol Soc UK (en inglés) 40: 329-34. (Citado en Curatolo, 2003)
- ↑ Marcus, H (1924). «Characteristic roentgenographic changes associated with tuberous sclerosis». Archives of Neurology and Psychiatry (en inglés) 53 (3): 199-204. doi:10.1001/archneurpsyc.1945.02300030036005. (Citado en Curatolo, 2003 y Gómez, 1995)
- ↑ Critchley, M; Earl, C. J (1932). «Tuberose sclerosis and allied conditions». Brain (en inglés) 55 (3): 311-46. doi:10.1093/brain/55.3.311.
- ↑ Berkwitz, N. J; Rigler, L. G (1934). «Tuberous sclerosis diagnosed with cerebral pneumography». Archives of Neurology and Psychiatry (en inglés) 35 (833–8). (Citado en Gómez, 1995)
- ↑ Moolten, S. E (1942). «Hamartial nature of tuberous sclerosis complex and its bearings on the tumor problem: report of a case with tumor anomaly of the kidney and adenoma sebaceum». Arch Intern Med (en inglés) 69 (4): 589-623. doi:10.1001/archinte.1942.00200160040005.
- ↑ Eker, K (1954). «Familial renal adenomas in Wistar rats; a preliminary report». Acta Pathologica et Microbiologica Scandinavica (en inglés) 34 (6): 554-62. PMID 13206757. doi:10.1111/j.1699-0463.1954.tb00301.x. (Citado en Yeung, 1994)
- ↑ Perot, P; Weir, B; Rasmussen, T (1966). «Tuberous sclerosis. Surgical therapy for seizures». Archives of Neurology (en inglés) 15 (5): 498-506. PMID 5955139. doi:10.1001/archneur.1966.00470170052005. (Citado en Bebin, E. M; Kelly, P. J; Gomez, M. R (1993). «Surgical treatment for epilepsy in cerebral tuberous sclerosis». Epilepsia (en inglés) 34 (3): 651-7. PMID 8330575. doi:10.1111/j.1528-1157.1993.tb00442.x.)
- ↑ Lagos, J. C; Gomez, M. R (1967). «Tuberous sclerosis: reappraisal of a clinical entity». Mayo Clinic Proceedings (en inglés) 42 (1): 26-49. PMID 5297238. (Citado en Curatolo, 2003)
- ↑ Knudson, A. G (1971). «Mutation and cancer: statistical study of retinoblastoma». Proceedings of the National Academy of Sciences of the United States of America 68 (4): 820-3. Bibcode:https://ui.adsabs.harvard.edu/abs/1971PNAS...68..820K/abstract. PMC 389051. PMID 5279523. doi:10.1073/pnas.68.4.820. (Citado en Rott, 2005)
- ↑ Yeung, R. S (2004). «Lessons from the Eker rat model: from cage to bedside». Current Molecular Medicine (en inglés) 4 (8): 799-806. PMID 15579026. doi:10.2174/1566524043359791.
- ↑ Pampiglione, G; Pugh, E (1975). «Letter: Infantile spasms and subsequent appearance of tuberous sclerosis syndrome». Lancet (en inglés) 2 (7943): 1046. PMID 53537. doi:10.1016/S0140-6736(75)90343-8.
- ↑ a b Riemann, J. F; Mörl, M; Rott, H. D (1975). «Chronic renal failure in bourneville-pringle's disease». Medizinische Klinik (en alemán) 70 (26): 1128-32. PMID 1223616. (Citado en Rott, 2005)
- ↑ Berger, P. E; Kirks, D. R; Gilday, D. L; Fitz, C. R; Harwood-Nash, D. C (1976). «Computed tomography in infants and children: intracranial neoplasms». AJR. American Journal of Roentgenology (en inglés) 127 (1): 129-37. PMID 180824. doi:10.2214/ajr.127.1.129.
- ↑ McFarlane, Isobel (30 de julio de 2014). «Ann Hunt obituary». The Guardian (en inglés). ISSN 0261-3077. Consultado el 14 de agosto de 2019.
- ↑ Gómez, M. R (1979). Tuberous Sclerosis (en inglés) (1° edición). Nueva York: Raven Press. ISBN 978-0-89004-313-4. (Citado en Özgür, 2005)
- ↑ Arndt, K. A (1982). «Adenoma sebaceum: successful treatment with the argon laser». Plastic and Reconstructive Surgery 70 (1): 91-3. PMID 7089113. doi:10.1097/00006534-198207000-00021. (Citado en Rott, 2005)
- ↑ Szelies, B; Herholz, K; Heiss, W. D; Rackl, A; Pawlik, G; Wagner, R; Ilsen, H. W; Wienhard, K (1983). «Hypometabolic cortical lesions in tuberous sclerosis with epilepsy: demonstration by positron emission tomography». Journal of Computer Assisted Tomography 7 (6): 946-53. PMID 6415136. doi:10.1097/00004728-198312000-00002. (Citado en Rott, 2005)
- ↑ Dulac, O; Lemaitre, A; Plouin, P (1984). «The Bourneville syndrome: clinical and EEG features of epilepsy in the first year of life». Boll Lega Ital Epil (en inglés) (45/46): 39-42. (Citado en Curatolo, 2003)
- ↑ Kandt, R. S; Gebarski, S. S; Goetting, M. G (1985). «Tuberous sclerosis with cardiogenic cerebral embolism: magnetic resonance imaging». Neurology (en inglés) 35 (8): 1223-5. PMID 4022361. doi:10.1212/wnl.35.8.1223. (Citado en Rott, 2005)
- ↑ McMurdo, S. K; Moore, S. G; Brant-Zawadzki, M; Berg, B. O; Koch, T; Newton, T. H; Edwards, M. S (1987). «MR imaging of intracranial tuberous sclerosis». AJR. American Journal of Roentgenology (en inglés) 148 (4): 791-6. PMID 3493666. doi:10.2214/ajr.148.4.791.
- ↑ Roach, E. S; Williams, D. P; Laster, D. W (1987). «Magnetic resonance imaging in tuberous sclerosis». Archives of Neurology 44 (3): 301-3. PMID 3827681. doi:10.1001/archneur.1987.00520150047020. (Citado en Curatolo, 2003)
- ↑ Fryer, A. E; Chalmers, A; Connor, J. M; Fraser, I; Povey, S; Yates, A. D; Yates, J. R; Osborne, J. P (1987). «Evidence that the gene for tuberous sclerosis is on chromosome 9». Lancet (en inglés) 1 (8534): 659-61. PMID 2882085. doi:10.1016/S0140-6736(87)90416-8.
- ↑ Curatolo, P; Cusmai, R (1988). «Magnetic resonance imaging in Bourneville's disease: relation to the EEG». Neurophysiologie Clinique = Clinical Neurophysiology (en francés) 18 (5): 459-67. PMID 3185465. doi:10.1016/s0987-7053(88)80056-x. (Citado en Curatolo, 2003)
- ↑ Chiron, C; Luna, D; Palacios, L; Mondragon, S; Beaumont, D; Mumford, J. P (1990). «Vigabatrin in infantile spasms». Lancet (en inglés) 335 (8685): 363-4. PMID 1967808. doi:10.1016/0140-6736(90)90660-W.
- ↑ Vigabatrin Paediatric Advisory Group (2000). «Guideline for prescribing vigabatrin in children has been revised. Vigabatrin Paediatric Advisory Group». BMJ (en inglés) 320 (7246): 1404-5. PMC 1118061. PMID 10858057. doi:10.1136/bmj.320.7246.1404.
- ↑ Kandt, R. S; Haines, J. L; Smith, M; Northrup, H; Gardner, R. J; Short, M. P; Dumars, K; Roach, E. S et al. (1992). «Linkage of an important gene locus for tuberous sclerosis to a chromosome 16 marker for polycystic kidney disease». Nature Genetics (en inglés) 2 (1): 37-41. PMID 1303246. doi:10.1038/ng0992-37.
- ↑ European Chromosome 16 Tuberous Sclerosis Consortium (1993). «Identification and characterization of the tuberous sclerosis gene on chromosome 16». Cell (en inglés) 75 (7): 1305-15. PMID 8269512. doi:10.1016/0092-8674(93)90618-Z. (Citado en Rott, 2005)
- ↑ Yeung, R. S; Xiao, G. H; Jin, F; Lee, W. C; Testa, J. R; Knudson, A. G (1994). «Predisposition to renal carcinoma in the Eker rat is determined by germ-line mutation of the tuberous sclerosis 2 (TSC2) gene». Proceedings of the National Academy of Sciences of the United States of America (en inglés) 91 (24): 11413-6. Bibcode:https://ui.adsabs.harvard.edu/abs/1994PNAS...9111413Y/abstract. PMC 45241. PMID 7972075. doi:10.1073/pnas.91.24.11413.
- ↑ Maeda, M; Tartaro, A; Matsuda, T; Ishii, Y (1995). «Cortical and subcortical tubers in tuberous sclerosis and FLAIR sequence». Journal of Computer Assisted Tomography (en inglés) 19 (4): 660-1. PMID 7622707. doi:10.1097/00004728-199507000-00033.
- ↑ Takanashi, J; Sugita, K; Fujii, K; Niimi, H (1995). «MR evaluation of tuberous sclerosis: increased sensitivity with fluid-attenuated inversion recovery and relation to severity of seizures and mental retardation». AJNR. American Journal of Neuroradiology (en inglés) 16 (9): 1923-8. PMC 8338227. PMID 8693996.
- ↑ van Slegtenhorst, M; de Hoogt, R; Hermans, C; Nellist, M; Janssen, B; Verhoef, S (1997). «Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34». Science (en francés) 277 (5327): 805-8. PMID 9242607. doi:10.1126/science.277.5327.805.
- ↑ Sampson, J. R; Maheshwar, M. M; Aspinwall, R; Thompson, P; Cheadle, J. P; Ravine, D; Roy, S; Haan, E et al. (1997). «Renal cystic disease in tuberous sclerosis: role of the polycystic kidney disease 1 gene». American Journal of Human Genetics (en inglés) 61 (4): 843-51. PMC 1716004. PMID 9382094. doi:10.1086/514888.
- ↑ Bolton, P. F; Griffiths, P. D (1997). «Association of tuberous sclerosis of temporal lobes with autism and atypical autism». Lancet (en inglés) 349 (9049): 392-5. PMID 9033466. doi:10.1016/S0140-6736(97)80012-8.
- ↑ Roach, E. S; Gomez, M. R; Northrup, H (1998). «Tuberous sclerosis complex consensus conference: revised clinical diagnostic criteria». Journal of Child Neurology (en inglés) 13 (12): 624-8. PMID 9881533. doi:10.1177/088307389801301206.
- ↑ Peresson, M; Lopez, L; Narici, L; Curatolo, P (1998). «Magnetic source imaging and reactivity to rhythmical stimulation in tuberous sclerosis». Brain & Development (en inglés) 20 (7): 512-8. PMID 9840671. doi:10.1016/S0387-7604(98)00034-5.
- ↑ Jansen, F. E; Huiskamp, G; van Huffelen, A.C; Bourez-Swart, M; Boere, E; Gebbink, T; Vincken, K. L; van Nieuwenhuizen, O (2006). «Identification of the epileptogenic tuber in patients with tuberous sclerosis: a comparison of high-resolution EEG and MEG». https://onlinelibrary.wiley.com/doi/10.1111/j.1528-1167.2006.00373.x (en inglés) 47 (1): 108-14. PMID 16417538. doi:10.1111/j.1528-1167.2006.00373.x.
- ↑ Dabora, S. L; Jozwiak, S; Franz, D. N; Roberts, P. S; Nieto, A; Chung, J; Choy, Y. S; Reeve, M. P et al. (2001). «Mutational analysis in a cohort of 224 tuberous sclerosis patients indicates increased severity of TSC2, compared with TSC1, disease in multiple organs». American Journal of Human Genetics (en inglés) 68 (1): 64-80. PMC 1234935. PMID 11112665. doi:10.1086/316951.
- ↑ Tee, A. R; Fingar, D. C; Manning, B. D; Kwiatkowski, D. J; Cantley, L. C; Blenis, J (2002). «Tuberous sclerosis complex-1 and -2 gene products function together to inhibit mammalian target of rapamycin (mTOR)-mediated downstream signaling». Proceedings of the National Academy of Sciences of the United States of America (en inglés) 99 (99): 13571-6. Bibcode:https://ui.adsabs.harvard.edu/abs/2002PNAS...9913571T. PMC 129715. PMID 12271141. doi:10.1073/pnas.202476899.
- ↑ Kenerson, H. L; Aicher, D. L; True, L. D; Yeung, R. S (2002). «Activated mammalian target of rapamycin pathway in the pathogenesis of tuberous sclerosis complex renal tumors». Cancer Research (en inglés) 62 (20): 5645-50. PMID 12384518.
- ↑ Kwiatkowski, D. J; Zhang, H; Bandura, J. L; Heiberger, K. M; Glogauer, M; el-Hashemite, N; Onda, H (2002). «A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, and up-regulation of p70S6 kinase activity in Tsc1 null cells». Human Molecular Genetics (en inglés) 11 (5): 525-34. PMID 11875047. doi:10.1093/hmg/11.5.525.
- ↑ Wienecke, R; Fackler, I; Linsenmaier, U; Mayer, K; Licht, T; Kretzler, M (2006). «Antitumoral activity of rapamycin in renal angiomyolipoma associated with tuberous sclerosis complex». American Journal of Kidney Diseases (en inglés) 48 (3): e27-9. PMID 16931204. doi:10.1053/j.ajkd.2006.05.018.
- ↑ Franz, D. N; Leonard, J; Tudor, C; Chuck, G; Care, M; Sethuraman, G; Dinopoulos, A; Thomas, G et al. (2006). «Rapamycin causes regression of astrocytomas in tuberous sclerosis complex». Annals of Neurology (en inglés) 59 (3): 490-8. PMID 16453317. doi:10.1002/ana.20784. Archivado desde el original el 17 de diciembre de 2012.
- ↑ «Multicenter International Lymphangioleiomyomatosis Efficacy of Sirolimus Trial (The MILES Trial)». ClinicalTrials.gov (NIH) (en inglés). 6 de enero de 2007. Consultado el 10 de enero de 2007.
- ↑ «Sirolimus in Treating Patients With Angiomyolipoma of the Kidney». ClinicalTrials.gov (NIH) (en inglés). 21 de noviembre de 2006. Consultado el 10 de enero de 2007.
- ↑ «Everolimus (RAD001): first systemic treatment for subependymal giant cell astrocytoma associated with tuberous sclerosis complex». ClinicalTrials.gov (NIH) (en inglés). Consultado el 11 de julio de 2024.
- ↑ Krueger, D. A; Northrup, H (2013). «Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference». Pediatric Neurology (en inglés) 49 (4): 255-65. PMC 4058297. PMID 24053983. doi:10.1016/j.pediatrneurol.2013.08.002.
- ↑ Northrup; Krueger, D. A (2013). «Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference». Pediatric Neurology (en inglés) 49 (4): 243-54. PMC 4080684. PMID 24053982. doi:10.1016/j.pediatrneurol.2013.08.001.
Bibliografía[editar]
- Acierno, L. J (1994). The History of Cardiology (en inglés). Taylor & Francis. p. 427. ISBN 978-1-85070-339-6.
- Curatolo, P (2003). Tuberous Sclerosis Complex : From Basic Science to Clinical Phenotypes (en inglés). MacKeith Press. ISBN 978-1-898683-39-1.
- Gómez, M. R (1995). «History of the tuberous sclerosis complex». Brain & Development 17: 55-7. PMID 8882573. doi:10.1016/0387-7604(94)00130-8.
- Rott, H. D (2005). Zur Geschichte der Tuberösen Sklerose (The History of Tuberous Sclerosis) (en alemán). Tuberöse Sklerose Deutschland. Archivado desde el original el 15 de marzo de 2007. Consultado el 8 de enero de 2007.
