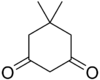
Dimedona
| Dimedona | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 5,5-Dimetilciclohexano-1,3-diona | ||
| General | ||
| Otros nombres |
Ciclometona, 5,5-dimetil-1,3-ciclohexanediona, Dimetildihidroresorcinol, Metona | |
| Fórmula molecular | C8H12O2 | |
| Identificadores | ||
| Número CAS | 126-81-8[1] | |
| ChemSpider | 29091 | |
| PubChem | 31358 | |
| UNII | B2B5DSX2FC | |
| Propiedades físicas | ||
| Apariencia | Cristales amarillos | |
| Masa molar | 140,17968 g/mol | |
| Punto de fusión | 423 K (150 °C) | |
| Propiedades químicas | ||
| Acidez | 5.23 pKa | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La dimedona es una dicetona cíclica utilizada en síntesis orgánica para determinar si un compuesto contiene un grupo de aldehído. Como otras ciclohexanedionas, este compuesto puede ser utilizado como ligante en catalizadores formados a partir de complejos con metales. Otros usos incluyen aplicaciones en colorimetría, cristalografía, luminiscencia y análisis espectrofotométrico. También puede ser utilizado en química de compuestos orgánicos de baja resistencia eléctrica.
Síntesis
[editar]La dimedona se prepara a partir de óxido de mesitilo y malonato de dietilo.[2]
Propiedades físicas
[editar]La dimedona normalmente se encuentra como cristales blancos o amarillentos. Es estable bajo condiciones ambientales y solubles en agua, así como en etanol y metanol. Tiene un intervalo de puntos de fusión de 147–150 °C (420–423 K).
Tautomería
[editar]La dimedona se encuentra en equilibrio con su tautómero enólico en disolución. Por ejemplo el enol se encuentra con respecto al ceto en una proporción de 2:1 cuando se encuentra en disolución con cloroformo.[3]
La dimedona cristalina de estabiliza por cadenas de moléculas, en la forma enol, el cual permite conectarse por medio de puentes de hidrógeno:[4]
Referencias
[editar]- ↑ Número CAS
- ↑ R. L. Shriner and H. R. Todd (1935). «5,5-dimethyl-1,3-cyclohexanedione». Organic Syntheses 15: 16. doi:10.1002/0471264180.os015.06. Archivado desde el original el 29 de septiembre de 2012. Consultado el 21 de enero de 2017.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. p. 532. ISBN 978-0-19-850346-0.
- ↑ M. Bolte and M. Scholtyssik (octubre de 1997). «Dimedone at 133K». Acta Crystallogr. C 53 (10): IUC9700013. doi:10.1107/S0108270197099423.



