Electrodo selectivo de iones

Un electrodo selectivo de iones (ISE por sus sigla en inglés), también denominado electrodo para iones epecíficos (SIE), es un transductor que convierte la actividad de un ion en disolución, en una señal de potencial eléctrico, que puede ser medida con un voltímetro o pH-metro. Básicamente consiste en una membrana más o menos selectiva cuya superficie externa se encuentra en contacto con el ion a determinar, mientras que la interna generalmente lo está con una disolución del mismo ion a actividad constante[1]. La diferencia de potencial entre ambas superficies de la membrana está en relación con las diferencias de concentración (o mas estrictamente, de actividad), por lo que dicho potencial puede ser medido frente a un electrodo de referencia. Teóricamente, esta diferencia de potencial debida a la actividad iónica está conforme con la ecuación de Nernst, por lo que la señal medida tiene una relación logarítmica con la concentración del ion analizado. En consecuencia, a veces, a estos electrodos también se les denomina genéricamente electrodos pIon o específicamente por el ion al que son sensibles, como por ejemplo, electrodo de pH, si mide la actividad del ion H+; electrodo pF, si se trata del anión F-, pCa, etc.[2]
Los electrodos selectivos de iones son utilizados frecuentemente en los laboratorios de análisis químico y en investigaciones en el ámbito de la bioquímica y biofísica, donde se requiere conocer las concentraciones iónicas en una solución acuosa, por lo general en tiempo real.[3]
Historia[editar]
Los electrodos selectivos de iones tuvieron su origen a comienzos del siglo XX, cuando se descubrió que diferentes tipos de vidrios presentaban cierta sensibilidades a los cambios en la acidez del medio (pH), siendo este hecho posteriormente investigado por otros científicos. En 1906, M. Cremer encontró que el potencial eléctrico que aparece entre diferentes partes de un fluido ubicado en lados opuestos de una membrana de vidrio es proporcional a la concentración de ácido (concentración de iones hidrógeno).[4] Tras este descubrimiento, empezó a estudiarse y desarrollarse lo que sería el primer electrodo selectivo de iones, el electrodo de vidrio, aunque en aquel momento apenas se tenía un conocimiento detallado de cómo funcionan este tipo de electrodos indicadores.
Posteriormente al descubrimiento del electrodo de vidrio, surgieron numerosos estudios teóricos y prácticos que permitieron, con el tiempo, determinar o interpretar los mecanismos por los que se desarrollaba el potencial en las membranas de vidrio, con diferentes propuestas, como las del intercambio iónico de B. P. Nicolsky o los mecanismos de disociación propuestos, mucho después, por F. G. K. Baucke.[5]Algunos de estos estudios permitieron descubrir que la selectividad de la membrana de vidrio no era solo a los iones H+, sino que bajo determinadas condiciones de trabajo o mediante modificaciones de la composición de la membrana, esta podía mostrar sensibilidad y selectividad a otros iones alcalinos. Así, por ejemplo, a pH muy alcalino, algunas composiciones de la membrana de vidrio muestran respuesta selectiva que permite la determinación de litio, sodio, amonio, y otros cationes monovalentes en determinados rangos de concentración de tales cationes.[2]
Después de cierto lapso de tiempo, ya en la década de 1960, aparecería abundante información científica sobre electrodos selectivos de iones, describiéndose diferentes electrodos de iones selectivos a diferentes especies iónicas, generalmente de cationes, aunque también de aniones, como el electrodo de fluoruro de lantano, sensible a iones F-, desarrollado por M. S. Frant y J.M. Ross en 1966[6], posteriormente comercializado y muy utilizado en medidas de fluoruro en disolución, por su gran reproducibilidad y sensibilidad.
El estudio y desarrollo de los electrodos selectivos de iones recibió un gran empuje tras los simposios que tuvieron lugar en 1969, en el National Bureau of Standars (USA) y en el Institute of Science and Technology de la Universidad de Gales (U.K.). Esta reuniones científicas contribuyeron a la aceptación general de los electrodos selectivos de iones a la vez que proporcionaron una abundante fuente de información.[7]
En la actualidad existen numerosos electrodos selectivos de iones, muchos de ellos comercializados, que pueden utilizarse en la determinación específica de diferentes especies iónicas.[8]
Tipos de membranas selectivas de iones[editar]
Existen diferentes tipos de membranas selectivas de iones que se utilizan en electrodos selectivos de iones (ISEs). Estas pueden clasificarse de diferentes maneras. La IUPAC, originalmente, en 1994 los clasificó en tres grupos principales con varios subgrupos:[9]
- Electrodos selectivos primarios.
- Electrodos cristalinos
- De membrana homogénea
- De membrana heterogénea
- Electrodos no cristalinos
- De matriz rígida
- De matriz no rígida
- Electrodos cristalinos
- Electrodos selectivos compuestos o de membrana múltiple.
- Sensores de gases
- De sustrato enzimático
- Electrodos de membrana en contacto con el metal conductor u otro soporte conductor.
Esta clasificación suele simplificarse y se considera que la mayoría de ellos entran en alguna de las siguientes categorías o tipos: membranas de vidrio, membranas cristalinas en estado sólido, membrana líquida y electrodos compuestos.[10][11]
Membranas de vidrio[editar]
Un ejemplo muy común de este tipo de electrodo es el electrodo de pH de vidrio. Este tipo de electrodo selectivo es muy anterior, en varias décadas, al desarrollo de otros tipos de membrana selectiva de iones. Las membranas de vidrio se fabrican con un tipo de vidrio especial que tiene una pequeñísima conductividad (100 MΩ de resistencia) y que permite el intercambio de ciertos iones. Es la membrana más estudiada y conocida ya que se utiliza en los electrodos de medida del pH, por ser altamente selectiva a iones H+. Con el tiempo, estas membranas se fueron perfeccionando e incluso modificando su composición, de forma que a finales de la década de 1970 ya era posible encontrar electrodos de vidrio para otros iones; principalmente K+, Na+, Ag+ y algunos divalentes. La membrana de vidrio posee una excelente durabilidad química y puede funcionar en medios muy agresivos.
Membranas cristalinas[editar]
Los electrodos selectivos en estado sólido de membrana cristalina, pueden ser de cristal único (monocristal) o policristalinas, es decir, de una sustancia cristalina que se fija a una matriz inerte. Entre los electrodos que se basan en un único cristal inorgánico, destaca el electrodo selectivo de fluoruro, cuya membrana es un monocristal de trifluoruro de lantano (LaF3) impurificado (dopado, en el argot técnico) con una pequeña cantidad de fluoruro de europio (EuF2). El monocristal que actúa como membrana selectiva, cierra la parte inferior de un tubo de material polimérico inerte, que le confiere rigidez y que permite contener la disolución de relleno con ion fluoruro a concentración (o actividad) constante y el electrodo de referencia interna, habitualmente un hilo de plata impregnado de cloruro de plata. El ion fluoruro puede migrar desde la disolución de medida a la disolución interior del electrodo (o viceversa), favorecida por la presencia del EuF2, que hace que el cristal presente huecos reticulares en su estructura. Las migraciones del ion fluoruro a través de estos huecos hace que se establezca una diferencia de potencial entre las dos caras del cristal, que es proporcional a la diferencia de concentraciones y que puede ser medida con un milivoltímetro conectado al electrodo y a otro electrodo de referencia.
Los electrodos policristalinos están formados por sales poco solubles (AgCl, AgBr, Ag2S, etc.) prensadas a unas 7000 atm o suspendidas en matrices poliméricas. Estos electrodos son sensibles a iones Ag+ y a aniones que reaccionan con la plata (Cl-, S2-, etc.) para dar compuestos poco solubles. Impurificando las sale de plata de la membrana policristalina con sales insolubles de otros metales, como por ejemplo CuS, CdS o PbS, es posible elaborar electrodos con respuesta a Cu2+, Cd2+ o Pb2+.[11]
Estos electrodos poseen una buena selectividad, porque solo iones que logran penetrar en la estructura cristalina pueden interferir con la respuesta del electrodo. La selectividad de membranas cristalinas puede ser tanto para catión y anión de la substancia que forma la membrana.
Membranas líquida de intercambio de iones[editar]
Las membranas líquidas se preparan a partir de intercambiadores de iones, líquidos e inmiscibles, que están contenidos en un soporte sólido, inerte y poroso. Estos electrodos básicamente son similares al electrodo de monocristal del fluoruro de lantano, descrito anteriormente. La principal diferencia se encuentra en que el monocristal que cierra el tubo, donde se encuentra la disolución del ion a actividad constante, se sustituye por una membrana impregnada con un intercambiador líquido orgánico que se almacena en un deposito que rodea al tubo que contiene la referencia interna[11].
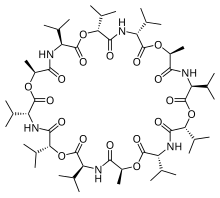
Las sustancias activas empleadas en las membranas líquidas pueden ser intercambiadores catiónicos, intercambiadores aniónicos o compuestos neutros macrocíclicos, que forman complejos con ciertos cationes en forma selectiva. Estos últimos también se conocen como electrodos selectivos de iones basados en ionóforos. Los ionóforos son sustancias neutras lipofílicas que pueden formar compuestos de coordinación con los iones analito, como la valinomicina, un antibiótico tipo éter macrocíclico sin carga, que tiene una gran afinidad con el potasio. También se pueden utilizar ionóforos para aniones, como las bis-tioureas, especialmente selectivas hacia el ion cloruro. La selectividad de estas membranas por un ion específico está regida por la estabilidad del complejo formado entre el ionóforo y el ion analito.[2]
El uso de membranas líquidas específicas permite preparar electrodos selectivos para decenas de iones diferentes, siendo los electrodos más populares y difundidos con selectividad aniónica. Sin embargo, este tipo de electrodos poseen una baja durabilidad química y física lo que resulta en una vida útil corta.
Electrodos compuestos[editar]
A este último tipo de electrodos pertenecen los sensores de gases y los electrodos enzimáticos y su denominación se debe a que, generalmente, son de diseño compuesto ya que incorporan un electrodo ordinario (por ejemplo de pH) rodeado de una disolución de electrolito contenida en una membrana adicional que, en unos casos separa la especie que detecta el electrodo y en otros, la genera. Actualmente existen sensores de este tipo para CO2, NH3, SO2, H2S u otros gases con propiedades ácidas o básicas.[11]
Algunos electrodos compuestos contienen, en la membrana, enzimas inmovilizadas que catalizan alguna reacción en la que está involucrado el analito y cuyo producto de reacción es lo que detecta el electrodo. Aunque estos electrodos enzimáticos no son verdaderos electrodos selectivos de iones, generalmente se consideran dentro del alcance de los electrodos selectivos de iones, pues estos electrodos tienen un mecanismo de "doble reacción": una enzima reacciona con una sustancia específica y el producto de esta reacción (generalmente H+ u OH-) se detecta mediante un verdadero electrodo selectivo de iones, como los electrodos selectivos de pH. Todas estas reacciones ocurren dentro de una membrana especial, que cubre el verdadero electrodo selectivo de iones. Esta es la razón por la que los electrodos enzimáticos a veces se consideran selectivos para los iones. Un ejemplo es un electrodo selectivo de glucosa.
Véase también[editar]
Referencias[editar]
- ↑ Sánchez Batanero, Pedro (1981). Química Electrocatalítica. Fundamentos y aplicaciones. Madrid: Alhambra Universidad. p. 193. ISBN 84-205-0824-1.
- ↑ a b c Skoog, D. A.; Holler, F. J.; . Crouch, S. R. (2008). «Cap. 23D. Electrodos indicadores de membrana». Principios de análisis instrumental. Mexico: Cengage Learning. pp. 664-665. ISBN 607-481-390-6.
- ↑ Bard, Allen J.; Faulkner, Larry R. (2001). Electrochemical methods: fundamentals and applications (2nd ed edición). Wiley. ISBN 978-0-471-04372-0.
- ↑ Cremer, M. Über die Ursache der elektromotorischen Eigenschaften der Gewebe, zugleich ein Beitrag zur Lehre von Polyphasischen Elektrolytketten. — Z. Biol. 47: 56 (1906).
- ↑ Scholz, Fritz (2011-01). «Nikolsky’s ion exchange theory versus Baucke’s dissociation mechanism of the glass electrode». Journal of Solid State Electrochemistry (en inglés) 15 (1): 67-68. ISSN 1432-8488. doi:10.1007/s10008-010-1163-0. Consultado el 18 de junio de 2024.
- ↑ Frant, Martin S.; Ross, James W. (1966). «Electrode for Sensing Fluoride Ion Activity in Solution». Science 154 (3756): 1553 - 1555.
- ↑ Durst, R. A. (1969). National Bureau of Standars, ed. Ion-Selective Electrodes. Consultado el 18 de junio de 2024.
- ↑ Rubinson, Kenneth A.; Rubinson, Judith F. (2000). «Cap. 7.4 Potenciometría y electrodos selectivos de iones». Análisis instrumental. Prentice Hall. ISBN 84-205-2988-5.
- ↑ Buck, R. P.; Lindner, E. (1 de enero de 1994). «Recommendations for nomenclature of ionselective electrodes (IUPAC Recommendations 1994)». Pure and Applied Chemistry 66 (12): 2527-2536. ISSN 1365-3075. doi:10.1351/pac199466122527. Consultado el 19 de junio de 2024.
- ↑ Bakker, Eric; Qin, Yu (1 de junio de 2006). «Electrochemical Sensors». Analytical Chemistry (en inglés) 78 (12): 3965-3984. ISSN 0003-2700. PMC 2883720. PMID 16771535. doi:10.1021/ac060637m. Consultado el 19 de junio de 2024.
- ↑ a b c d Harris, Daniel C. (1992). «Cap. 15-6 Electrodos selectivos de iones». Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. ISBN 970-625-003-4.
Enlaces externos[editar]
- SCIMEDIA: Ion-Selective Electrodes Archivado el 27 de abril de 2014 en Wayback Machine.
- Ion-selective electrodes by Wojciech Wroblewski
- Guide to use of ion-selective electrodes, with both simple and very detailed versions, including theoretical formulae and tables
- Sensoric Applications
- H+ ion-selective electrode – freeware for pH calculation and titration data analysis and simulation
- Medidores de Electrodos selectivos de iones
