Ensayo de quimiotaxis
Los ensayos de quimiotaxis son instrumentos experimentales conocidas para la evaluación de la habilidad quimiotáctica de las células procariotas o eucariotas y se aplican una amplia variedad de técnicas para este objetivo.
Algunas de ellas son cualitativas y el investigador puede determinar cual de las células prefiere o no evaluar químicamente. Otras son cuantitativas y podemos obtener información sobre la intensidad de las respuestas en una forma detallada.
Control calidad
[editar]En general el requisito más importante para la evaluación de ambos modelos de células y de, ligando, es calibrar el tiempo de incubación. Un tiempo de incubación corto, no deja células en la muestra y un tiempo demasiado prolongado altera las medidas de concentración de gradientes (sustancias) y las respuestas quimiocinética y quimiotácticas.
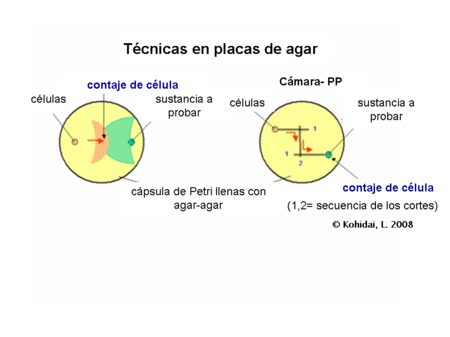
- Técnicas en agar (de placa-agar)
- Conteo de células
Las técnicas más usadas se dividen en dos grupos
Técnicas en placa-agar
[editar]Este tipo de evaluación se trata de cultivos semisólidos que contienen agar-agar o gelatina lo cual es primordial para el experimento. Pequeñas cantidades son cortadas en capas y llenadas con las células y la sustancia de prueba. Las células pueden migrar hacia el gradiente químico en la capa semisólida e incluso por debajo de esta también. Algunas variaciones de la técnica tratan también con pozos y canales paralelos conectados entre ellos antes del inicio del experimento (técnica PP).
Una forma radial (circular) de la técnica PP (3 o más canales) nos da la posibilidad de comparar la actividad quimiotáctica entre las diferentes poblaciones celulares o del estudio preferencial entre ligandos.[1]
Conteo de células
[editar]Las células blanco que responden en forma positiva, podrían ser contadas desde el frente después de la migración de las células, después de la tinción, o en condiciones normales en el microscopio óptico.
Técnica de dos cámaras (two-chamber technique)
[editar]Las cámaras aisladas por filtros son herramientas adecuadas para determinar con exactitud el comportamiento de quimiotaxis. El pionero de este tipo de cámaras fue construido por Boyden.[2]
Las células móviles se colocan en la cámara superior, mientras que con la sustancia de ensayo disuelta se llena la primera cámara inferior . El tamaño de las células móviles que son investigadas determinan el tamaño del poro del filtro, y esto es esencial para elegir un diámetro que permite una transmigración activa. Para la elaboración de modelos en condición in vivo varios protocolos prefieren una cobertura de filtro con moléculas de la matriz extracelular (ejemplo: colágeno, elastina, etc). La eficiencia de las mediciones se incrementó por el desarrollo de los multipozos “multiwell” (ejemplo, NeuroProbe), en donde 24, 96 y hasta 384 muestras se evalúan en forma paralela. La ventaja de esta variante es que varios ensayos paralelos son realizables en idénticas condiciones.
En otro tipo de cámaras, las mismas están conectadas horizontalmente una al lado de la otra (ejemplo, cámara Zigmond)[3] o como anillos concéntricos en una diapositiva (ejemplo, cámara Dunn).[4] Se desarrolla un gradiente de concentración en un estrecho puente de conexión entre las cámaras y el número de las células que emigran también se cuenta en el microscopio óptico. En algunos casos, el puente entre las dos cámaras se llena de agar y las células tienen que mantenerse en esta capa semisólida.
Algunas técnicas capilares proporcionan también una cámara como arreglo, sin embargo, ahora hay un filtro entre las células y la sustancia de prueba.[5] Se obtienen resultados cuantitativos con esta técnica multipozos “multiwell”. Este tipo de pruebas usa pipetas multicanal de 4-8 y 12 puntas. La precisión de la pipeta y el aumento del número de muestras paralelas es la gran ventaja de esta prueba.[6]
Conteo de células: las respuestas positivas de las células se cuentan en la cámara inferior ( después de un largo tiempo de incubación) o desde el filtro (corto tiempo de incubación). Para la detección de células se usan técnicas de tinción (ejemplo, azul de tripano) o sondas especiales (p.ej., mt-deshidrogenasa detección de ensayo con MTT). Las células marcadas (p.ej., fluorocromos) son también usadas, en algunos ensayos las células marcadas se obtienen a través de la transmigración por el filtro.

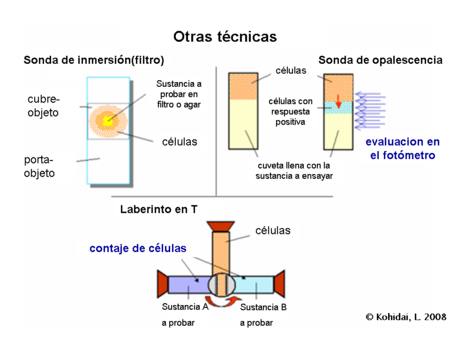
Otras técnicas
[editar]Además de los dos mencionados , de las familias de técnicas de uso común existe una amplia gama de protocolos que fueron desarrollados para medir la actividad de quimiotaxis. Algunas de ellas son sólo cualitativas, como los tests de agregación, cuando los pequeños trozos de filtros o agar se colocan sobre un portaobjetos y se mide la acumulación de células a su alrededor.
En otra técnica semicuantitativa, las células son sobrepuestas en la sustancia de ensayo y los cambios en la opalescencia del compartimiento originalmente libre de células se registran durante el tiempo de incubación.[7]
La tercera muy frecuentementemente utilizada, sin embargo, es la técnica cualitativa laberinto en T o T-maze y sus adaptaciones de las microplacas. En la versión original el contenedor es perforado, se llena de células. Entonces, la ficha se retuerce y las células logran contactarse con otros dos contenedores llenos de diferentes sustancias. La incubación es para poder emparejar y contar el número de células a partir de los contenedores.[8]
Referencias
[editar]- ↑ Kőhidai L. (1995). «Method for determination of chemoattraction in Tetrahymena pyriformis.». Curr Microbiol 30: 251-3.
- ↑ Boyden, S.V. (1962). «The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes.». J Exp Med 115: 453.
- ↑ Zigmond S.H. (1988). «Orientation chamber in chemotaxis.». Methods Enzymol 162: 65-72.
- ↑ Zicha D., Dunn G.A., Brown A.F. (1991). «A new direct-viewing chemotaxis chamber.». J Cell Sci 99: 769-75.
- ↑ Leick V.and Helle J. (1983). «A quantitative assay for ciliate chemotaxis.». Anal Biochem 135: 466-9.
- ↑ Kőhidai, L., Lemberkovits, É. and Csaba, G. (1995). «Molecule dependent chemotactic responses of Tetrahymena pyriformis elicited by volatile oils.». Acta Protozool 34: 181-5.
- ↑ Koppelhus U., Hellung-Larsen P. and Leick V. (1994). «An improved quantitative assay for chemokinesis in Tetrahymena.». Biol Bull 187: 8-15.
- ↑ Van Houten J., Martel E. and Kasch T. (1982). «Kinetic analysis of chemokinesis of Paramecium.». J Protozool 29: 226-30.
