Fosfofructocinasa-2
| Fosfofructocinasa-2 isoenzima 1 | ||||
|---|---|---|---|---|
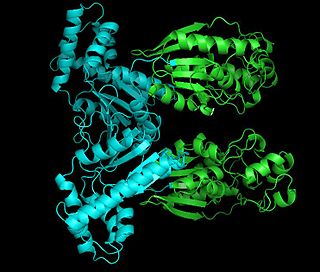 Fosfofructoquinasa-2 de la rata. | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Nomenclatura |
Otros nombres 6-fosfofructo-2-cinasa isoenzima 1
| |||
| Símbolos | PFK2 (HGNC: 8872) 6PF-2-K | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.105 | |||
| Locus | Cr. X p11.21 | |||
| Estructura/Función proteica | ||||
| Tamaño | 471 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Fosfofructocinasa-2 isozima 2 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Nomenclatura |
Otros nombres 6-fosfofructo-2-kinasa isozima 2
| |||
| Símbolos | PFK2 (HGNC: 8873) 6PF-2-K | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.105 | |||
| Locus | Cr. 1 q31-32.2 | |||
| Estructura/Función proteica | ||||
| Tamaño | 505 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Fosfofructocinasa-2 isoenzima 3 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Nomenclatura |
Otros nombres 6-fosfofructo-2-kinasa isozima 3
| |||
| Símbolos | PFK2 (HGNC: 8874) 6PF-2-K | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.105 | |||
| Locus | Cr. 10 p15.1 | |||
| Estructura/Función proteica | ||||
| Tamaño | 520 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Fosfofructocinasa-2 isoenzima 4 | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Nomenclatura |
Otros nombres 6-fosfofructo-2-kinasa isozima 4
| |||
| Símbolos | PFK2 (HGNC: 8875) 6PF-2-K | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.1.105 | |||
| Locus | Cr. 3 p22-21 | |||
| Estructura/Función proteica | ||||
| Tamaño | 469 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La fosfofructocinasa-2 (PFK2) o 6-fosfofructo-2-cinasa (EC 2.7.1.105) es una enzima responsable de la regulación de la velocidad de la glicólisis y la gluconeogénesis en el cuerpo humano. También tiene actividad fosfatasa correspondiente a la fructosa-2,6-bisfosfato 2-fosfatasa (número EC 3.1.3.46). Las reacciones catalizadas son:
- Actividad cinasa: fructosa-6-fosfato + ATP fructosa-2,6-bisfosfato + ADP
- Actividad fosfatasa: fructosa-2,6-bisfosfato + H2O fructosa-6-fosfato + fosfato
Es un homodímero de subunidades de 55 kDa en la que cada cadena polipeptídica consiste en dominios independientes cinasa y fosfatasa. Cuando la Ser-32 está fosforilada, la carga negativa causa un cambio conformacional de la enzima para favorecer la actividad fosfatasa; en otras formas, la actividad cinasa está favorecida. El dominio PFK2 está relacionado estrechamente a la superfamilia de proteínas que se unen a mononucleotidos (como la adenilato ciclasa). El dominio fosfatasa está relacionado con las proteínas que incluyen las fosfoglicerato mutasas.
Estructura
[editar]Los monómeros de la proteína bifuncional están claramente divididos en dos dominios funcionales. El dominio cinasa está localizado en el N-terminal. Consiste en una lámina central beta de seis filamentos, con cinco filamentos paralelos y un filamento antiparalelo, rodeado por siete hélices alfa. El dominio contiene el sitio de unión del nucleótido en el final C-terminal del primer filamento beta, por tanto, se parece a la estructura de la adenilato cinasa.
El dominio fosfatasa está localizado en el C-terminal. Se parece a la familia de proteínas que incluye las fosfoglicerato mutasas y las ácido fosfatasas. El dominio tiene una estructura mixta α/β, con una lámina central beta de seis filamentos y un subdominio alfa-helicoidal que presumiblemente incluye el sitio activo de la molécula.
Finalmente la región N-terminal modula las actividades de la cinasa y la fosfatasa, y estabiliza la forma dimérica de la enzima.
Función
[editar]Cuando el nivel de glucosa es bajo, se libera glucagón en la corriente sanguínea, activando una cascada de señalización mediante cAMP. La proteína cinasa A, activada por la cascada de cAMP, fosforila la enzima bifuncional activando la fosfatasa y bajando los niveles de fructosa-2,6-bisfosfato. Ya que la fructosa-2,6-bisfosfato normalmente estimula a la fosfofructocinasa-1, una reducción en su concentración provoca la inhibición de la glicólisis y la estimulación de la gluconeogénesis.
En cambio, cuando el nivel de glucosa se incrementa, el nivel de fructosa-6-fosfato se incrementa y la molécula estimula a la proteína fosfatasa 2, que elimina el grupo fosfato de la proteína bifuncional. De esta forma el dominio cinasa es activado y cataliza la formación de fructosa-2,6-bisfosfato. Entonces, la glicólisis es estimulada y la gluconeogénesis inhibida.
Regulación
[editar]La regulación alostérica de la fosfofructocinasa-2 (PFK2) es muy similar a la regulación de la fosfofructocinasa-1 (PFK1). La presencia de altos niveles de AMP o grupo fosfato significa la presencia de bajos niveles de glucosa y estimula a PFK2. En cambio, la presencia de una alta concentración de fosfoenolpiruvato y citrato significa que hay una presencia elevada del precursor biosintético y por tanto inhibe a PFK2. En cambio, a diferencia de PFK1, la PFK2 no es afectada por la concentración de ATP.
El glucagón inhibe a la PFK2 activando la proteína cinasa A. Se causa que la actividad de la fosfatasa sea favorecida, disminuyendo la concentración de fructosa-2,6-bisfosfato e inhibiéndose la glicólisis a través de la inhibición de PFK1.
Mecanismo de reacción
[editar]La fosfofructocinasa-2 parece que cataliza la transferencia "simple" del grupo γ-fosfato del ATP al carbono C-2 de la fructosa-6-fosfato, en cambio, teóricamente esta reacción puede ocurrir por una variedad de mecanismos incluyendo la formación de un compuesto intermedio fructosa-6-fosfato-2-pirofosfato.
La hidrólisis de la fructosa-2,6-bisfosfato parece que sigue las siguientes etapas:
- La histidina actúa como un nucleófilo y ataca al grupo 2-fosfato.
- La estabilización del estado de transición pentacoordinado mediante varios puentes salinos y puentes de hidrógeno.
- La rotura del estado de transición y la liberación de fructosa-6-fosfato.
- La histidina incrementa la nucleofilia del agua que ataca a la fosfohistidina, generándose fosfato y de nuevo la histidina protonada.
Isozimas
[editar]Hasta la fecha se han reportado 5 isozimas de la proteína en los mamíferos. Se deben a la transcripción de diferentes enzimas o a splicing alternativo. Las isozimas difieren radicalmente en su regulación y lo expuesto más arriba corresponde a la isozima 1 (hígado).
Los genes humanos que codifican las proteínas con actividad fosfofructocinasa-2 son:
Relevancia clínica
[editar]El gen PFKFB2 que codifica la fosfofructocinasa-2 isozima 2 está relacionado con la predisposición a la esquizofrenia. El control de la actividad de fosfofructocinasa-2 isozima 2 está relacionado con el funcionamiento del corazón y el control contra la hipoxia.

