Hidrosilano
En química, los hidrosilanos son compuestos de silicio tetravalentes que contienen uno o más enlaces Si-H. El hidrosilano principal es el silano (SiH4). Comúnmente, el hidrosilano se refiere a los derivados de los organosilicones. Los ejemplos incluyen fenilsilano (PhSIH3) y trietoxisilano ((C2H5O) 3SIH). Los polímeros y los oligómeros terminados con hidrosilanos son resinas que se utilizan para hacer materiales útiles como los calafates.
Síntesis
[editar]El triclorosilano se produce comercialmente mediante la reacción de cloruro de hidrógeno con silicio:
- Si + 3 HCl → HSiCl3 + H2
Muchos hidrosilanos de alcoxi se generan por alcohólisis de triclorosilano. Un ejemplo es el trietoxisilano:
- HSiCl3 + 3 EtOH → HSi(OEt)3 + 3 HCl
Los organohidrosilanos se pueden preparar mediante hidrosilación parcial de silano en sí:
- SiH4 + 3 C2H4 → HSi(C2H5)3
En el laboratorio, los hidrosilanos se preparan clásicamente tratando clorosilanos con reactivos de hidruro, como el hidruro de aluminio de litio:
- 4 ClSi(C2H5)3 + LiAlH4 → 4 HSi(C2H5)3 + "LiAlCl4"
Enlace y estructura
[editar]El enlace de silicio a hidrógeno es más largo que el enlace C-H (148 en comparación con 105 PM). El enlace SI-H es aproximadamente un 10% más débil en comparación con los enlaces C-H.
| Enlace | D (kJ/mol, 298K) |
|---|---|
| H3C-H | 441 |
| H3Si-H | 384 |
| (CH3)3C-H | 404 |
| (CH3)3Si-H | 397 |
| ((CH3)3Si)3Si-H | 351 |
El hidrógeno es más electronegativo que el silicio (de ahí la convención de nombres de hidruros de silil), lo que da como resultado que la polarización del enlace Si-H sea el reverso de eso para el enlace C-H. En general, los hidruros de silil son incoloros con propiedades físicas (solubilidad, volatilidad) comparables a los hidrocarburos. Pueden ser pirofóricos, lo que refleja la gran fuerza impulsora para reemplazar los enlaces SI-H con enlaces Si-O.
Reacciones y aplicaciones
[editar]Dejando a un lado el silano, para lo cual se utiliza principalmente en la industria de la microelectrónica como fuente de Si, los hidrosilanos participan en muchas reacciones. Los hidrosilanos se utilizan principalmente para diversos estilos de reducción en reacciones industriales y de laboratorio a escala. Estos incluyen desoxigenación, hidrosililación e hidrogenación iónica.
Hidrosililación
[editar]Hidrosililación de SIN, el enlace Si-H se suma a través de múltiples enlaces en alquenos, alquinos, imines y carbonilos. La reacción de los alquenos es comercialmente significativa. Muchos compuestos y materiales de organosilicones se preparan de esta manera. Illustrativo es la reticulación de siloxanos terminados en vinilo:

Conversión a silanoles
[editar]En presencia de catalizadores a base de platino, los hidrosilanos reaccionan con agua para dar silanoles:
- R3SiH + H2O → R3SiOH + H2
La misma transformación puede efectuarse con oxígeno en presencia de catalizadores.[2]
Complejos de fluoruro
[editar]En presencia de iones de fluoruro, los hidrosilanos forman reversiblemente fluorosilicatos hipervalentes con la fórmula R3Si(F)H−. Estas especies son agentes reductores, similares al borohidruro.[3][4]

Hidrogenación iónica
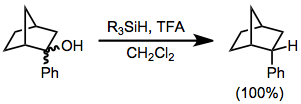
[editar]Las reducciones con hidrosilanos son un subconjunto de hidrogenaciones iónicas. En este tipo de reacción, las carbocaciones se generan por la acción de los ácidos fuertes de Lewis o Brønsted en presencia de hidrosilanos, que luego transfieren hidruro. Un ácido típico es el ácido trifluoroacético (TFA).
La reacción es estequiométrica.
Desoxigenación e hidrogenación iónica
[editar]Los hidrosilanos se usan para la desoxigenación de óxidos de fosfina y sulfóxidos.[5] Los hidrosilanos sirven como donantes de hidruro en algunas hidrogenaciones iónicas.
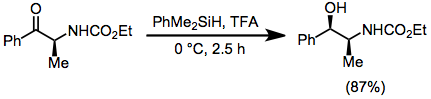
Coordinación de los metales
[editar]Los hidrosilanos forman complejos Sigma con metales insaturados. El enlace es similar al de los complejos de dihidrógeno pero más fuerte. Un ejemplo es (CH3C5H4)Mn(CO)2(H2SIPH2).[6] Dichos aductos representan modelos y competidores con la adición oxidativa del enlace Si-H.
Reducción o adición a sustratos orgánicos
[editar]Es similar a la hidrosililación de alquenos, los hidrosilanos se suman a una variedad de sustratos insaturados.
En un estudio, el trietilsilano se usa en la conversión de una fenilazida a una anilina:[7]
En esta reacción, ACCN es un iniciador radical y un tiol alifático transfiere el carácter radical al sililhidruro. El radical libre del trietilsililo reacciona con la azida con la expulsión de nitrógeno a un radical n-silinarilaminilo que toma un protón de un tiol que completa el ciclo catalítico:
Referencias
[editar]- ↑ Chatgilialoglu, Chryssostomos. (1995). «Structural and Chemical Properties of Silyl Radicals». Chemical Reviews 95 (5): 1229-1251. doi:10.1021/cr00037a005.
- ↑ Jeon, Mina; Han, Junghoon; Park, Jaiwook (2012). «Catalytic Synthesis of Silanols from Hydrosilanes and Applications». ACS Catalysis 2 (8): 1539-1549. doi:10.1021/cs300296x.
- ↑ Chuit, C.; Corriu, R. J. P.; Perz, R.; Reyé, C. Synthesis 1982, 981.
- ↑ Fleck, T. J. «Phenylsilane–Cesium Fluoride». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rp101.
- ↑ Colvin, Ernest W. (1981). «Silanes as Reducing Agents». Silicon in Organic Synthesis. pp. 325-336. ISBN 9780408108317. doi:10.1016/B978-0-408-10831-7.50027-5.
- ↑ McGrady, G. Sean; Sirsch, Peter; Chatterton, Nicholas P.; Ostermann, Andreas; Gatti, Carlo; Altmannshofer, Sandra; Herz, Verena; Eickerling, Georg et al. (2009). «Nature of the Bonding in Metal-Silane σ-Complexes». Inorganic Chemistry 48 (4): 1588-1598. PMID 19146446. S2CID 40616439. doi:10.1021/ic8019777.
- ↑ Benati, Luisa; Bencivenni, Giorgio; Leardini, Rino; Minozzi, Matteo; Nanni, Daniele; Scialpi, Rosanna; Spagnolo, Piero; Zanardi, Giuseppe (2006). «Radical Reduction of Aromatic Azides to Amines with Triethylsilane». J. Org. Chem. 71 (15): 5822-5825. PMID 16839176. doi:10.1021/jo060824k.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Hydrosilanes» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.