Indicador de pH
| Ácidos y Bases | |
|---|---|

| |
| Ácidos y Bases | |
| |
| Tipos de ácidos | |
| Tipos de bases | |
Un indicador de pH, o más correctamente, un indicador ácido-base es una sustancia de origen natural o sintético que muestra colores diferentes dependiendo del pH de las disoluciones en las que se encuentran.[1] [2] El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la sustancia indicadora.[3] Los indicadores ácido-base tienen un intervalo de viraje de, aproximadamente, una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1- 4,4, de color rojo a naranja, y la fenolftaleína, que varía desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados/violetas. Además se pueden usar indicadores caseros como la disolución resultante de hervir con agua col lombarda, pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se obtiene curcumina, y otros (entre los cuales podemos destacar a la col morada y la piel de ciruela, que son usadas por algunas culturas indígenas).
Fundamento
[editar]Muchos compuestos químicos de origen natural o preparados en el laboratorio, presentan la propiedad de cambiar de color en función del pH de las disoluciones en las que se encuentran disueltos, por lo que son conocidos como indicadores de pH, ya que mediante el empleo de uno o varios de ellos es posible medir, de forma aproximada, el pH de las disoluciones. Estas sustancias son, en sí mismas, ácidos o bases débiles, es decir, parcialmente disociados, que dependiendo del grado de disociación muestran un color u otro. Esto ocurre como consecuencia de que la forma ácida presenta un color muy diferente al que le corresponde a su forma conjugada.[4] Considerando un indicador como si de cualquier ácido débil se tratara y llamando HIn a la forma ácida del indicador y In- a la forma conjugada, se puede plantear su equilibrio de disociación como:
Para aquellos casos en que el indicador es una base débil, también es posible definir su correspondiente equilibrio de disociación. Llamando In a la base y InH+ a su ácido conjugado:
Cualquiera de estos equilibrios pueden definirse matemáticamente a través de la constante de disociación ácida, Ka. Considerando el indicador ácido:
y reordenando los términos de la ecuación, queda:

Si la concentración de H3O+ de la disolución en la que se encuentra el indicador, es alta, implica, puesto que Ka es constante, que la concentración de la forma ácida, HIn, será muy superior a la de su base conjugada, In-, por lo que se apreciará el color que le corresponda a la forma ácida. Lo contrario ocurre cuando la concentración de H3O+ es muy baja (pH básico), pues para que se cumpla la ecuación, la concentración de In- tiene que ser mucho mayor que la de HIn . En este caso se apreciará principalmente, el color de la forma básica. En aquellos casos en que [HIn] = [In-] el color que toma la disolución será un color intermedio entre el color de la forma ácida y el de la forma básica. En este caso, implica que
o lo que es lo mismo,
de forma que si se conocen los colores correspondientes a las forma ácida y básica del indicador y su constante de acidez, es posible estimar si el pH de la disolución está por debajo o por encima del pKa, o en sus inmediaciones. La precisión puede mejorarse si se emplean varios indicadores con diferentes constantes de acidez. En algunos casos, los indicadores presentan dos constantes de equilibrio, lo que implica, que según el pH del medio pueden encontrarse en forma ácida, en forma básica o como anfolito o especie intermedia. Cada una de estas formas tienen un color característico y además, el indicador presenta dos intervalos de cambio de color, uno por cada pKa.
Intervalo de viraje
[editar]El intervalo de pH en el que se produce el cambio neto de color color de la forma ácida a la básica, se denomina intervalo de viraje y produce entre dos valores de pH de la disolución, uno máximo y otro mínimo. Cada indicador tiene un intervalo de viraje característico, que está relacionado con su constante de disociación (o pKa) y que suele ser del entorno de dos unidades de pH, una por debajo del pKa y otro por encima. Esto es consecuencia de que el ojo humano no es muy sensible a los cambios de color o a la tonalidad de estos, cuando los colores son muy parecidos, cosa que ocurre a pH próximo al valor del pKa del indicador, cuando en la disolución esta presente una mezcla de HIn e In- en una proporción [HIn] / [In-] mayor de diez o inferior a 0,1. A mayores o menores proporciones el ojo humano promedio es incapaz de detectar pequeños cambios en la tonalidad del color, por lo que da la impresión de que se mantiene constante a la vista, independientemente de la relación entre la forma ácida y la básica.[1]
Matemáticamente, esta situación puede ser expresada como que el indicador exhibe el color ácido cuando
y exhibe el color básico cuando
mientras que el color parece ser intermedio entre estos dos valores.
Sustituyendo estos valores en la ecuación reordenada de la constante de equilibrio, queda:
o tomando logaritmos y cambiando se signo, queda:

o lo que es lo mismo:
En otras palabras, el ojo humano verá claramente el color correspondiente a la forma ácida del indicador, cuando el pH de la disolución sea, al menos una unidad menor que el pKa del indicador. De igual manera, se puede proceder para la forma básica del indicador, obteniendo, en este caso:
en el que se apreciará el color correspondiente a la forma básica del indicador.
En consecuencia, el cambio de color del indicador se produce en un intervalo de pH que es igual a pKa ± 1. Este intervalo de pH en lo que se conoce como intervalo de viraje o intervalo de cambio del indicador y tiene especial relevancia cuando el indicador se utiliza para determinar el punto final de las valoraciones ácido-base. Este intervalo es, por supuesto, una estimación aproximada, siempre que ambos colores sean percibidos por el ojo humano con la misma sensibilidad. Como, en realidad, los colores se basan en una percepción subjetiva del observador y no todos los humanos presentan la misma sensibilidad a los diferentes colores, esta valor de pKa ± 1 es solo una aproximación teórica y no tiene por qué ser simétrico al valor del pKa . [5]
Estructura de los indicadores
[editar]Actualmente se conocen más de doscientas sustancias que pueden actuar como indicadores de pH, tanto en disoluciones acuosas como no acuosas. En disolución acuosa, los más habitualmente pertenecen a alguno de los siguientes grupos:[6]
Colorantes azoicos
[editar]Muchos de los indicadores ácido-base son contienen un grupo azo (-N=N-) y una estructura derivada del azobenceno al que se le introducen diferentes sustituyentes polares, como grupos carboxílicos o sulfónicos, que aumentan su solubilidad en el agua. Estos indicadores son indicadores básicos, ya que el nitrógeno del grupo azo tiene un par de electrones no enlazantes, por lo que actúan como una base de Lewis, pudiendo protonarse en medio ácido, formando un catión cuya carga positiva se encuentra deslocalizada. Típicos indicadores pertenecientes a este grupo son el naranja de metilo y el rojo de metilo.
|
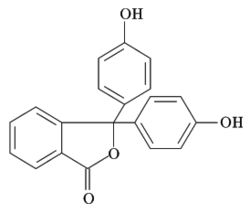
Ftaleinas
[editar]Las ftaleinas son derivados del triarilmetano y se caracterizan por ser de baja solubilidad en agua, pero muy solubles en etanol, por lo que se preparan en este disolvente. La mayoría de los indicadores derivados de las ftaleínas presentan forma ácida incolora y forma básica de colores azulados o violetas; es decir, se trata de indicadores monocromáticos. El indicador de este tipo más conocido y utilizado en el laboratorio químico es la fenolftaleina, que vira de incoloro a violeta a pH superior 8,0 (pKa del indicador; 9,3).
Sulfoftaleinas
[editar]Son indicadores ácido-base relacionado con las ftaleínas, pero cuya estructura contiene, al menos, un anillo aromático con un grupo sulfonato (-SO3-). Son sustancias poco solubles en agua cuando se encuentran en forma protonada, pero sus sales sódicas, por el contrario, son muy solubles, por lo que se preparan en disolución acuosa a pH básico. Presentan color tanto en la forma ácida como en la forma básica. Pertenecen a esta grupo de indicadores de pH el azul de bromotimol y el verde de bromocresol.
|
Véase también
[editar]Referencias
[editar]- ↑ a b Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap. 14A.2 Indicadores ácido/base». Fundamentos de química analítica. Cengage Learning. ISBN 978-607-519-937-6.
- ↑ Fundamentos de la química general e inorgánica, Volumen 1, pag 398
- ↑ Gustavo Gomez Sosa (2010). «Indicadores de pH». p. UNAM.
- ↑ Morcillo, J. (1980). «Cap. 14.5 Concepto y cálculo del pH». Temas básicos de Química. Madrid: Alhambra. pp. 269-270. ISBN 84-205-0382-7.
- ↑ Ayres, Gilbert H. (1974). «Indicadores ácido-base». Análisis químico cuantitativo. Madrid: Alhambra. pp. 323-327. ISBN 84-219-0280-6.
- ↑ Scholz, Fritz; Kahlert, Heike (2019). Chemical equilibria in analytical chemistry: the theory of acid-base, complex, precipitation and redox equilibria (1st ed edición). Springer international publishing. ISBN 978-3-030-17180-3.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre indicadores de pH.
Wikimedia Commons alberga una categoría multimedia sobre indicadores de pH.- Tabla de indicadores de pH Tabla de indicadores de pH con intervalo de viraje y color.



![{\displaystyle K_{a}={\frac {[H_{3}O^{+}][In^{-}]}{[HIn]}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/910640aa3f54763c123edb8c3576c7e4d2b9d7d5)
![{\displaystyle [H_{3}O^{+}]=K_{a}\ {\frac {[HIn]}{[In^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf106b700974cdce47368d868c106b84c644eae1)
![{\displaystyle [H_{3}O^{+}]=K_{a}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0aeb21018e4ffb258dda455f086aa3042839cb81)

![{\displaystyle {\frac {[HIn]}{[In^{-}]}}\geq {\frac {10}{1}}\geq 10}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6b4ed20fdf303c055addacdc21b2b38a6b96a1a)
![{\displaystyle {\frac {[HIn]}{[In^{-}]}}\leq {\frac {1}{10}}\leq 0,1}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6533c0302f6401e3c9e7b1332cd31934e468dff1)
![{\displaystyle [H_{3}O^{+}]=K_{a}\cdot 10}](https://wikimedia.org/api/rest_v1/media/math/render/svg/17c42f630e71428d87e87858815537a9e97e68ba)
![{\displaystyle -log[H_{3}O^{+}]=-logK_{a}-1}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6d33727c878697e26d9391427506427b2cb3e90)





