Inmunodeficiencia combinada grave ligada al cromosoma X
| Inmunodeficiencia combinada grave ligada al cromosoma X | ||
|---|---|---|
 Patrón de herencia recesiva ligada al cromosoma X | ||
| Especialidad | hematología | |
| Sinónimos | ||
| X-SCID del inglés X-linked severe combined immunodeficiency | ||
La inmunodeficiencia combinada grave ligada al cromosoma X (X-SCID) es un trastorno de inmunodeficiencia en el cual el cuerpo produce muy pocas células T y células NK.
En ausencia de ayuda de las células T, las células B se vuelven defectuosas.[1] Es un rasgo de herencia recesiva ligada al cromosoma X, derivado de una versión mutada (anormal) del gen IL2RG ubicado en el cromosoma X. Este gen codifica la IL-2RG (cadena gamma común del receptor de interleucina), que es una subunidad de receptores para IL-2, IL-4, IL-7, IL-9, IL-15 y IL-21.[2][3]
Síntomas y signos
[editar]Las personas con X-SCID a menudo tienen infecciones muy temprano en la vida, antes de los tres meses de edad. Esto ocurre debido a la disminución de los niveles de inmunoglobulina G (IgG) en el lactante durante la etapa de tres meses.[4] Esto es seguido por infecciones virales como neumonitis, una inflamación del pulmón que produce síntomas comunes como tos, fiebre, escalofríos y dificultad para respirar.[5] Un signo revelador de X-SCID es la candidiasis, un tipo de infección por hongos causada por Candida albicans.[6] La candidiasis involucra áreas húmedas del cuerpo como la piel, la boca, el tracto respiratorio y la vagina; los síntomas de la candidiasis oral incluyen dificultad para tragar, dolor al tragar y lesiones orales. Las erupciones recurrentes tipo eccema también son un síntoma común. Otras infecciones comunes experimentadas por individuos con X-SCID incluyen diarrea, sepsis y otitis media.[4] Algunos otros síntomas comunes que experimentan los pacientes con X-SCID incluyen fracaso para prosperar, problemas gastrointestinales, problemas cutáneos y hipotonía muscular.[4]
En algunos pacientes, los síntomas pueden no aparecer durante los primeros seis meses después del nacimiento.[6] Esto es probablemente debido a la inmunidad pasiva recibida de la madre para proteger al bebé de infecciones hasta que el recién nacido sea capaz de producir sus propios anticuerpos.[6] Como resultado, puede haber un período silencioso donde el bebé no muestra síntomas de X-SCID seguido por el desarrollo de infecciones frecuentes.[cita requerida]
Genética
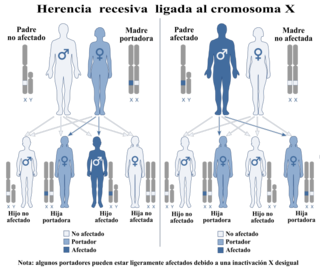
[editar]X-SCID es causado por una mutación que ocurre en el locus xq13.1 del cromosoma X.[7] Con mayor frecuencia, esta enfermedad afecta a los varones cuya madre es portadora (heterocigota) del trastorno. Debido a que las mujeres tienen dos cromosomas X, la madre no se verá afectada por llevar solo un cromosoma X anormal, pero cualquier hijo varón tendrá un 50% de probabilidad de verse afectado por el trastorno al heredar el gen defectuoso. De igual manera, sus hijas tendrán un 50% de probabilidad de ser portadoras de la inmunodeficiencia. X-SCID también puede surgir a través de mutación de novo y puede prevenirse en mujeres mediante inactivación del cromosoma X. En la inactivación del X, la selección preferencial del cromosoma X no mutante durante el desarrollo resulta en el resultado de que ninguna de las células femeninas maduras exprese activamente la mutación X-SCID, permaneciendo inmunológicamente no afectadas y sin carga de portadora. Una mutación de novo es una alteración en un gen causada por el resultado de una mutación en una célula germinal (óvulo o esperma) o en el óvulo fertilizado mismo, en lugar de haber sido heredada de un portador. Dado que solo 1/3 de todos los pacientes con X-SCID tienen un historial familiar positivo de SCID, se hipotetiza que las mutaciones de novo representan un porcentaje significativo de los casos.[8] La inactivación del X ocurre de manera completamente aleatoria, en mujeres, muy temprano en el desarrollo embrionario. Una vez que un X se inactiva, permanece inactivo durante la vida de esa célula y cualquiera de sus células hijas. Es importante notar que la inactivación del X se revierte en las células germinales femeninas, de modo que todos los nuevos ovocitos reciben un X activo. Independientemente de cuál X se inactiva en sus células somáticas, una mujer tendrá un 50% de probabilidad de transmitir la enfermedad a cualquier hijo varón.[9]
Fisiopatología
[editar]Las Interleucinas son producidas por los linfocitos, entre otros tipos de células, y son liberadas en respuesta a estímulos antigénicos y no antigénicos. El gen IL2RG codifica la proteína cadena gamma común, que es una subunidad común de los receptores individuales para Interleucina 2, Interleucina 4, Interleucina 7, Interleucina 9, Interleucina 15 e Interleucina 21.[10] La señalización desde estos receptores promueve normalmente el crecimiento y la diferenciación de células T, células B, células asesinas naturales, células gliales y células de la línea monocítica, dependiendo del tipo de célula y del receptor activado.[11] Los receptores más importantes para X-SCID son los de Interleucina 2, Interleucina 4, Interleucina 7 y Interleucina 15. Específicamente, Interleucina 2 e Interleucina 7 son responsables de la proliferación y supervivencia de las células T.[12] De igual manera, la acción de Interleucina 4 e Interleucina 15 llevará a la proliferación y diferenciación de las células B en células plasmáticas secretoras de anticuerpos.[12] Por último, Interleucina 15 ayuda a generar células asesinas naturales desarrolladas y maduras.[5]
El gen que codifica la cadena gamma común en estos receptores de interleucina está mutado en X-SCID. La mutación conduce a una cadena gamma común ausente o anormalmente funcionante. La mutación puede ocurrir a través de eliminaciones grandes, o incluso de un solo nucleótido, en el gen IL2RG, que deshabilitan la cadena gamma común de modo que no puede unirse con otras subunidades de receptor y señalar la activación de citocinas.[11] Normalmente, cuando la interleucina se une a la proteína del receptor trimérica que contiene las subunidades alfa, beta y gamma, la subunidad gamma común activa la Janus Kinase 3 (JAK3), lo que conduce a la fosforilación de la Proteína Transductora de Señales y Activadora de Transcripción 5, STAT5. Las proteínas STAT5 dimerizan y se translocan al núcleo, controlando la señalización aguas abajo subsiguiente.[1] Debido a que la cadena gamma común está ausente o anormal, esta vía subsiguiente se inhibe. Este cambio evita que los linfocitos T señalicen otras células, como los linfocitos B y las células asesinas naturales. Dado que estas células nunca reciben estas señales, nunca pueden madurar y diferenciarse en células inmunes completamente desarrolladas.[cita requerida]
Diagnóstico
[editar]El diagnóstico de X-SCID es posible mediante recuentos de células linfocíticas, pruebas de función linfocitaria y pruebas genéticas. Un sistema inmunitario sano debería contener grandes cantidades de linfocitos, pero las personas con X-SCID contendrán cantidades inusualmente pequeñas de células T, células B no funcionales y algunas células asesinas naturales.[9]
| Tipo celular | Recuento linfocitario normal (rango) | Recuento medio con X-SCID (rango) | Refs |
|---|---|---|---|
| Linfocitos T | 3,680 (2,500–5,500) | 200 (0-800) | [9] |
| Linfocitos B | 730 (300–2,000) | 1,300 (44 - >3,000) | |
| Linfocitos NK | 420 (170–1,100) | <100 | |
| Total | 0–3 meses: 5,400 (3,400–7,300) | <2,000 |
Las personas con X-SCID a menudo tienen una función linfocitaria disminuida. Esto se puede probar mediante la introducción de agentes en el sistema inmunitario; luego se observa la reacción de los linfocitos. En X-SCID, las respuestas de anticuerpos a las vacunas e infecciones introducidas están ausentes, y las respuestas de las células T a los mitógenos, sustancias que estimulan la transformación linfocítica, son deficientes. Los inmunoglobulinas IgA e IgM, sustancias que ayudan a combatir las infecciones, están muy bajas. [cita requerida]
La ausencia de una sombra tímica en las radiografías de tórax también es indicativa de X-SCID.[9] En un niño normal, se puede ver una sombra distintiva en forma de velero cerca del corazón.[6] La glándula del timo en pacientes normales disminuirá gradualmente de tamaño porque la necesidad de la glándula del timo disminuye. La disminución del tamaño de la glándula del timo ocurre porque el cuerpo ya tiene un número suficiente de células T desarrolladas.[13] Sin embargo, un paciente con X-SCID nacerá con una glándula del timo anormalmente pequeña al nacer.[9] Esto indica que la función de la glándula del timo, de formar células T desarrolladas, ha sido afectada.
Dado que la mutación en X-SCID es ligada al cromosoma X, existen pruebas genéticas para detectar portadores en pedigrís de X-SCID. Un método es buscar mutaciones específicas de la familia en IL2RG. Finalmente, si ninguna de esas opciones está disponible, hay un patrón inusual de inactivación no aleatoria del cromosoma X en los linfocitos de los portadores, por lo que buscar dicha inactivación sería útil.
Si una madre está embarazada y la familia tiene un historial conocido de inmunodeficiencia, entonces los médicos pueden realizar una evaluación diagnóstica in utero. La muestra de vellosidades coriónicas, que implica tomar una muestra del tejido placentario usando un catéter insertado a través del cuello uterino, se puede realizar de 8 a 10 semanas de gestación.[14] Alternativamente, la amniocentesis, que implica extraer una muestra del líquido que rodea al feto, se puede realizar de 15 a 20 semanas de gestación.[14]
La detección temprana de X-SCID (y otros tipos de SCID) también es posible mediante la detección de círculos de excisión de recombinación de células T, o TRECs. Los TRECs están compuestos por fragmentos de ADN excididos que se generan durante el empalme normal de los receptores de antígenos de superficie de células T y la maduración de células T.[15] Este proceso de maduración está ausente en todas las variantes de SCID, como lo demuestran los recuentos bajos de linfocitos T. El ensayo se realiza utilizando sangre seca de una tarjeta Guthrie, de la cual se extrae ADN.[16] Luego se realiza una PCR cuantitativa y se determina el número de TRECs.[17] Las personas que tienen el fenotipo SCID tendrán recuentos de TRECs tan bajos como <30, en comparación con aproximadamente 1020 para un bebé sano.[18] Un recuento bajo de TRECs indica que hay un desarrollo insuficiente de células T en la glándula del timo.[19] Esta técnica puede predecir SCID incluso cuando los recuentos de linfocitos están dentro del rango normal. El tamizaje neonatal de X-SCID basado en el recuento de TRECs en muestras de sangre seca se ha introducido recientemente en varios estados de los Estados Unidos, incluidos California, Colorado, Connecticut, Delaware, Florida, Massachusetts, Michigan, Minnesota, Mississippi, Nueva York, Texas y Wisconsin.[20] Además, se están realizando ensayos piloto en varios otros estados a partir de 2013.[21]
Tratamientos
[editar]El tratamiento para el SCID ligado al cromosoma X se puede dividir en dos grupos principales, el tratamiento profiláctico (es decir, preventivo) y el tratamiento curativo.[22] El primero intenta manejar las infecciones oportunísticas comunes en pacientes con SCID[22] y el último tiene como objetivo reconstituir la función saludable de los linfocitos T.[23]
Desde finales de los años 60 hasta principios de los años 70, los médicos comenzaron a usar "burbujas", que eran recintos de plástico utilizados para albergar a los recién nacidos sospechosos de tener SCID, inmediatamente después del nacimiento.[24] La burbuja, una forma de aislamiento, era un entorno estéril que significaba que el bebé evitaría infecciones causadas por patógenos comunes y letales.[24] Por otro lado, los tratamientos profilácticos utilizados hoy en día para el SCID ligado al cromosoma X son similares a los utilizados para tratar otras inmunodeficiencias primarias.[23] Hay tres tipos de tratamientos profilácticos, a saber, el uso de medicamentos, entornos estériles y terapia con inmunoglobulina intravenosa (IVIG).[23] En primer lugar, se administran antibióticos o antivirales para controlar las infecciones oportunísticas, como fluconazol para la candidiasis y aciclovir para prevenir la infección por herpes virus.[25] Además, el paciente también puede someterse a suplementación con inmunoglobulina intravenosa (IVIG).[26] Aquí, se inserta un catéter en la vena y se inyecta un fluido, que contiene anticuerpos normalmente producidos por células B, en el cuerpo del paciente.[27] Los anticuerpos, proteínas en forma de Y creadas por células plasmáticas, reconocen y neutralizan cualquier patógeno en el cuerpo.[28] Sin embargo, la IVIG es costosa, en términos de tiempo y finanzas.[29] Por lo tanto, los tratamientos mencionados solo previenen las infecciones y de ninguna manera son una cura para el SCID ligado al cromosoma X.[23]
El trasplante de médula ósea (TMO) es un procedimiento curativo estándar y resulta en una reconstitución inmune completa, si el tratamiento es exitoso.[30] En primer lugar, un trasplante de médula ósea requiere una coincidencia de antígenos leucocitarios humanos (HLA) entre el donante y el receptor.[31] El HLA es distinto de persona a persona, lo que significa que el sistema inmunológico utiliza el HLA para distinguir las células propias de las células extrañas.[32] Además, un TMO puede ser alogénico o autólogo, lo que significa que el donante y el receptor de la médula ósea pueden ser dos personas diferentes o la misma persona, respectivamente.[31] El TMO autólogo implica una coincidencia completa de HLA, mientras que el TMO alogénico implica una coincidencia completa o parcial (haploidentical) de HLA.[33] Particularmente, en el TMO alogénico, las posibilidades de que ocurra la enfermedad de injerto contra huésped son altas si la coincidencia entre el donante y el receptor no es lo suficientemente cercana.[32] En este caso, las células T en la médula ósea del donante atacan el cuerpo del paciente porque el cuerpo es ajeno a este injerto.[34] La reducción de células T en el tejido del donante y una coincidencia cercana de HLA reducirán las posibilidades de que ocurra la enfermedad de injerto contra huésped.[35] Además, los pacientes que recibieron una coincidencia exacta de HLA tenían células T funcionales normales en catorce días.[36] Sin embargo, aquellos que recibieron una coincidencia haploidéntica de HLA, sus células T comenzaron a funcionar después de cuatro meses.[36] Además, la razón por la que el TMO es una solución permanente es porque la médula ósea contiene células madre hematopoyéticas multipotentes[30] que se convierten en progenitores linfoides comunes o mieloides comunes.[37] En particular, el progenitor linfoides común da origen a los linfocitos involucrados en la respuesta inmune (células B, células T, células asesinas naturales).[37] Por lo tanto, un TMO resultará en una reconstitución inmune completa, pero hay aspectos del TMO que necesitan ser mejorados (es decir, GvHD).[38]
La terapia génica es otra opción de tratamiento que está disponible solo para ensayos clínicos.[34] El SCID ligado al cromosoma X es un trastorno monogénico, el gen IL2RG está mutado, por lo que la terapia génica reemplazará este gen mutado por uno normal.[39] Esto resultará en una proteína de cadena gamma del receptor de interleucina que funcione normalmente.[35] Para transferir un gen funcional a la célula diana, se pueden emplear vectores virales o no virales.[35] Los vectores virales, como el retrovirus, que incorporan el gen al genoma resultan en efectos a largo plazo.[34] Esto, junto con las células madre de la médula ósea, ha tenido éxito en el tratamiento de individuos con SCID-X.[40] En un ensayo en particular realizado por Cavazzana-Calvo et al., diez niños fueron tratados con terapia génica en la infancia para SCID-X.[41] Nueve de los diez fueron curados de SCID-X.[41] Sin embargo, cerca de tres años después del tratamiento, dos de los niños desarrollaron leucemia de células T debido a la inserción del gen IL2RG cerca del gen LMO2 y activando así el gen LMO2 (un oncogén conocido).[42] Un tercer niño desarrolló leucemia dentro de los dos años siguientes a la publicación de ese estudio, probablemente como resultado directo de la terapia.[43] Esta condición se conoce como mutagénesis insertional, donde la inserción aleatoria de un gen interfiere con el gen supresor de tumores o estimula un oncogén.[34] Actualmente no hay terapia génica aprobada en el mercado, pero hay muchos ensayos clínicos en los que los pacientes con SCID-X pueden inscribirse. Por lo tanto, se necesita investigación en el campo de la terapia génica hoy y en el futuro para evitar la aparición de leucemia.[35] En particular, se justifica la investigación sobre el uso de genes aislantes y suicidas, ya que esto puede evitar que se desarrolle cáncer.[34] El gen aislante inhibe la activación de genes adyacentes. Por otro lado, el gen suicida se estimula cuando comienza a formarse un tumor, y esto resultará en la desactivación del gen terapéutico.[34] Además, se está estudiando el uso de enzimas de restricción como la endonucleasa de dedo de zinc (ZFN).[34] El ZFN permite al investigador elegir el sitio de integración del gen.[34] La seguridad del vector es importante en el campo de la terapia génica, por lo que los vectores que se autoinactivan en el promotor y el potenciador (SIN) y los adenovirus que no crean respuesta inmunitaria son áreas prominentes de investigación para los biólogos de vectores.[34]
Pronóstico
[editar]El SCID ligado al cromosoma X es una emergencia pediátrica conocida que afecta principalmente a los varones.[31] Si no se administra el tratamiento adecuado, como suplementos de inmunoglobulina intravenosa, medicamentos para tratar infecciones o un trasplante de médula ósea, entonces el pronóstico es pobre.[17] Los pacientes con SCID ligado al cromosoma X suelen fallecer dos años después de nacer.[38] Por esta razón, el diagnóstico del SCID ligado al cromosoma X debe realizarse temprano para evitar que cualquier patógeno infecte al lactante.
Sin embargo, los pacientes tienen una mayor probabilidad de supervivencia si el diagnóstico del SCID ligado al cromosoma X se realiza tan pronto como nace el bebé.[17] Esto implica tomar medidas preventivas para evitar cualquier infección que pueda causar la muerte. Por ejemplo, David Vetter tenía una alta probabilidad de tener SCID ligado al cromosoma X porque su hermano mayor había fallecido debido al SCID.[44] Esto permitió que los médicos colocaran a David en la burbuja y evitaran infecciones.[44] Además, si se sabe que el SCID ligado al cromosoma X afecta a un niño, entonces no se deben administrar vacunas vivas y esto puede salvar la vida del lactante. Las vacunas vivas atenuadas, que consisten en patógenos debilitados insertados en el cuerpo para crear una respuesta inmunitaria, pueden provocar la muerte en lactantes con SCID ligado al cromosoma X.[45] Además, con tratamientos adecuados, como un trasplante de médula ósea, el pronóstico es bueno. El trasplante de médula ósea ha tenido éxito en el tratamiento de varios pacientes y ha dado lugar a una completa reconstitución inmunitaria y el paciente puede llevar una vida saludable.[46] Los resultados del trasplante de médula ósea son más exitosos cuando se ha encontrado la coincidencia más cercana del antígeno leucocitario humano.[47] Sin embargo, si no se encuentra una coincidencia cercana, hay posibilidad de que se produzca la enfermedad de injerto contra huésped, lo que significa que la médula ósea del donante ataca al cuerpo del paciente.[35] Por lo tanto, se requiere una coincidencia más exhaustiva para prevenir cualquier complicación.
Epidemiología
[editar]No hay información sobre las tasas de natalidad o ratios de nacimientos, pero "El SCID ligado al cromosoma X es la forma más común de SCID y se estima que representa entre el 46% y el 70% de todos los casos de SCID".[48]
Otras referencias
[editar]- https://web.archive.org/web/20081122091233/http://www.scid.net/about.htm
- Allenspach, Eric; Rawlings, David J.; Scharenberg, Andrew M. (2016). «X-Linked Severe Combined Immunodeficiency». GeneReviews [Internet]. Seattle WA: University of Washington. PMID 20301584. NBK1410. Parámetro desconocido
|veditors=ignorado (ayuda); Parámetro desconocido|orig-year=ignorado (ayuda) - OMIM 308380
- OMIM 300400
Véase también
[editar]Anotaciones y referencias
[editar]- ↑ a b Fisher, A.; Hacein-Bey, S.; Cavazzana-Calvo, M. (August 2002). «Gene therapy of severe combined immunodeficiencies». Nature Reviews Immunology 2 (8): 615-621. PMID 12154380. S2CID 39791932. doi:10.1038/nri859.
- ↑ Buckley, R.H. (2000). «Advances in the Understanding and Treatment of Human Severe Combined Immunodeficiency». Immunologic Research 22 (2–3): 237-251. PMID 11339359. S2CID 36855063. doi:10.1385/ir:22:2-3:237.
- ↑ Puck, J.M.; de Saint Basil, G.; Schwarz, K.; Fugmann, S.; Fischer, R.E. (November 1996). «IL2RGbase: a database of γc-chain defects causing human X-SCID». Immunology Today 17 (11): 507-511. PMID 8961626. doi:10.1016/0167-5699(96)30062-5.
- ↑ a b c Vickers, Peter (2009). Severe Combined Immune Deficiency: Early Hospitalisation and Isolation. Wiley. pp. 29–47. ISBN 978-0-470-31986-4.
- ↑ a b Sponzilli, Ivonne; Notarangelo, Luigi D. (2011). «Severe Combined Immunodeficiency (SCID): from molecular basis to clinical management». Acta Bio-medica: Atenei Parmensis 82 (1): 5-13. PMID 22069950.
- ↑ a b c d Gennery, A.R.; Cant, A.J. (2001). «Diagnosis of severe combined immunodeficiency». Journal of Clinical Pathology 54 (3): 191-5. PMC 1731376. PMID 11253129. doi:10.1136/jcp.54.3.191.
- ↑ Buckley, Rebecca H. (1 de abril de 2004). «Molecular Defects in Human Severe Combined Immunodeficiency and Approaches to Immune Reconstitution». Annual Review of Immunology 22 (1): 625-655. PMID 15032591. doi:10.1146/annurev.immunol.22.012703.104614.
- ↑ Shwartz, R.A. «Pediatric Severe Combined Immunodeficiency». MedScape. Consultado el 18 de enero de 2012.
- ↑ a b c d e GeneReviews, 2016
- ↑ Cavazzana-Calvo, Marina; Fischer, A. (June 2007). «Gene therapy for severe combined immunodeficiency: are we there yet?». The Journal of Clinical Investigation 117 (6): 1456-65. PMC 1878528. PMID 17549248. doi:10.1172/jci30953.
- ↑ a b Spolski, Rosanne; Leonard, Warren J. (1 de abril de 2008). «Interleukin-21: Basic Biology and Implications for Cancer and Autoimmunity*». Annual Review of Immunology 26 (1): 57-79. PMID 17953510. doi:10.1146/annurev.immunol.26.021607.090316.
- ↑ a b Leonard, Warren J. (December 2001). «Cytokines and immunodeficiency diseases». Nature Reviews Immunology 1 (3): 200-8. PMID 11905829. S2CID 5466985. doi:10.1038/35105066.
- ↑ Rehan, Kelly M. «An Overview of the Thymus: The Gland that Protects You Long after It's Gone». EndocrineWeb.
- ↑ a b Fischer, A. (2000). «Severe combined immunodeficiencies». Clinical & Experimental Immunology 122 (2): 143-9. PMC 1905779. PMID 11091267. doi:10.1046/j.1365-2249.2000.01359.x.
- ↑ Puck, Jennifer M. (1 de marzo de 2012). «Tecnología de laboratorio para el tamizaje poblacional de la inmunodeficiencia combinada grave en neonatos: El ganador son los círculos de excisión de receptor de células T». Journal of Allergy and Clinical Immunology 129 (3): 607-616. PMC 3294074. PMID 22285280. doi:10.1016/j.jaci.2012.01.032.
- ↑ Shearer, William T. (1 de marzo de 2012). «Tamizaje para la inmunodeficiencia combinada grave en recién nacidos». Journal of Allergy and Clinical Immunology 129 (3): 619-621. PMID 22277197. doi:10.1016/j.jaci.2011.12.992.
- ↑ a b c Verbsky, James W.; Baker, Mei W.; Grossman, William J.; Hintermeyer, Mary; Dasu, Trivikram; Bonacci, Benedetta; Reddy, Sreelatha; Margolis, David; Casper, James; Gries, Miranda; DeSantes, Ken; Hoffman, Gary L.; Brokopp, Charles D.; Seroogy, Christine M.; Routes, John M. (10 de noviembre de 2011). «Tamizaje neonatal para inmunodeficiencia combinada grave; La experiencia de Wisconsin (2008–2011)». Journal of Clinical Immunology 32 (1): 82-88. PMID 22068910. S2CID 14226544. doi:10.1007/s10875-011-9609-4.
- ↑ Chan, K.; Puck, J. M. (2005). «Desarrollo del tamizaje neonatal basado en la población para inmunodeficiencia combinada grave». Journal of Allergy and Clinical Immunology 115 (2): 391-8. PMID 15696101. doi:10.1016/j.jaci.2004.10.012.
- ↑ Puck, Jennifer M.; Routes, Jack; Filipovich, Alexandra H.; Sullivan, Kate (20 de octubre de 2011). «Comentario de expertos: Problemas prácticos en el tamizaje neonatal para la inmunodeficiencia combinada grave (SCID)». Journal of Clinical Immunology 32 (1): 36-38. PMC 4380147. PMID 22012274. doi:10.1007/s10875-011-9598-3.
- ↑ «Campaña de tamizaje neonatal SCID de IDF». Fundación de Inmunodeficiencia Primaria. Archivado desde el original el 1 de mayo de 2013. Consultado el 28 de mayo de 2024.
- ↑ Wilkerson, Sarah. «Actualizaciones desde Washington – Día 2». Save Babies Through Screening Foundation. Archivado desde el original el 9 de junio de 2017. Consultado el 28 de mayo de 2024.
- ↑ a b Fischer, A. (2000). «Inmunodeficiencias Combinadas Graves (SCID)». Inmunología Clínica y Experimental 122 (2): 143-9. PMC 1905779. PMID 11091267. doi:10.1046/j.1365-2249.2000.01359.x.
- ↑ a b c d Rans, T.S.; England, R. (2009). «La evolución de la terapia génica en la inmunodeficiencia combinada grave ligada al cromosoma X». Anales de Alergia, Asma e Inmunología 102 (5): 357-363. PMID 19492655. doi:10.1016/S1081-1206(10)60504-2.
- ↑ a b Johnston Jr., R.B. (2006). «El Niño en la Burbuja». JAMA: La Revista de la Asociación Médica Estadounidense 296 (4): 453-4. doi:10.1001/jama.296.4.453.
- ↑ Freeman, A. F.; Holland, S. M. (2009). «Profilaxis antimicrobiana para inmunodeficiencias primarias». Opinión Actual en Alergia e Inmunología Clínica 9 (6): 525-530. PMID 19812481. S2CID 205434961. doi:10.1097/ACI.0b013e328332be33.
- ↑ Nolte, M. T.; Pirofsky, B.; Gerritz, G. A.; Golding, B. (1979). «Terapia con inmunoglobulina intravenosa para deficiencia de anticuerpos». Inmunología Clínica y Experimental 36 (2): 237-43. PMC 1537711. PMID 477026.
- ↑ Farrington, E.; Hochwald, C. (1996). «Inmunoglobulina intravenosa». Enfermería Pediátrica 22 (4): 344-7. PMID 8852117.
- ↑ Shishido, S.N.; Varahan, S.; Yuan, K.; Li, X.; Fleming, S. D. (2012). «Respuesta inmune innata humoral y enfermedad». Inmunología Clínica 144 (2): 142-158. PMC 3576926. PMID 22771788. doi:10.1016/j.clim.2012.06.002. hdl:2097/16670.
- ↑ «Terapia con inmunoglobulina I.V. para enfermedades infecciosas». Boletín de Medicamentos y Terapéutica 48 (5): 57-60. 6 de mayo de 2010. PMID 20447982. S2CID 26258054. doi:10.1136/dtb.2009.07.0032.
- ↑ a b Burg, Mirjam; Gennery, Andy R. (9 de abril de 2011). «Documento educativo: El amplio espectro clínico e inmunológico de la inmunodeficiencia combinada grave». European Journal of Pediatrics 170 (5): 561-571. PMC 3078321. PMID 21479529. doi:10.1007/s00431-011-1452-3.
- ↑ a b c Buckley, Rebecca H. (15 de noviembre de 2004). «Las múltiples causas del SCID humano». Journal of Clinical Investigation 114 (10): 1409-11. PMC 525750. PMID 15545990. doi:10.1172/JCI23571.
- ↑ a b Martelli, Massimo F; Aversa, Franco; Bachar-Lustig, Ester; Velardi, Andrea; Reich-Zelicher, Shlomit; Tabilio, Antonio; Gur, Hilit; Reisner, Yair (1 de enero de 2002). «Trasplantes a través de barreras de antígenos leucocitarios humanos». Seminarios en Hematología 39 (1): 48-56. PMID 11799529. doi:10.1053/shem.2002.29255.
- ↑ «Reconstitución inmunológica de células T en el SCID ligado al X después del trasplante materno haploidéntico de médula ósea». Ann. N. Y. Acad. Sci. 770 (1): 376-7. diciembre de 1995. Bibcode:1995NYASA.770..376M. PMID 8597380. S2CID 35195857. doi:10.1111/j.1749-6632.1995.tb31074.x. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b c d e f g h i Kohn, Donald B.; Sadelain, Michel; Glorioso, Joseph C. (1 de julio de 2003). «Ocurrencia de leucemia después de la terapia génica del SCID ligado al X». Revisiones de la Naturaleza del Cáncer 3 (7): 477-488. PMID 12835668. S2CID 62790581. doi:10.1038/nrc1122.
- ↑ a b c d e Rans, Tonya S.; England, Ronald (1 de mayo de 2009). «La evolución de la terapia génica en la inmunodeficiencia combinada grave ligada al X». Anales de Alergia, Asma e Inmunología 102 (5): 357-363. PMID 19492655. doi:10.1016/S1081-1206(10)60504-2.
- ↑ a b Buckley, Rebecca H.; Schiff, Sherrie E.; Schiff, Richard I.; Markert, M. Louise; Williams, Larry W.; Roberts, Joseph L.; Myers, Laurie A.; Ward, Frances E. (18 de febrero de 1999). «Trasplante de células madre hematopoyéticas para el tratamiento de la inmunodeficiencia combinada grave». Nueva Inglaterra Journal of Medicine 340 (7): 508-516. PMID 10021471. doi:10.1056/NEJM199902183400703.
- ↑ a b Kondo, Motonari; Wagers, Amy J.; Manz, Markus G.; Prohaska, Susan M.; Scherer, David C.; Beilhack, Georg F.; Shizuru, Judith A.; Weissman, Irving L. (1 de abril de 2003). «Biología de las células madre hematopoyéticas y progenitores: Implicaciones para la aplicación clínica». Revisión Anual de Inmunología 21 (1): 759-806. PMID 12615892. doi:10.1146/annurev.immunol.21.120601.141007.
- ↑ a b Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasFischer 143–149 - ↑ Buckley, Rebecca H. (15 de noviembre de 2004). «Las múltiples causas del SCID humano». Revista de Investigación Clínica 114 (10): 1409-11. PMC 525750. PMID 15545990. doi:10.1172/JCI23571.
- ↑ «Terapia génica: ¿Es oncogénico el IL2RG en el desarrollo de las células T?: Leucemogenicidad de transgenes de SCID-X (respuesta)». Nature 443 (7109): E6-E7. 21 de septiembre de 2006. Bibcode:2006Natur.443E...6W. PMID 16988660. S2CID 4418027. doi:10.1038/nature05220. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b Cavazzana-Calvo, M. (28 de abril de 2000). «Terapia Génica de la Enfermedad de Inmunodeficiencia Combinada Grave (SCID)-X1 Humana». Ciencia 288 (5466): 669-672. Bibcode:2000Sci...288..669C. PMID 10784449. doi:10.1126/science.288.5466.669.
- ↑ «Perspectivas de Mutagénesis Insertional de la Terapia Génica». Ciencia. 16 de enero de 2004. Archivado desde el original el 7 de enero de 2009. Consultado el 28 de mayo de 2024.
- ↑ «La Terapia Génica para el SCID-X Plantea un Substancial Riesgo de Cáncer». Medical News Today. 30 de abril de 2006. Archivado desde el original el 3 de enero de 2009. Consultado el 28 de mayo de 2024.
- ↑ a b Cossu, Fausto (1 de enero de 2010). «Genética del SCID». Revista Italiana de Pediatría 36 (1): 76. PMC 2999594. PMID 21078154. doi:10.1186/1824-7288-36-76.
- ↑ Nima Rezaei; Asghar Aghamohammadi; Luigi Notarangelo, eds. (2008). Enfermedades de inmunodeficiencia primaria: definición, diagnóstico y manejo. Berlín: Springer. p. 45. ISBN 978-3-540-78537-8.
- ↑ Dvorak, C C; Cowan, M J (29 de octubre de 2007). «Trasplante de células madre hematopoyéticas para enfermedad de inmunodeficiencia primaria». Trasplante de Médula Ósea 41 (2): 119-126. PMID 17968328. S2CID 9424204. doi:10.1038/sj.bmt.1705890.
- ↑ Mikkers, Harald; Pike-Overzet, Karin; Staal, Frank J.T. (8 de febrero de 2012). «Células madre pluripotentes inducidas y deficiencia grave combinada de inmunodeficiencia: ¿simplemente modelado de enfermedades o potencialmente una nueva cura?». Investigación Pediátrica 71 (4–2): 427-432. PMID 22430378. doi:10.1038/pr.2011.65.
- ↑ «Inmunodeficiencia Combinada Severa Ligada al Cromosoma X». GeneReviews. Seattle WA: Universidad de Washington. 1993. PMID 20301584. Parámetro desconocido
|vauthors=ignorado (ayuda); Parámetro desconocido|veditors=ignorado (ayuda)
