Nanocáscara

Una nanocapa, nanocáscara (del inglés: nanoshell), o, más bien, un plasmón de nanocapa, es un tipo de nanopartícula esférica que consta de un núcleo dieléctrico que está cubierto por una fina capa metálica (generalmente de oro).[1] Estas nanocáscaras involucran una cuasipartícula llamada plasmón, que es una excitación colectiva u oscilación de plasma cuántico donde los electrones oscilan simultáneamente con respecto a todos los demás iones.
La oscilación simultánea puede denominarse hibridación de plasmones, donde la sintonizabilidad de la oscilación está asociada con la mezcla de la capa más externa y la capa más externa, donde se hibridan para obtener una energía más baja o más alta. Esta energía más baja se acopla fuertemente con la luz incidente, mientras que la energía más alta es un antienlazante, es decir, que ésta no se vincula con la más baja. También, la energía más alta se combina débilmente con la luz incidente. La interacción de hibridación es más fuerte para las capas más delgadas de la nanocáscara, y, por eso, el grosor de la cáscara y el radio general de la partícula determinan con qué longitud de onda de luz se acopla.[2] Las nanocáscaras varían a través de una amplia gama del espectro electromagnético que se extiende en las regiones visibles e infrarrojas cercanas. La interacción de la luz y las nanopartículas afecta la colocación de cargas, lo que afecta la fuerza de acoplamiento. La luz incidente polarizada paralela al sustrato produce una polarización (s) (véase la Figura 1), por lo que resulta que las cargas están más alejadas de la superficie del sustrato, lo que proporciona una interacción más fuerte entre la cáscara y el núcleo. De lo contrario, se forma una polarización (p) que da una energía de plasmón más fuertemente desplazada, provocando una interacción y un acoplamiento más débiles.
Descubrimiento
[editar]El descubrimiento de la nanocáscara fue realizado por la profesora Naomi J. Halas y su equipo en la Universidad Rice en 2003. Cuando ella y su equipo descubrieron las nanocáscaras, inicialmente no estaban seguros del potencial que tenían las nanocáscaras. En una entrevista con CNN, Halas dijo lo siguiente: «Nosotros dijimos: “Vaya, ¿para qué podría servir?”».
Después de muchas sugerencias acerca de los posibles usos que podrían tener las nanocáscaras, la terapia contra el cáncer surgió de colaboraciones continuas con bioingenieros que buscaban diferentes tipos de aplicaciones biomédicas.[3] «Una de nuestras visiones ––afirmó Halas—, nada menos que en una sola visita el diagnóstico y tratamiento del cáncer». En 2003, Halas fue galardonada con el premio al Mejor Descubrimiento de 2003 por Nanotechnology Now.[4]
Producción
[editar]Un método de última vanguardia para sintetizar nanocáscaras de oro es el uso de Espumas compuestas por Microfluidos. Este método tiene el potencial de reemplazar el método litográfico estándar de síntesis de nanocáscaras plasmónicas. El proceso de producción que se describe a continuación fue un experimento realizado por Suhanya Duraiswamy y Saif A. Khan del Departamento de Ingeniería Química y Biomolecular de Singapur. Aunque este método fue un experimento, representa el futuro de la síntesis de nanocáscaras.
Los materiales requeridos para la producción de las nanocáscaras son los siguientes: Ortosilicato de tetraetilo, hidróxido de amonio, clorhidrato de hidroxilamina, tris de 3-aminopropilo, trihidrato de hidrogenotetracloroaurato (III), cloruro de tetrakis (hidroximetil), fosfonio, hidróxido de sodio, carbonato de potasio, etanol, agua ultrapura y cristalería lavada en agua regia y enjuagada minuciosamente con agua.[5] )
El primer paso en el proceso de sintetizar las nanocáscaras con este método es crear el dispositivo en el que tendrá lugar la reacción. Se fabricaron patrones de dispositivos microfluídicos en obleas de silicio mediante fotolitografía estándar utilizando fotoprotector negativo SU-8 2050. Posteriormente, los dispositivos se moldearon en polidimetilsiloxano (PDMS) utilizando la técnica de litografía blanda. Brevemente, se moldeó el PDMS en los SU-8 a 70 °C durante 4 horas. Fueron pelados, cortados y limpios. Se perforaron orificios de entrada y salida (con 1,59 mm de diámetro exterior) en el dispositivo. Los microcanales se unieron de forma irreversible a un portaobjetos de vidrio recubierto previamente con una fina capa de PDMS después de un breve tratamiento con plasma de aire de 35 s. Los microcanales tienen una sección transversal rectangular y miden 300 µm de ancho, 155 µm de profundidad y 0,45 m de largo.[5]
La producción actual de las nanopartículas implica bombear "aceite de silicona, una mezcla de partículas de sílice con semillas de oro y una solución de enchapado en oro y una solución de agente reductor al dispositivo de microfluidos mientras se suministra gas nitrógeno desde un cilindro".[5] Luego, se dejó envejecer la solución de recubrimiento, en un ambiente controlado, durante más de 24 horas. Después del proceso de envejecimiento, el líquido se recoge del dispositivo de microfluidos y se coloca en una centrífuga. El líquido resultante tiene una capa de aceite en la superficie con una solución debajo que contiene las nanocáscaras.
La razón por la que este método es revolucionario es que el tamaño y el espesor relativo de la nanocáscara de oro se pueden controlar cambiando la cantidad de tiempo que se permite que se lleve a cabo la reacción, así como la concentración de la solución de recubrimiento. Permitiendo así a los investigadores adaptar las partículas a sus necesidades específicas. Aunque sea para óptica o tratamiento contra el cáncer.
Tratamiento para el cáncer
[editar]Las nanopartículas con cubierta de oro, que son nanopartículas esféricas con núcleos de sílice y/o liposomas[6] y cubiertas de oro, se utilizan en la terapia del cáncer y en la mejora de la bioimagen. Las sondas teranósticas, capaces de detectar y tratar el cáncer en un solo tratamiento, son nanopartículas que tienen sitios de unión en su capa que les permiten unirse a una ubicación deseada (típicamente células cancerosas) y luego se pueden obtener imágenes a través de imágenes de modalidad dual (una estrategia de imágenes). que utiliza rayos X e imágenes de radionúclidos ) y mediante fluorescencia en el infrarrojo cercano.[7] La razón por la que se utilizan nanopartículas de oro es por sus vívidas propiedades ópticas que están controladas por su tamaño, geometría y sus plasmones superficiales. Las nanopartículas de oro (como las AuNP) tienen la ventaja de ser biocompatibles y la flexibilidad de tener múltiples moléculas diferentes y materiales fundamentales unidos a su capa (casi cualquier cosa que normalmente se pueda unir al oro se puede unir a la nano-capa de oro). que puede usarse para ayudar a identificar y tratar el cáncer). El tratamiento del cáncer sólo es posible gracias a la dispersión y absorción que se produce en los plasmónicos . Durante la dispersión, las nanopartículas chapadas en oro se vuelven visibles en los procesos de obtención de imágenes que están sintonizados a la longitud de onda correcta, que depende del tamaño y la geometría de las partículas. Durante la absorción se produce la ablación fototérmica, que calienta las nanopartículas y su entorno inmediato a temperaturas capaces de matar las células cancerosas. Esto se logra con un daño mínimo a las células del cuerpo debido a la utilización de la "ventana de agua" (el rango espectral entre 800 y 1300 Nuevo Méjico).[1] Como el cuerpo humano está compuesto principalmente de agua, esto optimiza la luz utilizada frente a los efectos generados.
Estas nanocáscaras de oro se transportan a los tumores mediante el uso de fagocitosis, donde los fagocitos engullen las nanocáscaras a través de la membrana celular para formar un fagosoma interno o macrófago . Después de esto, se transporta a una célula y generalmente se usan enzimas para metabolizarlo y sacarlo de la célula. Estas nanocáscaras no se metabolizan, por lo que para que sean efectivas solo necesitan estar dentro de las células tumorales y se utiliza la muerte celular fotoinducida (como se describió anteriormente) para eliminar las células tumorales. Este esquema se muestra en la Figura 2.
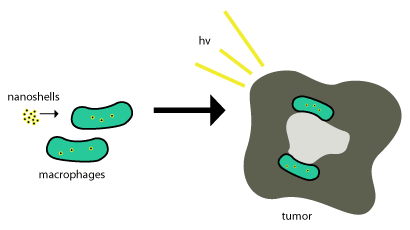
Se han administrado con éxito terapias basadas en nanopartículas en tumores aprovechando el efecto mejorado de permeabilidad y retención, una propiedad que permite que las estructuras a nanoescala se absorban pasivamente en los tumores sin la ayuda de anticuerpos.[4] La entrega de nanocáscaras en regiones importantes de los tumores puede resultar muy difícil. Aquí es donde la mayoría de las nanocáscaras intentan explotar el reclutamiento natural de monocitos del tumor para su administración, como se ve en la figura anterior. Este sistema de entrega se llama "Caballo de Troya".[8]
Este proceso funciona muy bien ya que los tumores son aproximadamente ¾ macrófagos y una vez que los monocitos ingresan al tumor, se diferencian en macrófagos que también serían necesarios para mantener las nanopartículas de carga. Una vez que las nanocáscaras están en el centro necrótico, se utiliza iluminación infrarroja cercana para destruir los macrófagos asociados al tumor.
Además, se puede hacer que estas nanopartículas liberen oligonucleótidos de ADN antisentido cuando están bajo fotoactivación. Estos oligonucleótidos se utilizan junto con los tratamientos de ablación fototérmica para realizar terapia génica. Esto se logra porque los complejos de nanopartículas se administran dentro de las células y luego se someten a una liberación de ADN desde su superficie inducida por la luz. Esto permitirá la manipulación interna de una célula y proporcionará un medio para monitorear el regreso de un grupo de células al equilibrio.[9]
Otro ejemplo de plasmónica de nanocáscaras en el tratamiento del cáncer implica colocar medicamentos dentro de la nanopartícula y utilizarla como vehículo para administrar medicamentos tóxicos únicamente a los sitios cancerosos.[10] Esto se logra recubriendo el exterior de una nanopartícula con óxido de hierro (lo que permite un fácil seguimiento con una máquina de resonancia magnética ), luego, una vez que el área del tumor está recubierta con las nanopartículas llenas de fármaco, las nanopartículas se pueden activar usando ondas de luz resonantes para liberar la droga.
Véase también
[editar] Portal:Ciencia. Contenido relacionado con Tecnología.
Portal:Ciencia. Contenido relacionado con Tecnología.
Referencias
[editar]- ↑ a b Loo, C; Lin, A; Hirsch, L; Lee, Mh; Barton, J; Halas, N; West, J; Drezek, R (Feb 2004). «Nanoshell-enabled photonics-based imaging and therapy of cancer» (Free full text). Technology in Cancer Research & Treatment 3 (1): 33-40. PMID 14750891. doi:10.1177/153303460400300104. Archivado desde el original el 23 de octubre de 2007. Consultado el 6 de agosto de 2009.
- ↑ Brinson, Be; Lassiter, Jb; Levin, Cs; Bardhan, R; Mirin, N; Halas, Nj (Nov 2008). «Nanoshells Made Easy: Improving Au Layer Growth on Nanoparticle Surfaces». Langmuir 24 (24): 14166-14171. PMC 5922771. PMID 19360963. doi:10.1021/la802049p.
- ↑ CNN. "Biography: Naomi Halas." CNN. Cable News Network, 11 Mar. 2008. Web. 7 May 2012. <http://edition.cnn.com/2007/TECH/science/06/11/halas.biog/>.
- ↑ «Nanotechnology Now - Best of Nanotechnology - 2003 Awards. Best Discoveries.». www.nanotech-now.com. Consultado el 25 de agosto de 2023.
- ↑ a b c Duraiswamy, Suhanya; Khan, Saif (23 de agosto de 2010). «Plasmonic Nanoshell Synthesis in Microfluidic Composite Foams». Nano Letters. 9 10 (9): 3757-3763. Bibcode:2010NanoL..10.3757D. PMID 20731386. doi:10.1021/nl102478q.
- ↑ Abbasi, Akram; Park, Keunhan; Bose, Arijit; Bothun, Geoffrey D. (30 de mayo de 2017). «Near-Infrared Responsive Gold–Layersome Nanoshells». Langmuir 33 (21): 5321-5327. ISSN 0743-7463. PMID 28486807. doi:10.1021/acs.langmuir.7b01273.
- ↑ Bardhan, R; Grady, Nk; Halas, Nj (Sep 2008). «Nanoscale Control of Near-Infrared Fluorescence Enhancement Using Au Nanoshells». Nano Micro Small 4 (10): 1716-1722. PMID 18819167. doi:10.1002/smll.200800405.
- ↑ Choi, Mr; Stanton-Maxey, Kj; Stanley, Jk; Levin, Cs; Bardhan, R; Akin, D; Badve, S; Sturgis, J et al. (Dec 2007). «A cellular Trojan Horse for delivery of therapeutic nanoparticles into tumors». Nano Letters 7 (12): 3759-65. Bibcode:2007NanoL...7.3759C. PMID 17979310. doi:10.1021/nl072209h.
- ↑ Bardan, R; Lal, S; Joshi, A; Halas, Nj (May 2011). «Theranostic Nanoshells: From Probe Design to Imaging and Treatment of Cancer». Accounts of Chemical Research 44 (10): 936-946. PMC 3888233. PMID 21612199. doi:10.1021/ar200023x.
- ↑ «Nanoparticles Used To Target Brain Cancer -- ScienceDaily».
