Nitrobenceno
| Nitrobenceno | ||
|---|---|---|
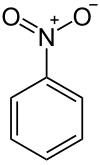 | ||
 Estructura tridimensional. | ||
| Nombre IUPAC | ||
| Nitrobenceno | ||
| General | ||
| Otros nombres | Nitrobenzol, Nitritobenceno, Nitrobencina, Aceite de mirbane o de mirbana[1] | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | C6H5NO2 | |
| Identificadores | ||
| Número CAS | 98-95-3[2] | |
| Número RTECS | DA6475000 | |
| ChEBI | 27798 | |
| ChEMBL | CHEMBL15750 | |
| ChemSpider | 7138 | |
| PubChem | 7416 | |
| KEGG | C06813 | |
| Propiedades físicas | ||
| Apariencia | Líquido amarillento | |
| Densidad | 1199 kg/m³; 1,199 g/cm³ | |
| Masa molar | 1 231 094 g/mol | |
| Punto de fusión | 278,85 K (6 °C) | |
| Punto de ebullición | 484 K (211 °C) | |
| Temperatura crítica | 720 K (447 °C) | |
| Presión crítica | 47,62 atm | |
| Viscosidad | 1.863 mPa-s a 25 °C | |
| Índice de refracción (nD) | 1,5562 | |
| Propiedades químicas | ||
| Acidez | 3,98 pKa | |
| Solubilidad en agua |
1,9 g/l (20 °C) 2,1 g/l (25 °C) | |
| Termoquímica | ||
| ΔfH0gas | 68,53 kJ/mol | |
| ΔfH0líquido | 12,5 kJ/mol | |
| S0líquido, 1 bar | 224,3 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 361 K (88 °C) | |
| NFPA 704 |
2
3
1
| |
| Temperatura de autoignición | 798 K (525 °C) | |
| Frases R | R23/24/25, R40, R48/23/24, R51/53, R62 | |
| Frases S | (S1/2), S28, S36/37, S45, S61 | |
| Riesgos | ||
| Ingestión | Enjuagar la boca, dar a beber una papilla de carbón activado en agua, reposo, asistencia médica. | |
| Inhalación | Dolor de cabeza, labios o uñas azulados, piel azulada, vértigo, náuseas, debilidad, confusión mental, convulsiones, pérdida del conocimiento. Dar aire, reposo, respiración artificial de ser necesaria, asistencia médica. | |
| Piel | Puede absorberse. Quitar ropas contaminadas, lavar con agua y jabón, asistencia médica. | |
| Ojos | Enjuagar con abundante agua, asistencia médica. | |
| LD50 |
640 mg/kg (oral, ratas) 2100 mg/kg (dermal, ratas) | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Anilina Cloruro de bencenodiazonio Nitrosobenceno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nitrobenceno es un compuesto químico con la fórmula C6H5NO2. Es un líquido aceitoso tóxico, ligeramente amarillento con un cierto olor a almendras. Se congela para dar cristales verdoso-amarillos. Es producido a gran escala como un precursor de la anilina. Aunque es ocasionalmente utilizado como un saborizante o aditivo de perfumes, el nitrobenceno es altamente tóxico en grandes cantidades. En el laboratorio, es en ocasiones usado como disolvente, especialmente para reactivos electrofílicos.
Síntesis
[editar]El nitrobenceno se obtiene por la nitración del benceno con una mezcla de agua, ácido nítrico y ácido sulfúrico concentrados, denominada "mezcla sulfonítrica" o simplemente "mezcla ácida". La producción del nitrobenceno es uno de los procesos más peligrosos realizados en la industria química debido a gran exotermicidad de la reacción (ΔH = −117 kJ/mol).[3]
La capacidad mundial para la producción de nitrobenceno en 1985 era alrededor de 1.7×106 toneladas.[3]
Mecanismo de nitración
[editar]El camino de reacción implica la formación de un aducto entre el ion nitronio como ácido de Lewis (NO2+) y benceno. El ion nitronio es generado in situ por la reacción del ácido nítrico y un agente deshidratante ácido, típicamente ácido sulfúrico:
- HNO3 + H+
 NO2+ + H2O
NO2+ + H2O
Reacciones
[editar]Con reductores fuertes como el hidrógeno en estatus naciendi (a la hora de formarse) el nitrobenceno es reducido a la anilina. La reducción del nitrobenceno con hierro y ácido clorhídrico era el método más utilizado para obtener esta amina aromática. Aparte de su conversión a anilina, el nitrobenceno se convierte fácilmente en derivados como el azobenceno,[4] nitrosobenceno,[5] y fenilhidroxilamina.[6]
En reacciones de sustitución electrofílica sobre el sistema aromático el grupo nitro baja la reactividad (es un desactivador) y dirige el grupo entrante en posición meta.
Aplicaciones
[editar]Aproximadamente el 95% del nitrobenceno se utiliza para la producción de anilina,[3] la cual es precursora del caucho sintético y en la elaboración de pesticidas , colorantes, explosivos y productos farmacéuticos.
Aplicaciones especializadas
[editar]El nitrobenceno es un compuesto de partida importante en la síntesis de diversos productos orgánicos, y aparte de la anilina, para sintetizar la benzidina, el trinitrobenceno, el ácido nitrobenzolsulfónico, la fucsina, la quinolina o fármacos como el acetoaminofeno.
A veces se utiliza también como disolvente, por ejemplo de pinturas y otros materiales para enmascarar olores no placenteros, como componente de lubricantes o como aditivo en explosivos. También en pulidores de zapatos y pisos, vendajes de piel,
Antiguamente se utilizaba también redestilado con el nombre de "Aceite de mirbana"[1] en formulaciones de perfumes baratos para jabones. Hoy estas aplicaciones están prohibidas debido a la elevada toxicidad y el peligro que supone para el medio ambiente.
Un significativo mercado comercial para el nitrobenceno es su uso en la producción del analgésico paracetamol (también conocido como acetaminofén) (Mannsville 1991).[7] El nitrobenceno es usado también en celdas de Kerr, debido a que tiene una inusualmente grande constante de Kerr.
Bioquímica y toxicología
[editar]El nitrobenceno es altamente tóxico (umbral límite 5 mg/m³) y puede ser fácilmente absorbido a través de la piel, los pulmones o tras ingestión por el intestino. En el cuerpo provoca graves intoxicaciones. En primera instancia reacciona con la hemoglobina de la sangre formando metahemoglobina. Además provoca graves daños en el sistema nervioso central. Síntomas son debilidad, dolor de cabeza, calambres, vómitos y pérdida de conciencia. Una intoxicación grave puede provocar la muerte en cuestión de horas. El efecto tóxico se ve refortalecido por el alcohol.
El nitrobenceno es considerado como un carcinógeno por la Agencia de Protección Ambiental de los Estados Unidos,[8] y es clasificado por la International Agency for Research on Cancer (Agencia Internacional para la Investigación del Cáncer) en el Grupo 2B, como "posible carcinógeno para los humanos".[9] Se ha mostrado que causa adenomas y carcinomas en el hígado, riñón, y tiroides en ratas.[10]
Véase también
[editar]Referencias
[editar]- ↑ a b «Ficha de seguridad en winklerltda.com» (PDF). Consultado el 28 de enero de 2012.
- ↑ Número CAS
- ↑ a b c Gerald Booth (2007). "Nitro Compounds, Aromatic". In: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York. doi 10.1002/14356007.a17_411
- ↑ Bigelow, H. E.; Robinson, D. B. (1955). "Azobenzene". Org. Synth.; Coll. Vol. 3: 103.
- ↑ G. H. Coleman, C. M. McCloskey, F. A. Stuart. "Nitrosobenzene". Org. Synth.; Coll. Vol. 3: 668.
- ↑ O. Kamm. "β-Phenylhydroxylamine". Org. Synth.; Coll. Vol. 1: 445.
- ↑ Bhattacharya A.; Purohit V. C.; Suarez, V.; Tichkule, R; Parmer, G.; Rinaldi, F. (2006). «One-step reductive amidation of nitro arenes: application in the synthesis of Acetaminophen». Tetrahedron Letters 47 (11): 1861-1864. doi:10.1016/j.tetlet.2005.09.196.
- ↑ http://cfpub.epa.gov/ncea/iris/index.cfm?fuseaction=iris.showQuickView&substance_nmbr=0079
- ↑ Agents Classified by the IARC Monographs Archivado el 25 de octubre de 2011 en Wayback Machine., International Agency for Research on Cancer
- ↑ National Institutes of Health · U.S. Department of Health and Human Services, Nomination: Nitrobenzene Review committee, 02/02/2010
Enlaces externos
[editar]- «ATSDR - ToxFAQs™: nitrobenceno». Consultado el 28 de enero de 2012.
- (en inglés) Nitrobenceno en toxnet.nlm.nih.gov Consultado el 28 de enero de 2012.
- «Libro del Web de Química del NIST». Consultado el 28 de enero de 2012.
- «Ficha de seguridad del INSHT» (PDF). Archivado desde el original el 7 de septiembre de 2012. Consultado el 28 de enero de 2012.
- «Monografía IARC: "Nitrobenzene"» (PDF) (en inglés). Consultado el 28 de enero de 2012.
- «US EPA factsheet» (PDF) (en inglés). Consultado el 28 de enero de 2012.


