Proteína integral de membrana
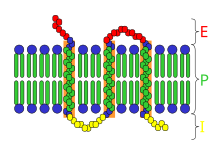
Una proteína integral de membrana, proteína intrínseca de membrana o proteína transmembranal es aquella que se halla embebida o atravesada en la bicapa lipídica, y por tanto su separación implica la destrucción de la estructura de membrana. Es necesario para ello el uso de detergentes iónicos fuertes como el SDS o no iónicos como Tritón X-100; o disolventes apolares. El concepto de proteína integral es opuesto al de proteína periférica, que se adhiere externamente y de forma débil a la membrana y se puede separar sin alterar la bicapa simplemente aplicando alta concentración de una sal. Las proteínas integrales poseen múltiples funciones en la célula, ya que pueden actuar como canales y transportadores para el paso de moléculas, y cumplir funciones enzimáticas en membrana y de adhesión y señalización celular. Según la forma de unión se pueden clasificar en varios tipos:
- Proteínas integrales transmembrana
- Proteínas integrales no transmembrana
- Integrales unidas a GPI
- Integrales no transmembrana preniladas
- Integrales no transmembrana aciladas
- Integral unida mediante una embebida en monocapa
Tipos de proteínas integrales
[editar]Proteínas integrales transmembrana
[editar]Se distingue de otros tipos de proteínas integrales de membrana en que atraviesa la bicapa de parte a parte, y por tanto además del dominio transmembrana a partir del cual se une mediante fuerzas hidrófobas al interior de la bicapa lipídica, posee un dominio en el citosol y otro en el exterior. Un ejemplo es la glucoforina del eritrocito.
Proteínas integrales no transmembrana
[editar]Integrales unidas a GPI
[editar]Las proteínas integrales no transversales del dominio extracitosólico presentan una unión covalente al fosfolípido Glucosil fosfatidil inositol (GPI). Como no hay glucolípidos en la cara citosólica, obligadamente estas proteínas están presentes hacia el exterior. Mediante fosfolipasa C se puede establecer un corte hidrolítico entre el grupo fosfato e inositol, de manera que en la bicapa se mantiene el fosfatidil restante, mientras que la proteína se desliga de la membrana y se solubiliza. Sirve como ejemplo la fosfatasa alcalina.
Integrales no transmembrana preniladas
[editar]Son proteínas integrales no transmembrana de la cara citosólica unidas covalentemente a un grupo prenílico derivado de isopreno como farnesil (con cadena carbonada de 15 carbonos) o geranil (con cadena carbonada de 20 carbonos). Se unen a través de un enlace tioéter entre el grupo –SH de una cisteína de la proteína integral y el –OH del grupo prenílico. Se pueden ver ejemplos en las proteínas Ras y proteínas G triméricas implicadas en la transducción de señales química.
Integrales no transmembrana aciladas
[editar]Son semejantes a las anteriores, con la diferencia de que estas se unen covalentemente a un ácido graso que está incluido como tal en la bicapa lipídica sin formar parte estructural de fosfolípidos y glucolípidos. En unos casos se trata de miristato (con cadena carbonada de 14 carbonos), lo que produce proteínas miristoiladas; y en otros de palmitato (con cadena carbonada de 16 carbonos) lo que genera proteínas palmitoiladas. Hay distintos tipos de unión, en unos casos se trata de una unión amida entre el grupo carboxilo del ácido graso y el grupo amino terminal de la proteína y en otros de una unión tioéster entre el grupo carboxilo del ácido graso y un sulfidrilo, -SH, de una cisteína de la proteína. Ni en este tipo de proteínas ni en el anterior, las proteínas son solubilizables por fosfolipasa C. olp
Integral unida mediante una α-hélice embebida en bicapa
[editar]Se dan casos especiales, en los que una proteína se inserta en la capa citosólica de la bicapa lipídica mediante una α-hélice anfipática. Esta α-hélice es paralela a la bicapa, y no perpendicular como en el caso de las α-hélice de las proteínas transmembrana. La parte hidrofóbica interacciona con el núcleo de la bicapa, y una parte hidrofílica contacta con el citosol. El resto de la proteína se halla expuesta hacia el citosol.
Otras clasificaciones
[editar]Aunque los distintos tipos de proteínas están bien caracterizados, en algunos casos no se sigue la clasificación anterior. Por ejemplo, otros autores consideran proteínas integrales únicamente a las transmembrana, y el resto lo consideran proteínas ancladas a lípidos.[1] En otras clasificaciones se considera el grupo anclado a lípidos como proteínas periféricas, lo que implica un cambio del concepto de proteína integral y periférica. [cita requerida]
Referencias
[editar]- ↑ Lodish et al. Biología celular y molecular, pág 157, 4ª edición, Ed. Médica Panamericana
Bibliografía
[editar]- Alberts et al (2004). Biología molecular de la célula. Barcelona: Omega. ISBN 54-282-1351-8.
- Lodish et al. (2005). Biología celular y molecular. Buenos Aires: Médica Panamericana. ISBN 950-06-1974-3.
- Cooper (2ª Ed.). La célula. Marbán.
- Eckert (4ª Ed.). Fisiología Animal: Mecanismos y adaptaciones. McGraw-Hill Interamericana.
