Sulfuro de litio
Apariencia
| Sulfuro de litio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Sulfuro de litio | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | Li2S | |
| Identificadores | ||
| Número CAS | 12136-58-2[1] | |
| Número RTECS | OJ6439500 | |
| ChemSpider | 8466196 | |
| PubChem | 10290727 | |
| UNII | SW6C51V9JZ | |
|
[Li+].[Li+].[S-2]
[Li+].[Li+].[S-2] | ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1660 kg/m³; 1,66 g/cm³ | |
| Masa molar | 45,95 g/mol | |
| Punto de fusión | 1211 K (938 °C) | |
| Punto de ebullición | 1645 K (1372 °C) | |
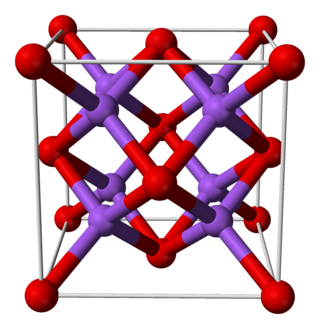
| Estructura cristalina | Fluorita | |
| Propiedades químicas | ||
| Solubilidad en agua | muy soluble | |
| Solubilidad | muy soluble en etanol | |
| Peligrosidad | ||
| NFPA 704 |
1
3
1
| |
| Riesgos | ||
| LD50 | 240 mg/kg (oral, ratas)[2] | |
| Compuestos relacionados | ||
| Otros aniones | Óxido de litio | |
| Otros cationes |
Sulfuro de sodio Sulfuro de potasio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El sulfuro de litio es un compuesto inorgánico cuya fórmula es Li2S. Se cristaliza en el motivo antifluorita, descripto como la sal (Li+)2S2−. Forma un polvo sólido amarillento deliquescente. En presencia de aire, se hidroliza fácilmente para desprender ácido sulfhídrico (olor a huevo podrido).[3]
Preparación[editar]
El sulfuro de litio se obtiene mediante la reacción del litio con el azufre, la cual se lleva a cabo convenientemente en amoníaco anhidro.[4][5]
- 2 Li + S → Li2S
El aducto trietilborano del sulfuro de litio puede obtenerse usando superhidruro.[6]
Aplicaciones[editar]
El sulfuro de litio se ha considerado para ser utilizado en baterías de litio-sulfuro.[7]
Referencias[editar]
- ↑ Número CAS
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/rn/12136-58-2
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ «Webelements – Lithium Sulfide». Consultado el 16 de septiembre de 2005.
- ↑ Rankin, D. W. H. (1974). «Digermanyl Sulfide». Inorg. Synth. 15: 182-84. ISBN 978-0-470-13246-3. doi:10.1002/9780470132463.ch40.
- ↑ Gladysz, J. A.; Wong, V. K. and Jick, B. G., "Reduction of S-S Bonds with LiBHEt3", Tetrahedron, 1979, 35, 2329.
- ↑ «Battery claims greater capacity than lithium ion». Electronics Weekly. Consultado el 16 de septiembre de 2005.

