Transposición de Meyer–Schuster
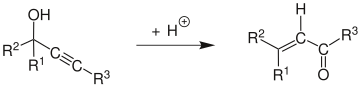
La transposición de Meyer-Schuster es una reacción química orgánica descrita como la transposición catalizada por un ácido de alcoholes propargílicos secundarios y terciarios a cetonas α, β-insaturadas cuando el alquino sea interno ,y aldehídos α, β-insaturados si el alquino es terminal. Swaminathan y Narayan, Vartanyan y Banbanyan, y Engel y Dudley han publicado revisiones, la última de las cuales describe formas de promover la transposición de Meyer-Schuster sobre otras reacciones disponibles para los alcoholes propargílicos.[1][2][3]
La condensación catalizada por bases se denomina reacción de Favorskii.
Mecanismo
[editar]
El mecanismo de reacción[4] comienza con la protonación del alcohol que sale en una reacción E1 para formar el aleno a partir del alquino. El ataque de una molécula de agua sobre el carbocatión y la desprotonación va seguido de tautomerización para dar el compuesto carbonilo α, β-insaturado.
Edens Et al. ha investigado el mecanismo de reacción.[5] Descubrieron que se caracterizaba por tres pasos principales: (1) la protonación rápida de oxígeno, (2) el paso lento que determina la velocidad que comprende el desplazamiento 1,3 del grupo hidroxi protonado y (3) el ceto-enol tautomería seguida de una rápida desprotonación.
En un estudio del paso limitante de la velocidad de la reacción de Meyer-Schuster, Andres et al. demostró que la fuerza impulsora de la reacción es la formación irreversible de compuestos carbonílicos insaturados a través de iones carbonio.[6] También encontraron que la reacción era asistida por el solvente. Esto fue investigado más a fondo por Tapia et al. que mostró un clatrato de disolvente estabiliza el estado de transición.[7]
Transposición de Rupe
[editar]La reacción de alcoholes terciarios que contienen un grupo α-acetilénico no produce los aldehídos esperados, sino metilcetonas α, β-insaturadas a través de un intermedio enino.[8][9] Esta reacción alternativa se llama reacción de Rupe y compite con la transposición de Meyer-Schuster en el caso de los alcoholes terciarios..


Uso de catalizadores
[editar]Mientras que el reordenamiento tradicional de Meyer-Schuster usa condiciones severas con un ácido fuerte como catalizador, esto introduce competencia con la reacción de Rupe si el alcohol es terciario.[1] Las condiciones más suaves han sido utilizadas exitosamente con metal de transición-basado y catalizadores de ácido del Lewis (por ejemplo, Ru- y Ag-basó catalizadores).[10][11] Se han utilizado con éxito condiciones más suaves con catalizadores ácidos de Lewis y basados en metales de transición (por ejemplo, catalizadores basados en Ru y Ag). Cadierno y colaboradores informaron del uso de radiación de microondas con InCl como catalizador para dar excelentes rendimientos con tiempos de reacción cortos y estereoselectividad notable.[12] Un ejemplo de su publicación se muestra a continuación:

Aplicaciones
[editar]La transposición de Meyer-Schuster se ha utilizado en una variedad de aplicaciones, desde la conversión de lactamas ω-alquinil-ω-carbinol en enamidas utilizando PTSA catalítico hasta la síntesis de tioésteres α, β-insaturados de alcoholes propargílicos γ-azufrados sustituidos reordenamiento de 3-alquinil-3-hidroxil-1H-isoindoles en condiciones ligeramente ácidas para dar los compuestos de carbonilo α, β-insaturados.[13][14][15] Una de las aplicaciones más interesantes, sin embargo, es la síntesis de una parte de paclitaxel en una forma diastereoméricamente selectiva que conduce solo al E-alqueno.[16]

El paso que se muestra arriba tuvo un rendimiento del 70% (91% cuando el subproducto se convirtió en el producto Meyer-Schuster en otro paso). Los autores utilizaron el reordenamiento de Meyer-Schuster porque querían convertir una cetona impedida en un alqueno sin destruir el resto de su molécula.
Referencias
[editar]- ↑ a b Swaminathan, S.; Narayan, K. V. "The Rupe and Meyer-Schuster Rearrangements" Chem. Rev. 1971, 71, 429–438. (Review)
- ↑ Vartanyan, S. A.; Banbanyan, S. O. Russ. Chem. Rev. 1967, 36, 670. (Review)
- ↑ Engel, D.A.; Dudley, G.B. Organic and Biomolecular Chemistry 2009, 7, 4149–4158. (Review)
- ↑ Li, J.J. In Meyer-Schuster rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 380–381.(doi 10.1007/978-3-642-01053-8_159)
- ↑ Edens, M.; Boerner, D.; Chase, C. R.; Nass, D.; Schiavelli, M. D. J. Org. Chem. 1977, 42, 3403–3408. (doi 10.1021/jo00441a017)
- ↑ Andres, J.; Cardenas, R.; Silla, E.; Tapia, O. J. Am. Chem. Soc. 1988, 110, 666–674. (doi 10.1021/ja00211a002)
- ↑ Tapia, O.; Lluch, J.M.; Cardena, R.; Andres, J. J. Am. Chem. Soc. 1989, 111, 829–835. (doi 10.1021/ja00185a007)
- ↑ Rupe, H.; Kambli, E. Helv. Chim. Acta 1926, 9, 672. (doi 10.1002/hlca.19260090185)
- ↑ Li, J.J. In Rupe rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 513–514.(doi 10.1007/978-3-642-01053-8_224)
- ↑ Cadierno, V.; Crochet, P.; Gimeno, J. Synlett 2008, 1105–1124. (doi 10.1055/s-2008-1072593)
- ↑ Sugawara, Y.; Yamada, W.; Yoshida, S.; Ikeno, T.; Yamada, T. J. Am. Chem. Soc. 2007, 129, 12902-12903. (doi 10.1021/ja074350y)
- ↑ Cadierno, V.; Francos, J.; Gimeno, J. Tetrahedron Lett. 2009, 50, 4773–4776.(doi 10.1016/j.tetlet.2009.06.040)
- ↑ Chihab-Eddine, A.; Daich, A.; Jilale, A.; Decroix, B. J. Heterocycl. Chem. 2000, 37, 1543–1548.(doi 10.1002/jhet.5570370622)
- ↑ Yoshimatsu, M.; Naito, M.; Kawahigashi, M.; Shimizu, H.; Kataoka, T. J. Org. Chem. 1995, 60, 4798–4802.(doi 10.1021/jo00120a024)
- ↑ Omar, E.A.; Tu, C.; Wigal, C.T.; Braun, L.L. J. Heterocycl. Chem. 1992, 29, 947–951.(doi 10.1002/jhet.5570290445)
- ↑ Crich, D.; Natarajan, S.; Crich, J.Z. Tetrahedron 1997, 53, 7139–7158.(doi 10.1016/S0040-4020(97)00411-0)
