Allopumiliotoxin 267A
| Allopumiliotoxin 267A | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (7R,8R,8aS)-8-Methyl-6-[(2R)-2-methylhexylidene]-1,2,3,5,7,8a-hexahydroindolizine-7,8-diol | ||
| General | ||
| Fórmula estructural |
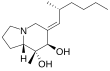 | |
| Fórmula molecular |
H 29NO 2 | |
| Identificadores | ||
| Número CAS | 73376-38-2[1] | |
| ChEBI | 182171 | |
| ChEMBL | CHEMBL2002405 | |
| ChemSpider | 4580699 | |
| PubChem | 5470308 | |
|
O[C@@H]1C(=C\[C@H](C)CCCC)\CN2[C@H]([C@]1(O)C)CCC2
| ||
| Propiedades físicas | ||
| Masa molar | 267,41 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Allopumiliotoxin 267A es una toxina que se encuentra en la piel de varias ranas venenosas de la familia Dendrobates.[2] Es un miembro de la clase de compuestos conocidos como allopumiliotoxinas . Las ranas producen la toxina mediante la modificación de la versión original, pumiliotoxin 251D.[3] Se ha probado en ratones y comprobado que es cinco veces más potente que la versión anterior. Se ha producido sintéticamente a través de una variedad de rutas diferentes.[4][5][6][7]
Referencias[editar]
- ↑ Número CAS
- ↑ Edwards MW, Daly JW, Myers CW. Alkaloids from a panamanian poison frog, Dendrobates speciosus: identification of pumiliotoxin-A and allopumiliotoxin class alkaloids, 3,5-disubstituted indolizidines, 5-substituted 8-methylindolizidines, and a 2-methyl-6-nonyl-4-hydroxypiperidine. Journal of Natural Products. 1988 Nov-Dec;51(6):1188-97. PMID 3236011
- ↑ Daly JW, Garraffo HM, Spande TF, Clark VC, Ma J, Ziffer H, Cover JF Jr. Evidence for an enantioselective pumiliotoxin 7-hydroxylase in dendrobatid poison frogs of the genus Dendrobates. Proceedings of the National Academy of Sciences USA. 2003 Sep 16;100(19):11092-7. PMID 12960405
- ↑ Comins DL, Huang S, McArdle CL, Ingalls CL. Enantiopure 2,3-dihydro-4-pyridones as synthetic intermediates: a concise asymmetric synthesis of (+)-allopumiliotoxin 267A. Organic Letters. 2001 Feb 8;3(3):469-71. PMID 11428041
- ↑ Franklin AS, Overman LE. Total Syntheses of Pumiliotoxin A and Allopumiliotoxin Alkaloids. Interplay of Pharmacologically Active Natural Products and New Synthetic Methods and Strategies. Chemical Reviews 1996;96(1),505-522.
- ↑ Tang XQ, Montgomery J. Nickel-Catalyzed Preparation of Bicyclic Heterocycles: Total Synthesis of (+)-Allopumiliotoxin 267A, (+)-Allopumiliotoxin 339A, and (+)-Allopumiliotoxin 339B. Journal Of The American Chemical Society. 2000;122(29):6950-6954.
- ↑ Aoyagi S, Wang TC, Kibayashi C. Highly stereoselective total syntheses of (+)-allopumiliotoxins 267A and 339A via intramolecular nickel(II)/chromium(II)-mediated cyclization. Journal of the American Chemical Society 1993;115(24):11393-11409.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Allopumiliotoxin 267A» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
