Bedaquilina
| Bedaquilina | ||
|---|---|---|
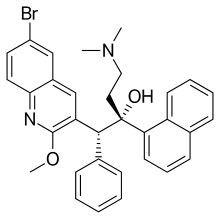 | ||
| Identificadores | ||
| Número CAS | 843663-66-1 | |
| PubChem | 5388906 | |
| ChemSpider | 4534966 | |
| UNII | 78846I289Y | |
| KEGG | D09872 | |
| ChEBI | 72292 | |
| ChEMBL | 376488 | |
| Datos químicos | ||
| Fórmula | C32H31N2BrO2 | |
|
InChI=1S/C32H31BrN2O2/c1-35(2)19-18-32(36,28-15-9-13-22-10-7-8-14-26(22)28)30(23-11-5-4-6-12-23)27-21-24-20-25(33)16-17-29(24)34-31(27)37-3/h4-17,20-21,30,36H,18-19H2,1-3H3/t30-,32-/m1/s1
Key: QUIJNHUBAXPXFS-XLJNKUFUSA-N | ||
Bedaquilina, comercializado bajo la marca Sirturo, es un medicamento que se usa para tratar la tuberculosis activa.[1] Se usa específicamente para tratar la tuberculosis multirresistente (TB-MR) cuando no se puede usar otro tratamiento.[1][2] Debe usarse junto con al menos otros tres medicamentos para la tuberculosis.[1][2] Se administra por vía oral.[2]
Los efectos secundarios comunes incluyen náuseas, dolores en las articulaciones, dolores de cabeza y dolor en el pecho.[1] Los efectos secundarios graves incluyen prolongación del intervalo QT, disfunción hepática y un mayor riesgo de muerte.[1] Si bien no se ha encontrado daño durante el embarazo, no se ha estudiado bien en esta población.[3] Está en la clase de medicamentos antimicobacterianos de la diarilquinolina.[1] Funciona a través del bloqueo de la capacidad de M. tuberculosis para producir adenosina 5'-trifosfato (ATP).[1]
Bedaquilina fue aprobado para uso médico en los Estados Unidos en 2012.[1] Está en la lista de medicamentos esenciales de la Organización Mundial de la Salud, los medicamentos más efectivos y seguros que se necesitan en un sistema de salud.[4] El costo por seis meses de tratamiento en 2015, era de aproximadamente 900 dólares estadounidenses (USD) en países de bajos ingresos, 3.000 USD en países de ingresos medios y 30.000 USD en países de altos ingresos.[2]
Usos médicos[editar]
Su uso fue aprobado formalmente (diciembre de 2012) por la Agencia de Alimentos y Medicamentos de los Estados Unidos (FDA) para su uso en el tratamiento de la tuberculosis (TB), como parte de una aprobación acelerada de Vía Rápida, para uso solo en casos de tuberculosis multirresistente, y tuberculosiscon amplia resistencia a medicamentos.[5]
Para 2013, tanto la Organización Mundial de la Salud (OMS) como los Centros para el Control de Enfermedades (CDC) de los EE.UU. han recomendado, provisionalmente, que la bedaquilina se reserve para pacientes con tuberculosis multirresistente cuando no se puede diseñar un régimen recomendado.[6][7]
Ensayos clínicos[editar]
Bedaquilina se ha estudiado en ensayos clínicos de fase IIb para el tratamiento de la tuberculosis multirresistente, mientras que los ensayos de fase III están actualmente en curso.[8] Se ha demostrado que mejora las tasas de curación de la tuberculosis multirresistente con baciloscopía positiva, aunque con cierta preocupación por el aumento de las tasas de muerte (más detallado en la sección Efectos adversos).[9] Pequeños estudios también han examinado su uso como terapia de rescate para infecciones micobacterianas no tuberculosas.[8]
Es un componente del tratamiento experimental de combinación BPaMZ (bedaquilina + pretomanida + moxifloxacino + pirazinamida).[10][11]
Efectos secundarios[editar]
Los efectos secundarios más comunes de la bedaquilina en los estudios fueron náuseas, dolor en articulaciones y el pecho, y dolor de cabeza. El medicamento también tiene una advertencia de recuadro negro por un mayor riesgo de muerte y arritmias, ya que puede prolongar el intervalo QT al bloquear el canal hERG.[12] Todos los pacientes que reciben bedaquilina deben someterse a una monitorización con un ECG inicial y uno de control.[13] Si un paciente tiene un QTcF > 500 ms o una arritmia ventricular significativa, debe interrumpirse la administración de bedaquilina y de otros medicamentos que prolongen el QT.
Existe una considerable controversia sobre la aprobación del medicamento, ya que uno de los estudios más grandes hasta la fecha tuvo más muertes en el grupo que recibió bedaquilina que los que recibieron placebo.[14] 10 muertes ocurrieron en el grupo de bedaquilina de un total de 79 pacientes, mientras que 2 se produjeron en el grupo de placebo, de un total de 81 pacientes.[9] De las 10 muertes en bedaquilina, 1 se debió a un accidente automovilístico, 5 se juzgaron por la progresión de la tuberculosis subyacente y 3 se presentaron después de que el paciente dejó de recibir bedaquilina.[14] Sin embargo, aún existe una preocupación importante por la mayor mortalidad en pacientes tratados con bedaquilina, lo que lleva a la recomendación de limitar su uso a situaciones en las que no se puede desarrollar un régimen de 4 medicamentos, limitar el uso con otros medicamentos que prolongan el intervalo QT y la colocación de un prominente recuadro negro de advertencia.[14][8]
Interacciones con medicamentos[editar]
Bedaquilina no debe administrarse junto con otros medicamentos que sean fuertes inductores o inhibidores de CYP3A4, la enzima hepática responsable del metabolismo oxidativo del medicamento.[13] La administración conjunta con rifampicina, un fuerte inductor del CYP3A4, produce una disminución del 52% en el AUC de la droga. Esto reduce la exposición del cuerpo al fármaco y disminuye el efecto antibacteriano. La administración conjunta con ketoconazol, un fuerte inhibidor del CYP3A4, produce un aumento del 22% en el AUC y, potencialmente, un aumento en la tasa de efectos adversos experimentados.[13]
Dado que la bedaquilina también puede prolongar el intervalo QT, debe evitarse el uso de otros fármacos que prolongen el QT.[6] Otros medicamentos para la tuberculosis que pueden prolongar el intervalo QT incluyen fluoroquinolonas y clofazimina.
Modo de acción[editar]
Bedaquilina bloquea la bomba de protones de la ATP sintasa de las micobacterias. La producción de ATP es necesaria para la producción de energía celular y su pérdida conduce a la muerte celular, incluso en micobacterias inactivas o no replicantes.[15] Es el primer miembro de una nueva clase de medicamentos llamados diarilquinolinas.[15] La bedaquilina es bactericida.[15]
Resistencia[editar]
La parte específica de la ATP sintasa afectada por bedaquilina es la subunidad c, que está codificada por el gen atpE. Las mutaciones en atpE pueden llevar a la resistencia. Las mutaciones en las bombas de salida de drogas también se han relacionado con resistencia.[16]
Historia[editar]
Bedaquilina se describió por primera vez en 2004 en la Conferencia Interciencias sobre Agentes Antimicrobianos y Quimioterapia (ICAAC), después de que el medicamento hubiera estado en desarrollo durante más de siete años.[17] Fue descubierto por un equipo liderado por Koen Andries en Janssen Pharmaceutica,[18] una filial de Johnson & Johnson
Bedaquilina fue aprobado para uso médico en los Estados Unidos en 2012.[1]
Está fabricado y comercializado por Johnson & Johnson (J&J), que buscó la aprobación acelerada del medicamento, un tipo de aprobación temporal para enfermedades que carecen de otras opciones de tratamiento viables.[19] Al obtener la aprobación para un medicamento que trata una enfermedad desatendida, J&J ahora puede solicitar una revisión acelerada por la FDA de un medicamento futuro.[20]
Cuando fue aprobado por la FDA el 28 de diciembre de 2012, fue el primer medicamento nuevo para la TB en más de cuarenta años.[21][22]
Referencias[editar]
- ↑ a b c d e f g h i «Bedaquiline Fumarate». The American Society of Health-System Pharmacists. Archivado desde el original el 20 de diciembre de 2016. Consultado el 8 de diciembre de 2016.
- ↑ a b c d The selection and use of essential medicines: Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children).. World Health Organization. 2015. p. vii, 29. ISBN 9789241209946. Consultado el 10 de diciembre de 2016.
- ↑ «Bedaquiline (Sirturo) Use During Pregnancy». www.drugs.com. Archivado desde el original el 20 de diciembre de 2016. Consultado el 10 de diciembre de 2016.
- ↑ «WHO Model List of Essential Medicines (19th List)». World Health Organization. April 2015. Archivado desde el original el 13 de diciembre de 2016. Consultado el 8 de diciembre de 2016.
- ↑ «Press Announcements - FDA approves first drug to treat multi-drug resistant tuberculosis». www.fda.gov (en inglés). Dec 2012. Archivado desde el original el 19 de diciembre de 2016.
- ↑ a b Centers for Disease Control and Prevention (25 de octubre de 2013). «Provisional CDC guidelines for the use and safety monitoring of bedaquiline fumarate (Sirturo) for the treatment of multidrug-resistant tuberculosis». MMWR 62 (RR-09): 1-12. ISSN 1545-8601. PMID 24157696.
- ↑ WHO (2013). The use of bedaquiline in the treatment of multidrug-resistant tuberculosis : interim policy guidance..
- ↑ a b c Field, Stephen K. (1 de julio de 2015). «Bedaquiline for the treatment of multidrug-resistant tuberculosis: great promise or disappointment?». Therapeutic Advances in Chronic Disease (en inglés) 6 (4): 170-184. ISSN 2040-6223. PMC 4480545. PMID 26137207. doi:10.1177/2040622315582325. Archivado desde el original el 28 de octubre de 2015.
- ↑ a b Diacon, Andreas H.; Pym, Alexander; Grobusch, Martin P.; de los Rios, Jorge M.; Gotuzzo, Eduardo; Vasilyeva, Irina; Leimane, Vaira; Andries, Koen et al. (21 de agosto de 2014). «Multidrug-Resistant Tuberculosis and Culture Conversion with Bedaquiline». New England Journal of Medicine 371 (8): 723-732. ISSN 0028-4793. PMID 25140958. doi:10.1056/NEJMoa1313865.
- ↑ «BPaMZ @ TB Alliance». Archivado desde el original el 19 de febrero de 2017. Consultado el 7 de abril de 2019.
- ↑ «Two new drug therapies might cure every form of tuberculosis. Feb 2017». Archivado desde el original el 20 de febrero de 2017. Consultado el 7 de abril de 2019.
- ↑ Drugs.com: Sirturo Side Effects Archivado el 23 de septiembre de 2013 en Wayback Machine.
- ↑ a b c «Prescribing Information for Bedaquiline». Archivado desde el original el 24 de agosto de 2013. Consultado el 28 de abril de 2014.
- ↑ a b c Cox, Edward; Laessig, Katherine (21 de agosto de 2014). «FDA Approval of Bedaquiline — The Benefit–Risk Balance for Drug-Resistant Tuberculosis». New England Journal of Medicine 371 (8): 689-691. ISSN 0028-4793. PMID 25140952. doi:10.1056/NEJMp1314385.
- ↑ a b c Worley, Marylee V.; Estrada, Sandy J. (1 de noviembre de 2014). «Bedaquiline: A Novel Antitubercular Agent for the Treatment of Multidrug-Resistant Tuberculosis». Pharmacotherapy (en inglés) 34 (11): 1187-1197. ISSN 1875-9114. PMID 25203970. doi:10.1002/phar.1482.
- ↑ Andries, Koen; Villellas, Cristina; Coeck, Nele; Thys, Kim; Gevers, Tom; Vranckx, Luc; Lounis, Nacer; Jong, Bouke C. de et al. (10 de julio de 2014). «Acquired Resistance of Mycobacterium tuberculosis to Bedaquiline». PLOS ONE 9 (7): e102135. ISSN 1932-6203. PMC 4092087. PMID 25010492. doi:10.1371/journal.pone.0102135.
- ↑ «In search of new cures for tuberculosis». Medicinal Chemistry 3 (3): 301-16. May 2007. PMID 17504204. doi:10.2174/157340607780620626. Archivado desde el original el 3 de julio de 2020. Consultado el 7 de abril de 2019.
- ↑ «A computational model of the inhibition of Mycobacterium tuberculosis ATPase by a new drug candidate R207910». Proteins 67 (4): 971-80. June 2007. PMID 17387738. doi:10.1002/prot.21376.
- ↑ Walker, Joseph (31 de diciembre de 2012). «J&J Tuberculosis Drug Gets Fast-Track Clearance». Consultado el 1 de enero de 2013.
- ↑ Edney, Anna (31 de diciembre de 2012). «J&J&J Sirturo Wins FDA Approval to Treat Drug-Resistant TB». Bloomberg. Archivado desde el original el 4 de enero de 2013. Consultado el 1 de enero de 2013.
- ↑ «FDA Approves 1st New Tuberculosis Drug in 40 Years». ABC News. Archivado desde el original el 4 de enero de 2013. Consultado el 31 de diciembre de 2012.
- ↑ Thomas, Katie (31 de diciembre de 2012). «F.D.A. Approves New Tuberculosis Drug». Consultado el 31 de diciembre de 2012.
Enlaces externos[editar]
- Esta obra contiene una traducción parcial derivada de «Bedaquiline» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
