Biomarcadores del cáncer
Un biomarcador del cáncer se refiere a una sustancia o proceso que es indicativo de la presencia de cáncer en el cuerpo. Un biomarcador puede ser una molécula secretada por un tumor o una respuesta específica del cuerpo a la presencia de cáncer. Los biomarcadores genéticos, epigenéticos, proteómicos, glucémicos y de imágenes pueden usarse para el diagnóstico, pronóstico y epidemiología del cáncer. Idealmente, dichos biomarcadores se pueden analizar en biofluidos no invasivos como sangre o suero.[1]
Si bien existen numerosas dificultades en la investigación de biomarcadores, ya se han utilizado en algún momento en la atención a los pacientes algunos biomarcadores basados en genes y proteínas; entre estos se encuentra la AFP para el cáncer de hígado, el BCR-ABL para la leucemia mieloide crónica, el BRCA1/ BRCA2 para el cáncer de mama y de ovario, el BRAF V600E para el melanoma/cáncer colorrectal, el CA-125 (cáncer de ovario), CA19.9 (cáncer de páncreas ), CEA (cáncer colorrectal), EGFR (carcinoma de pulmón no microcítico), HER-2 (cáncer de mama), KIT (tumor del estroma gastrointestinal), PSA (antígeno prostático específico) (cáncer de próstata), S100 (melanoma), y muchos otros.[2][3][4][5][6][7][8][9][10][11] Se ha informado que las propias proteínas mutantes detectadas por el Monitoreo de Reacción Seleccionado (SRM) son los biomarcadores más específicos para los cánceres porque solo pueden provenir de un tumor existente.[12]
Definiciones de biomarcadores del cáncer[editar]
Las organizaciones y publicaciones varían en su definición de biomarcador. En muchas áreas de la medicina, los biomarcadores se limitan a proteínas identificables o mensurables en la sangre o la orina. Sin embargo, el término se usa a menudo para cubrir cualquier propiedad molecular, bioquímica, fisiológica o anatómica que pueda cuantificarse o medirse.
El Instituto Nacional del Cáncer (NCI), en particular, define el biomarcador como: "Una molécula biológica que se encuentra en la sangre, otros fluidos corporales o tejidos que es un signo de un proceso normal o anormal, o de una afección o enfermedad". Se puede usar un biomarcador para ver cómo responde el cuerpo a un tratamiento para una enfermedad o afección, también llamado marcador molecular y "firma molecula".[13]
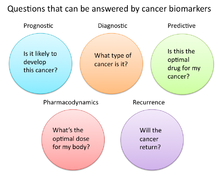
En la investigación y la medicina del cáncer, los biomarcadores se utilizan de tres maneras principales:[14]
- Para ayudar a diagnosticar las afecciones, como en el caso de la identificación de cánceres en etapa temprana (diagnóstico)
- Para pronosticar cuan agresiva está siendo una afección, como en el caso de determinar la capacidad del paciente para viajar en ausencia de tratamiento (pronóstico)
- Para pronosticar cómo responderá un paciente al tratamiento (predictivo)
Papel de los biomarcadores en la investigación y la medicina del cáncer[editar]
Usos de biomarcadores en la medicina del cáncer[editar]
Valoración de riesgo[editar]
Los biomarcadores del cáncer, en particular los asociados con mutaciones genéticas o alteraciones epigenéticas, a menudo ofrecen una forma cuantitativa de determinar cuándo los individuos están predispuestos a tipos particulares de cáncer. Ejemplos notables de biomarcadores de cáncer potencialmente predictivos incluyen mutaciones en los genes KRAS, p53, EGFR, erbB2 para cáncer colorrectal, esofágico, hepático y pancreático; mutaciones de los genes BRCA1 y BRCA2 para el cáncer de mama y de ovario; metilación anormal de los genes supresores de tumores p16, CDKN2B y p14ARF para el cáncer cerebral; hipermetilación de MYOD1, CDH1 y CDH13 para el cáncer de cuello uterino; e hipermetilación de p16, p14 y RB1, para cáncer oral.[15]
Diagnosis[editar]
Los biomarcadores del cáncer también pueden ser útiles para establecer un diagnóstico específico. Ocurre cuando hay una necesidad de determinar si los tumores son de origen primario o metastásico. Para hacer esta distinción, los investigadores pueden contrastar las alteraciones cromosómicas que se encuentran en las células ubicadas en el sitio del tumor primario con las encontradas en el sitio secundario. Si las alteraciones coinciden, el tumor secundario puede identificarse como metastásico; mientras que si las alteraciones difieren, el tumor secundario puede identificarse como un tumor primario distinto.[16]
Pronóstico y predicciones de tratamiento[editar]
Otro uso de biomarcadores en la medicina del cáncer es el pronóstico de la enfermedad, que tiene lugar después de que un individuo ha sido diagnosticado con cáncer. Aquí los biomarcadores pueden ser útiles para determinar la agresividad de un cáncer identificado, así como la probabilidad de responder a un tratamiento determinado. En parte, esto se debe a que los tumores que exhiben biomarcadores particulares pueden responder a tratamientos vinculados a la expresión o presencia de ese biomarcador. Ejemplos de tales biomarcadores pronósticos incluyen niveles elevados de inhibidor de la metalopeptidasa 1 (TIMP1), un marcador asociado con formas agresivas de mieloma múltiple, expresión elevada de receptor de estrógeno (ER) y/o receptor de progesterona (PR), marcadores asociados con una mejor supervivencia global en pacientes con cáncer de mama; La amplificación del gen HER2 / neu, un marcador que indica que un cáncer de mama probablemente responderá al tratamiento con trastuzumab; una mutación en el exón 11 del protooncogén c-KIT, un marcador indicatico de que un tumor del estroma gastrointestinal (GIST) probablemente responderá al tratamiento con imatinib; y mutaciones en el dominio tirosina quinasa de EGFR1, un marcador que indica que el carcinoma de pulmón no microcítico (CPCNP) de un paciente probablemente responderá al tratamiento con gefitinib o erlotinib.[17][18][19][20][21][22][23][24][25]
Farmacodinámica y farmacocinética[editar]
Los biomarcadores de cáncer también pueden usarse para determinar el régimen de tratamiento más efectivo para el cáncer de una persona en particular.[26] Debido a las diferencias en la composición genética de cada persona, algunas personas metabolizan o cambian la estructura química de las drogas de manera diferente. En algunos casos, la disminución del metabolismo de ciertas drogas puede crear condiciones peligrosas en las que se acumulan altos niveles de la droga en el cuerpo. Como tal, las decisiones de dosificación de fármacos en tratamientos de cáncer particulares pueden beneficiarse de la detección de dichos biomarcadores. Un ejemplo es el gen que codifica la enzima tiopurina metiltransferasa (TPMPT). Las personas con mutaciones en el gen TPMT no pueden metabolizar grandes cantidades del fármaco leucémico, la mercaptopurina, que potencialmente causa una caída fatal en el recuento de leucocitos en dichos pacientes. Por lo tanto, se recomienda que los pacientes con mutaciones de TPMT reciban una menor dosis de mercaptopurina por consideraciones de seguridad.[27]
Control de la respuesta al tratamiento[editar]
Los biomarcadores de cáncer también han demostrado utilidad para controlar cómo está funcionando un tratamiento a lo largo del tiempo. Se están llevando a cabo muchas investigaciones en esta área particular, ya que los biomarcadores exitosos tienen el potencial de proporcionar una reducción de costos significativa en la atención del paciente, ya que las pruebas actuales basadas en imágenes como CT y MRI para controlar el estado del tumor son muy costosas.[28]
Un biomarcador notable que atrae mucha atención es el biomarcador de proteínas S100-beta para controlar la respuesta del melanoma maligno. En dichos melanomas, los melanocitos, las células que producen pigmento en nuestra piel, producen la proteína S100-beta en altas concentraciones, dependiendo del número de células cancerosas. La respuesta al tratamiento se asocia así con niveles reducidos de S100-beta en la sangre de tales personas.[29][30]
De manera similar, investigaciones adicionales de laboratorio han demostrado que las células tumorales que experimentan apoptosis pueden liberar componentes celulares tales como el citocromo c, nucleosomas, citoqueratina-18 escindida y E-cadherina. Los estudios han encontrado que estas macromoléculas y otras se pueden encontrar en circulación durante la terapia del cáncer, proporcionando una fuente potencial de métricas clínicas para monitorear el tratamiento.
Recurrencia[editar]
Los biomarcadores del cáncer también pueden ser valiosos para predecir o controlar la recurrencia del cáncer. La prueba de cáncer de mama Oncotype DX® es una de esas pruebas utilizadas para predecir la probabilidad de recurrencia del cáncer de mama. La prueba de Thist está dirigida a mujeres con cáncer de mama invasivo (ER +) en etapa temprana (Etapa I o II), ganglios negativos y receptores de estrógenos, que será tratado con terapia hormonal. La prueba Oncotype DX examina un panel de 21 genes en células tomadas durante la biopsia tumoral. Los resultados de la prueba se dan en forma de una puntuación de recurrencia que indica la probabilidad de recurrencia a los 10 años.[31][32]
Usos de los biomarcadores en la investigación del cáncer[editar]
Desarrollo de fármacos objetivo[editar]
Además de su uso en medicina contra el cáncer, los biomarcadores se usan a menudo durante todo el proceso de desarrollo de fármacos contra el cáncer. Por ejemplo, en la década de 1960, los investigadores descubrieron que la mayoría de los pacientes con leucemia mielógena crónica poseían una anormalidad genética particular en los cromosomas 9 y 22 denominada cromosoma Filadelfia. Cuando estos dos cromosomas se combinan crean un gen causante de cáncer conocido como BCR-ABL. En tales pacientes, este gen actúa como el punto inicial principal en todas las manifestaciones fisiológicas de la leucemia. Durante muchos años, el BCR-ABL simplemente se usó como un biomarcador para estratificar un cierto subtipo de leucemia. Sin embargo, los desarrolladores de fármacos finalmente pudieron desarrollar imatinib, un potente fármaco que inhibió eficazmente esta proteína y disminuyó significativamente la producción de células que contienen el cromosoma Filadelfia.[33][34]
Tipos de biomarcadores del cáncer[editar]
| Tipo de tumor | Biomarcador |
|---|---|
| Mama | ER/PR (receptor de estrógeno/receptor de progesterona)[35][36] |
| HER-2/neu | |
| Colorectal | EGFR |
| KRAS[37] | |
| UGT1A1 | |
| Gástrico | HER-2/neu |
| GIST | CD117[38] |
| Leucemia/linfoma | CD20[39] |
| CD30[40] | |
| FIP1L1-PDGFRalpha[41] | |
| PDGFR[42] | |
| Cromosoma de Filadelfia (BCR/ABL)[43][44] | |
| PML/RAR-Alfa[45] | |
| TPMT[46] | |
| UGT1A1[47] | |
| Pulmón | EML4/ALK[48][49] |
| EGFR | |
| KRAS | |
| Melanoma | BRAF |
| Páncreas | Niveles elevados de leucina, isoleucina y valina[50] |
Referencias[editar]
- ↑ Mishra, Alok; Verma, Mukesh (2010). «Cancer Biomarkers: Are We Ready for the Prime Time?». Cancers 2 (1): 190-208. doi:10.3390/cancers2010190.
- ↑ Rhea, Jeanne; Ross J. Molinaro (March 2011). «Cancer Biomarkers: Surviving the journey from bench to bedside». Medical Laboratory Observer. Archivado desde el original el 14 de octubre de 2013. Consultado el 26 de abril de 2013.
- ↑ Behne, Tara; Copur, M. Sitki (1 de enero de 2012). «Biomarkers for Hepatocellular Carcinoma». International Journal of Hepatology 2012: 1-7. doi:10.1155/2012/859076.
- ↑ Musolino, A; Bella, MA; Bortesi, B; Michiara, M; Naldi, N; Zanelli, P; Capelletti, M; Pezzuolo, D; Camisa, R; Savi, M; Neri, TM; Ardizzoni, A (June 2007). «BRCA mutations, molecular markers, and clinical variables in early-onset breast cancer: a population-based study.». Breast 16 (3): 280-92. PMID 17257844. doi:10.1016/j.breast.2006.12.003.
- ↑ Dienstmann, R; Tabernero, J (March 2011). «BRAF as a target for cancer therapy.». Anti-Cancer Agents in Medicinal Chemistry 11 (3): 285-95. PMID 21426297. doi:10.2174/187152011795347469.
- ↑ Lamparella, N; Barochia, A; Almokadem, S (2013). «Impact of genetic markers on treatment of non-small cell lung cancer.». Advances in Experimental Medicine and Biology 779: 145-64. PMID 23288638. doi:10.1007/978-1-4614-6176-0_6.
- ↑ Orphanos, G; Kountourakis, P (2012). «Targeting the HER2 receptor in metastatic breast cancer.». Hematology/Oncology and Stem Cell Therapy 5 (3): 127-37. PMID 23095788. doi:10.5144/1658-3876.2012.127.
- ↑ DePrimo, S. E.; Huang, X.; Blackstein, M. E.; Garrett, C. R.; Harmon, C. S.; Schoffski, P.; Shah, M. H.; Verweij, J.; Baum, C. M.; Demetri, G. D. (8 de septiembre de 2009). «Circulating Levels of Soluble KIT Serve as a Biomarker for Clinical Outcome in Gastrointestinal Stromal Tumor Patients Receiving Sunitinib following Imatinib Failure». Clinical Cancer Research 15 (18): 5869-5877. PMC 3500590. PMID 19737953. doi:10.1158/1078-0432.CCR-08-2480.
- ↑ Bantis, A; Grammaticos, P (Sep–Dec 2012). «Prostatic specific antigen and bone scan in the diagnosis and follow-up of prostate cancer. Can diagnostic significance of PSA be increased?». Hellenic Journal of Nuclear Medicine 15 (3): 241-6. PMID 23227460.
- ↑ Kruijff, S; Hoekstra, HJ (April 2012). «The current status of S-100B as a biomarker in melanoma.». European Journal of Surgical Oncology 38 (4): 281-5. PMID 22240030. doi:10.1016/j.ejso.2011.12.005.
- ↑ Ludwig, JA; Weinstein, JN (November 2005). «Biomarkers in cancer staging, prognosis and treatment selection.». Nature Reviews Cancer 5 (11): 845-56. PMID 16239904. doi:10.1038/nrc1739.
- ↑ Wang, Qing; Raghothama Chaerkady (December 2010). «Mutant proteins as cancer-specific biomarkers.». Proceedings of the National Academy of Sciences 108: 2444-2449. PMC 3038743. PMID 21248225. doi:10.1073/pnas.1019203108. Consultado el 10 de abril de 2016.
- ↑ «biomarker». NCI Dictionary of Cancer Terms. National Cancer Institute.
- ↑ «Biomarkers in Cancer: An Introductory Guide for Advocates». Research Advocay Network. 2010. Archivado desde el original el 29 de octubre de 2013. Consultado el 26 de abril de 2013.
- ↑ Verma, M; Manne, U (October 2006). «Genetic and epigenetic biomarkers in cancer diagnosis and identifying high risk populations.». Critical Reviews in Oncology/Hematology 60 (1): 9-18. PMID 16829121. doi:10.1016/j.critrevonc.2006.04.002.
- ↑ «Distinguishing second primary tumors from lung metastases in patients with head and neck squamous cell carcinoma.». Journal of the National Cancer Institute 90 (13): 972-7. 1 de julio de 1998. PMID 9665144. doi:10.1093/jnci/90.13.972.
- ↑ «High levels of serum TIMP-1 correlate with advanced disease and predict for poor survival in patients with multiple myeloma treated with novel agents». Leukemia Research 34 (3): 399-402. March 2010. PMID 19781774. doi:10.1016/j.leukres.2009.08.035.
- ↑ «Loss of estrogen receptor in recurrent breast cancer is associated with poor response to endocrine therapy.». Journal of Clinical Oncology 14 (9): 2584-9. September 1996. PMID 8823339. doi:10.1200/jco.1996.14.9.2584.
- ↑ «American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer.». Journal of Clinical Oncology 25 (33): 5287-312. 20 de noviembre de 2007. PMID 17954709. doi:10.1200/JCO.2007.14.2364.
- ↑ «Prognostic and predictive effects of immunohistochemical factors in high-risk primary breast cancer patients.». Clinical Cancer Research 12 (1): 159-68. Jan 1, 2006. PMID 16397038. doi:10.1158/1078-0432.CCR-05-1340.
- ↑ «Current and future anti-HER2 therapy in breast cancer.». Journal of the Balkan Union of Oncology 18 (1): 4-16. Jan–Mar 2013. PMID 23613383.
- ↑ «Efficacy, safety, and pharmacokinetics of imatinib dose escalation to 800 mg/day in patients with advanced gastrointestinal stromal tumors.». Investigational New Drugs 31 (5): 1367-74. Apr 17, 2013. PMID 23591629. doi:10.1007/s10637-013-9961-8.
- ↑ «Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial.». Lancet 368 (9544): 1329-38. 14 de octubre de 2006. PMID 17046465. doi:10.1016/S0140-6736(06)69446-4.
- ↑ «TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer.». Journal of Clinical Oncology 23 (25): 5892-9. 1 de septiembre de 2005. PMID 16043829. doi:10.1200/JCO.2005.02.840.
- ↑ «Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib.». The New England Journal of Medicine 350 (21): 2129-39. 20 de mayo de 2004. PMID 15118073. doi:10.1056/NEJMoa040938.
- ↑ Sawyers CL (April 2008). «The cancer biomarker problem». Nature 452 (7187): 548-52. PMID 18385728. doi:10.1038/nature06913.
- ↑ «Mercaptopurine therapy intolerance and heterozygosity at the thiopurine S-methyltransferase gene locus». Journal of the National Cancer Institute 91 (23): 2001-8. December 1999. PMID 10580024. doi:10.1093/jnci/91.23.2001.
- ↑ «Economics of Cancer Biomarkers». Personalized Medicine 9 (8): 829-837. 2012. doi:10.2217/pme.12.87.
- ↑ «Serum S100--a marker for disease monitoring in metastatic melanoma.». Dermatology 194 (3): 208-12. 1997. PMID 9187834. doi:10.1159/000246103.
- ↑ «S100 proteins as cancer biomarkers with focus on S100B in malignant melanoma.». Clinical Biochemistry 37 (7): 512-8. July 2004. PMID 15234232. doi:10.1016/j.clinbiochem.2004.05.012.
- ↑ «Is the 21-gene recurrence score a cost-effective assay in endocrine-sensitive node-negative breast cancer?». Expert Review of Pharmacoeconomics & Outcomes Research 13 (2): 243-50. April 2013. PMID 23570435. doi:10.1586/erp.13.4.
- ↑ «Impact of Oncotype DX on Treatment Decisions in ER-Positive, Node-Negative Breast Cancer with Histologic Correlation.». The Breast Journal 19 (3): 269-75. May 2013. PMID 23614365. doi:10.1111/tbj.12099.
- ↑ «Imatinib: a review of its use in chronic myeloid leukaemia.». Drugs 67 (2): 299-320. 2007. PMID 17284091. doi:10.2165/00003495-200767020-00010.
- ↑ «New Hope for Cancer». 28 de mayo de 2001. Archivado desde el original el 25 de abril de 2013. Consultado el 26 de abril de 2013.
- ↑ «Table of Pharmacogenomic Biomarkers in Drug Labels». U.S Food and Drug Administration.
- ↑ «Tumor Markers Fact Sheet» (PDF). American Cancer Society. Archivado desde el original el 5 de noviembre de 2012. Consultado el 14 de marzo de 2018.
- ↑ Lenz, Heinz-Josef. EdBk.GI.Colo.04.pdf «Established Biomarkers in Colon Cancer» (PDF). American Society of Clinical Oncology’s 2009 Educational Book. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ «Gastrointestinal stromal tumor markers in cutaneous melanomas: relationship to prognostic factors and outcome». American Journal of Clinical Pathology 136 (1): 74-80. July 2011. PMID 21685034. doi:10.1309/AJCP9KHD7DCHWLMO.
- ↑ «Chronic lymphocytic leukaemia CD20 expression is dependent on the genetic subtype: a study of quantitative flow cytometry and fluorescent in-situ hybridization in 510 patients». British Journal of Haematology 141 (1): 36-40. April 2008. PMID 18324964. doi:10.1111/j.1365-2141.2008.07012.x.
- ↑ «Effective therapy of murine models of human leukemia and lymphoma with radiolabeled anti-CD30 antibody, HeFi-1». Proceedings of the National Academy of Sciences of the United States of America 104 (20): 8444-8. May 2007. PMC 1895969. PMID 17488826. doi:10.1073/pnas.0702496104.
- ↑ «FIP1L1/PDGFRalpha synergizes with SCF to induce systemic mastocytosis in a murine model of chronic eosinophilic leukemia/hypereosinophilic syndrome». Blood 112 (6): 2500-7. September 2008. PMID 18539901. doi:10.1182/blood-2007-11-126268.
- ↑ Nimer SD (May 2008). «Myelodysplastic syndromes». Blood 111 (10): 4841-51. PMID 18467609. doi:10.1182/blood-2007-08-078139.
- ↑ «Dasatinib induces rapid hematologic and cytogenetic responses in adult patients with Philadelphia chromosome positive acute lymphoblastic leukemia with resistance or intolerance to imatinib: interim results of a phase 2 study». Blood 110 (7): 2309-15. October 2007. PMID 17496201. doi:10.1182/blood-2007-02-073528.
- ↑ «Chemotherapeutic agents circumvent emergence of dasatinib-resistant BCR-ABL kinase mutations in a precise mouse model of Philadelphia chromosome-positive acute lymphoblastic leukemia». Blood 117 (13): 3585-95. March 2011. PMC 3072880. PMID 21263154. doi:10.1182/blood-2010-08-301267.
- ↑ «Regulation of S100A10 by the PML-RAR-α oncoprotein». Blood 117 (15): 4095-105. April 2011. PMID 21310922. doi:10.1182/blood-2010-07-298851.
- ↑ «A personalized approach to cancer treatment: how biomarkers can help». Clinical Chemistry 54 (11): 1770-9. November 2008. PMID 18801934. doi:10.1373/clinchem.2008.110056.
- ↑ «Pharmacogenetic study in Hodgkin lymphomas reveals the impact of UGT1A1 polymorphisms on patient prognosis». Blood 113 (14): 3307-13. April 2009. PMID 18768784. doi:10.1182/blood-2008-03-148874.
- ↑ «Evaluation of EML4-ALK fusion proteins in non-small cell lung cancer using small molecule inhibitors». Neoplasia 13 (1): 1-11. January 2011. PMC 3022423. PMID 21245935. doi:10.1593/neo.101120.
- ↑ «New driver mutations in non-small-cell lung cancer». Lancet Oncology 12 (2): 175-80. February 2011. PMID 21277552. doi:10.1016/S1470-2045(10)70087-5.
- ↑ Hewes, Arlington (2 de octubre de 2014). «Promising Method for Detecting Pancreatic Cancer Years Before Traditional Diagnosis». Singularity HUB. Consultado el 22 de abril de 2016.
Enlaces externos[editar]
- CancerDriver: base de datos abierta de biomarcadores de cáncer con enlaces a referencias y reclutamiento de ensayos clínicos.
- Últimas noticias sobre biomarcadores oncológicos
