Bromuro de fenilmagnesio
| Bromuro de fenilmagnesio | ||
|---|---|---|
 | ||
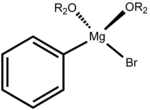 Aducto real | ||
| Nombre IUPAC | ||
| Bromuro de fenilmagnesio | ||
| General | ||
| Fórmula semidesarrollada | (C6H5)MgBr | |
| Fórmula molecular | C6H5MgBr | |
| Identificadores | ||
| Número CAS | 100-58-3[1] | |
| Propiedades físicas | ||
| Densidad | 1140 kg/m³; 1,14 g/cm³ | |
| Masa molar | 18 131 g/mol | |
| Propiedades químicas | ||
| Alcalinidad | base fuerte pKb | |
| Solubilidad en agua | reacciona con agua | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bromuro de fenilmagnesio, con la fórmula molecular C6H5MgBr, es un compuesto organometálico que contiene magnesio (es un compuesto de organomagnesio). Está disponible comercialmente como una disolución en éter dietílico o tetrahidrofurano (THF). El bromuro de fenilmagnesio es un reactivo de Grignard. A menudo se utiliza como un equivalente sintético para el sintón fenilo "Ph".
Síntesis[editar]

El bromuro de fenilmagnesio se encuentra disponible comercialmente como disoluciones de éter dietílico o THF. Se puede preparar en el laboratorio mediante el tratamiento de bromobenceno con magnesio metálico, generalmente en forma de virutas. Una pequeña cantidad de yodo puede ser usado para activar el magnesio e iniciar así la reacción.[2]
Para la síntesis de este compuesto se requiere de disolventes coordinantes, tales como éter o THF, que formen un complejo con el magnesio (II) pero no reaccionen con él. El disolvente debe ser aprótico, ya que disolventes próticos como los alcoholes o el agua, contienen un protón ácido que puede reaccionar con el bromuro de fenilmagnesio para dar benceno. Disolventes que contienen un grupo carbonilo, tales como la acetona o el acetato de etilo, también son incompatibles con este tipo de compuestos, ya que reaccionan formando el correspondiente alcohol.
Estructura[editar]

Aunque el bromuro de fenilmagnesio se representa normalmente como un compuesto de fórmula C6H5MgBr, la molécula es más compleja. El compuesto forma un aducto con dos ligandos OR2 ya sean éter o THF. Así, el Mg es tetraédrico y obedece la regla del octeto. Por lo general, no se aisló en forma de la sustancia libre, pero solo se utiliza como una disolución. La estabilidad de las disoluciones de los compuestos de Grignard se basa en el enlace coordinado de los pares de electrones libres del átomo de oxígeno del éter correspondiente. Las distancias Mg-O son 201 y 206 pm, mientras que la distancia Mg-Br y Mg-C son 220 y 244 pm, respectivamente.[3]
Reactividad química[editar]
El bromuro de fenilmagnesio es un nucleófilo fuerte, así como una base fuerte. Puede incluso abstraer protones ligeramente ácidos, por lo tanto el sustrato debe estar protegido en caso necesario. A menudo se añade a carbonilos, tales como cetonas o aldehídos para obtener alcoholes.[2][4] Con dióxido de carbono, reacciona para dar ácido benzoico después de un tratamiento ácido.
Usos industriales[editar]
Un ejemplo de la reacción de Grignard con este compuesto es una etapa clave en la producción industrial de tamoxifeno (utilizado actualmente para el tratamiento de cáncer de mama receptor positivo de estrógeno en las mujeres):

Referencias[editar]
- ↑ Número CAS
- ↑ a b Robertson, D. L. (3 de enero de 2007). «Grignard Synthesis: Synthesis of Benzoic Acid and of Triphenylmethanol». MiraCosta College. Consultado el 25 de enero de 2008.
- ↑ Stucky, G. D.; Rundle, R. E. «The Structure of Phenylmagnesium Bromide Diethyletherate and the Nature of Grignard Reagents». J. Am. Chem. Soc.]] año = 1963 85 (7): 1002-1003. doi:10.1021/ja00890a039.
- ↑ Bachmann, W. E.; Hetzner, H. P. (1955). "Triphenylcarbinol". Org. Synth.; Coll. Vol. 3: 839.
