Cáncer de riñón
| Cáncer de riñón | ||
|---|---|---|
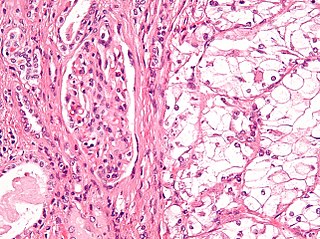 Micrografía que muestra el tipo más común de cáncer de riñón (carcinoma de células renales de células claras). Tinción H&E. | ||
| Especialidad |
oncología urología | |
El cáncer de riñón, también conocido como cáncer renal, es un grupo de cánceres que se origina en el riñón.[1] Los síntomas pueden incluir sangre en la orina, bulto en el abdomen o dolor de espalda.[2][3][4] También puede aparecer fiebre, pérdida de peso y cansancio.[2][3][4] Las complicaciones pueden ser la diseminación a los pulmones o el cerebro.[5]
Los principales tipos de cáncer de riñón son el cáncer de células renales (CCR ), el cáncer de células transicionales (CCT) y el tumor de Wilms.[6] El CCR constituye aproximadamente el 80 % de los cánceres de riñón y el CCT representa la mayor parte del resto.[7] Entre los factores de riesgo del CCR y el CCT se incluyen el tabaquismo, determinados analgésicos, cáncer de vejiga previo, sobrepeso, hipertensión arterial, determinadas sustancias químicas y antecedentes familiares.[2][3] Los factores de riesgo del tumor de Wilms son los antecedentes familiares y determinados trastornos genéticos como el síndrome de WAGR.[4] El diagnóstico se puede sospechar a partir de los síntomas, análisis de orina e imágenes médicas.[2][3][4] Se confirma mediante biopsia de tejido.[2][3][4]
El tratamiento puede incluir cirugía, radioterapia, quimioterapia, inmunoterapia y terapia dirigida.[2][3][4] El cáncer de riñón afectó por primera vez a unas 403 300 personas y provocó 175 000 muertes en todo el mundo en 2018.[8] El inicio suele ser después de los 45 años.[1] Los varones se ven afectados con más frecuencia que las mujeres.[1] La tasa general de supervivencia a cinco años es del 75 % en Estados Unidos, 71 % en Canadá, 70 % en China y 60 % en Europa.[1][9][10][11] Para los cánceres que se limitan al riñón, la tasa de supervivencia a cinco años es del 93 %, si se ha diseminado a los ganglios linfáticos circundantes, es del 70 %, y si se ha diseminado ampliamente, es del 12 %.[1] El cáncer de riñón se ha identificado como la decimotercera forma más común de cáncer,[12] y es responsable del 2 % de los casos y muertes por cáncer en el mundo.[13] La incidencia del cáncer de riñón no ha dejado de aumentar desde 1930. El cáncer renal es más frecuente en poblaciones de zonas urbanas que rurales.[14]
Signos y síntomas[editar]
Al principio, las masas renales no suelen causar ningún síntoma y son indetectables en la exploración física.[15] A medida que el cáncer de riñón avanza, suele aparecer sangre en la orina, dolor en el costado o en la espalda y una masa.[15] Otros síntomas compatibles con una enfermedad avanzada son la pérdida de peso, la fiebre, los sudores nocturnos, la inflamación palpable de los ganglios linfáticos del cuello, el varicocele que no se reduce, el dolor óseo, la tos continua y la hinchazón bilateral de la parte inferior de la pierna.[15][16][17]
La tríada clásica de sangre visible en la orina (hematuria), dolor en el flanco y masa abdominal palpable se da en menos del 15% de los casos. El CCR puede presentar signos y síntomas causados por las sustancias que producen las células cancerosas (es decir, síndromes paraneoplásicos).
Los síndromes paraneoplásicos causados por el cáncer de riñón pueden clasificarse en endocrinos y no endocrinos. Entre las disfunciones endocrinas se incluyen el aumento de los niveles de calcio en la sangre (hipercalcemia), presión arterial alta (hipertensión), aumento de los glóbulos rojos ( policitemia), disfunción hepática, secreción lechosa del pezón no relacionada con la lactancia materna normal (galactorrea) y síndrome de Cushing. Las disfunciones no endocrinas incluyen el depósito de proteínas en los tejidos ( amiloidosis), la disminución de la hemoglobina o los glóbulos rojos (anemia), los trastornos de los nervios, los músculos (neuromiopatías), los vasos sanguíneos ( vasculopatía) y los mecanismos de coagulación de la sangre (coagulopatía).[18]
Causas[editar]
Los factores que aumentan el riesgo de padecer cáncer de riñón son el tabaquismo, la hipertensión, la obesidad, los genes defectuosos, los antecedentes familiares de cáncer de riñón, padecer una enfermedad renal que requiera diálisis, estar infectado por la hepatitis C y haber recibido tratamiento previo para el cáncer de testículos o el cáncer de cuello de útero.[19][20]
También se están investigando otros posibles factores de riesgo, como los cálculos renales.[21][22]
Alrededor del 25-30% de los casos de cáncer de riñón se atribuyen al tabaquismo.[20] Los fumadores tienen un riesgo 1,3 veces mayor de desarrollar cáncer de riñón que los no fumadores. Además, el riesgo de desarrollar cáncer aumenta en función de la dosis. Los hombres que fuman más de 20 cigarrillos al día tienen el doble de riesgo. Del mismo modo, las mujeres que fuman más de 20 cigarrillos al día tienen 1,5 veces más riesgo que las no fumadoras. Después de 10 años de dejar de fumar, se observa una reducción sustancial del riesgo de desarrollar cáncer de riñón.[23]
Diagnóstico[editar]
Debido al aumento del uso de la ecografía y la TC para tratar dolencias abdominales inespecíficas, las masas renales se diagnostican con frecuencia de forma incidental en el diagnóstico médico por imagen.[15][24][25] Más del 60% de los carcinomas de células renales (el tipo más común de cáncer de riñón), se diagnostican incidentalmente mediante imágenes abdominales por molestias abdominales inespecíficas.[15][26]
Las masas renales pueden clasificarse por la naturaleza de las células que las componen o por su aspecto en la radiografía.[15] El término cáncer se refiere a un tumor maligno, que es un crecimiento incontrolado de células anormales.[27] Sin embargo, las masas renales pueden deberse al crecimiento de tejido normal (benigno), inflamatorio (una reacción del sistema inmunitario) o vascular (células de los vasos sanguíneos).
Imágenes médicas[editar]
Dado que el diagnóstico diferencial de un tumor renal es muy amplio, el primer paso consiste en caracterizar la masa mediante técnicas de imagen médica para evaluar la probabilidad de que sea benigna o maligna. La ecografía se utiliza a veces para evaluar una masa renal sospechosa, ya que puede caracterizar masas renales quísticas y sólidas sin exposición a la radiación y a un coste relativamente bajo.[15] Radiológicamente, los tumores se agrupan según su aspecto en quísticos simples, quísticos complejos o sólidos.[15] La característica más importante para diferenciar un tumor canceroso de uno no canceroso en las imágenes es el realce.[28] Los quistes simples, que se definen por criterios estrictos,[29] pueden controlarse con seguridad si la persona no presenta síntomas.[15] Sin embargo, todas las masas que no sean claramente quistes simples deben evaluarse más detenidamente y confirmarse mediante técnicas de imagen alternativas.[30][15]
La tomografía computarizada (TC) abdominal con y sin contraste intravenoso es la técnica de imagen ideal para diagnosticar y estadificar el cáncer de riñón.[31][32][15] Existen pruebas provisionales de que los agentes de contraste yodados pueden causar un empeoramiento de la función renal en personas con enfermedad renal crónica (ERC) con una tasa de filtración glomerular (TFG) inferior a 45ml/min/1,73m2, por lo que deben administrarse con precaución en este grupo.[33]
La resonancia magnética (RM) abdominal es un método de imagen alternativo que puede utilizarse para caracterizar y estadificar una masa renal.[31][32][15] Puede sugerirse si no puede administrarse material de contraste.[31] La RM también puede evaluar la vena cava inferior si se sospecha que la masa se extiende fuera del riñón[31]
Dado que los pulmones son el órgano al que con más frecuencia se extiende el cáncer de riñón, puede solicitarse una radiografía de tórax o una tomografía computarizada en función del riesgo de metástasis.[15][30]
Clasificación histopatológica[editar]


El tipo más común de malignidad renal es el carcinoma de células renales,[33] que se cree que se origina en las células del túbulo contorneado proximal de la nefrona.[15][34] Otro tipo de cáncer de riñón aunque menos común, es el cáncer de células de transición (CCT) o carcinoma urotelial de la pelvis renal.[35] La pelvis renal es la parte del riñón que recoge la orina y la drena en un tubo llamado uréter.[35] Las células que recubren la pelvis renal se denominan células de transición y, a veces, también se denominan células uroteliales. Las células de transición/uroteliales en la pelvis renal son el mismo tipo de células que recubren el uréter y la vejiga. Por esta razón, el CCT de la pelvis renal es distinto del CCR y se cree que se comporta más como el cáncer de vejiga.[35] Otros tipos raros de cáncer de riñón que pueden surgir de las células uroteliales de la pelvis renal son el carcinoma de células escamosas y el adenocarcinoma.[15]
Otras causas de cáncer de riñón son las siguientes:[15]
- Sarcoma: por ejemplo, el leiomiosarcoma, el liposarcoma, el angiosarcoma, el sarcoma de células claras y el rabdomiosarcoma son tipos de sarcomas que se han producido en el riñón.
- Tumor metastásico de órgano distante
- linfoma
- Tumor de Wilms: un tumor embrionario que es el tipo más común de cáncer de riñón en los niños
- Tumor carcinoide de la pelvis renal[36]
- Carcinosarcoma[37]
- Papiloma urotelial invertido: tradicionalmente se consideraba un crecimiento benigno. Sin embargo, puede haber un mayor riesgo de recurrencia y transformación a CCT.[38]
En los niños, el tumor de Wilms es el tipo más común de cáncer de riñón.[15] El nefroma mesoblástico, aunque es raro, también se presenta típicamente en la infancia.
El carcinoma de células renales se ha dividido en subtipos según las características histológicas y las anomalías genéticas. La clasificación de la OMS de 2004 de los tumores renales de los adultos describe estas categorías:[39]
- CCR de celda clara
- CCR de células claras multiloculares
- CCR papilar
- CCR cromófobo
- Carcinoma de los conductos colectores de Bellini
- Carcinoma medular renal
- Carcinomas de translocación Xp11
- Carcinoma asociado a neuroblastoma
- Carcinoma mucinoso tubular y de células fusiformes
- Tumor estromal epitelial mixto[40]
Los tumores que se consideran benignos incluyen el angiomiolipoma, el oncocitoma, el reninoma (tumor de células yuxtaglomerulares) y el adenoma renal.[15]
Inmunohistoquímica[editar]
| PAX8 | CD10 | CAIX | RCC | Marcadores melanocíticos | Vimentina | CK7 | HMWCK | CD117 / EQUIPO | AMACR | GATA3 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| CCR de celda clara | + | + | + (en forma de caja) | + | - | + | - | - | - | -/+ | - |
| CCR papilar | + | + | +/- | + | - | + | + | - | - | + | - |
| CCR papilar de células claras | + | - | + (en forma de taza) | +/- | - | + | + | +/- | - | - | +/- |
| RCC cromófobo | + | -/+ | - | +/- | - | - | + | - | + | - | +/- |
| Oncocitoma | + | -/+ | - | - | - | - | Focal | - | + | -/+ | - |
| Angiomiolipoma | - | - | -/+ | - | + | -/+ | - | - | - | - | - |
| Carcinoma de los conductos colectores | + | - | -/+ | - | - | + | +/- | + | - | - | - |
| Carcinoma tubuloquístico | + | + | +/- | + | - | +/- | -/+ | - | - | +/- | - |
| CCR de translocación | + | +/- | -/+ | +/- | +/- | + | - | - | - | +/- | - |
| MTSCC | + | -/+ | -/+ | +/- | - | + | + | -/+ | - | +/- | - |
Leyenda:
| |||||||||||
Estudios de laboratorio[editar]
Las personas con sospecha de cáncer de riñón también deben someterse a una evaluación de la función renal para ayudar a determinar las opciones de tratamiento. Los análisis de sangre para determinar la función renal incluyen un panel metabólico completo (PMC), un hemograma completo.[43][30] Además, estos análisis ayudan a conocer el estado de salud general de la persona, que puede verse afectado por la enfermedad metastásica (enfermedad que se encuentra fuera del riñón). Por ejemplo, la afectación hepática u ósea podría dar lugar a enzimas hepáticas anormales, anomalías electrolíticas o anemia. También debe recogerse una muestra de orina para realizar un análisis de orina.[32][15]
Biopsia[editar]
La utilidad de la biopsia de masa renal radica en que puede confirmar la malignidad con fiabilidad, puede dirigir la terapia basada en el diagnóstico y puede proporcionar drenaje.[30]
Una vez completado el diagnóstico por imagen, debe considerarse la biopsia de la masa renal si existe una alta probabilidad de que la masa sea hematológica, metastásica, inflamatoria o infecciosa.[30] Estos tipos de lesiones no se tratarían quirúrgicamente, a diferencia del cáncer originado en el riñón. El cáncer que se origina fuera del riñón y el linfoma se tratan por vía sistémica.[15][32]
La biopsia de masa renal puede diagnosticar con precisión la malignidad, sin embargo, no puede diagnosticar con fiabilidad la enfermedad benigna. En otras palabras, si la biopsia muestra cáncer, hay un 99,8% de probabilidades de que haya cáncer de riñón (Valor Predictivo Positivo= 99,8%). Una biopsia negativa no descarta el diagnóstico de cáncer.[44]
Estadificación[editar]
La estadificación es el proceso que ayuda a determinar la extensión y propagación de la enfermedad.[45] El carcinoma de células renales es el único tipo de cáncer de riñón que se puede clasificar por etapas. El primer paso de la estadificación sigue el sistema de estadificación TNM propuesto por la Union International Contre le Cancer, que se usa ampliamente entre los cánceres de otros órganos.[15] El sistema de estadificación TNM clasifica el tumor primario (T), los ganglios linfáticos (N) y la metástasis a distancia (M) de la enfermedad. El Comité Conjunto Estadounidense sobre el Cáncer (AJCC) publicó una revisión del Manual de estadificación del cáncer en 2010 que describe los valores de TMN para el carcinoma de células renales.[46][15]
La afectación de los ganglios linfáticos se clasifica como metástasis en los ganglios linfáticos regionales (N1) o sin afectación (N0).[46] De manera similar, M1 describe metástasis a distancia, mientras que M0 no describe metástasis a distancia.[46]
El tumor primario del carcinoma de células renales se clasifica en la siguiente tabla, según el Manual de Estadificación del Cáncer AJCC 8ª Edición[47][48]
| Escenario | TNM | Descripción |
|---|---|---|
| Tx, N0,
M0 |
No se puede evaluar el tumor. | |
| T0, N0,
M0 |
Sin evidencia de tumor primario | |
| I | T1, N0,
M0 |
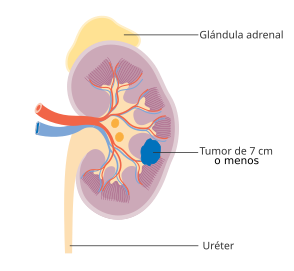
Tumor ≤7 cm; limitado al riñón |
| T1a, N0,
M0 |
Tumor ≤4 cm; limitado al riñón | |
| T1b, N0,
M0 |
Tumor 4-≤7 cm; limitado al riñón | |
| II | T2, N0,
M0 |
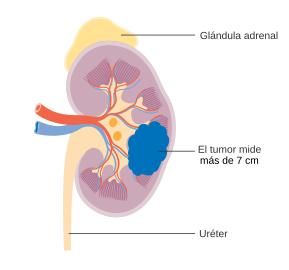
Tumor >7 cm; limitado al riñón |
| T2a, N0,
M0 |
Tumor 7-≤10 cm; limitado al riñón | |
| T2b, N0,
M0 |
Tumor >10 cm; limitado al riñón | |
| tercero | T3, N0,
M0 |
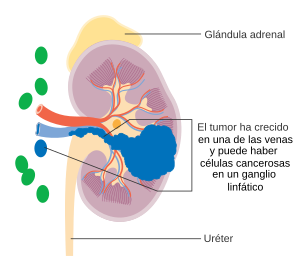
El tumor se extiende a las venas principales o al tejido perirrenal, pero no a la glándula suprarrenal ipsilateral ni más allá de la fascia de Gerota. |
| T3a, N0,
M0 |
El tumor se extiende macroscópicamente hacia la vena renal o sus ramas segmentarias, o el tumor invade el sistema pielocalicial, o el tumor invade la grasa perirrenal y/o del seno renal, pero no más allá de la fascia de Gerota. | |
| T3b, N0,
M0 |
El tumor se extiende macroscópicamente hacia la vena cava por debajo del diafragma. | |
| T3c, N0,
M0 |
El tumor se extiende macroscópicamente hacia la vena cava por encima del diafragma o invade la pared de la vena cava | |
| T1-T3,
N1, M0 |
El tumor principal puede tener cualquier tamaño y estar fuera del riñón, pero no se ha propagado más allá de la fascia de Gerota. El cáncer se ha propagado a los ganglios linfáticos regionales (N1), pero no a los ganglios linfáticos distantes ni a otros órganos (M0). | |
| IV | T4, cualquier
N, M0 |
El tumor invade más allá de la fascia de Gerota |
| cualquier T, cualquier N,
M1 |
El tumor se diseminó a los ganglios linfáticos distantes y/u otros órganos. |
Los pulmones son el sitio más común de metástasis,[32] con otros sitios comunes que incluyen hueso, cerebro, hígado, glándula suprarrenal y ganglios linfáticos distantes.[43][49][46]
-
Cáncer de riñón en etapa 1
-
Cáncer de riñón en etapa 2
-
Cáncer de riñón en etapa 3
-
Cáncer de riñón en etapa 4
Tratamiento[editar]
El tratamiento del cáncer de riñón depende del tipo y el estadio de la enfermedad. La cirugía es el tratamiento más habitual, ya que el cáncer de riñón no suele responder a la quimioterapia ni a la radioterapia. La complejidad quirúrgica puede estimarse mediante el sistema de puntuación de nefrometría RENAL. Si el cáncer no se ha extendido, suele extirparse mediante cirugía. En algunos casos esto implica la extirpación de todo el riñón, pero la mayoría de los tumores se pueden extirpar parcialmente para erradicar el tumor y preservar la parte normal restante del riñón. La cirugía no siempre es posible; por ejemplo, el paciente puede padecer otros problemas médicos que se lo impidan, o el cáncer puede haberse extendido por todo el cuerpo y los médicos no ser capaces de extirparlo.[50] Actualmente no hay pruebas de que el tratamiento médico de todo el cuerpo después de la cirugía cuando no hay enfermedad residual conocida, es decir, el tratamiento adyuvante, ayude a mejorar la supervivencia en el cáncer de riñón. Si el cáncer no puede tratarse con cirugía, pueden utilizarse otras técnicas, como la congelación del tumor o el tratamiento con altas temperaturas. Sin embargo, todavía no se utilizan como tratamientos estándar para el cáncer de riñón.[51]
Otras opciones de tratamiento incluyen terapias biológicas como everolimus, torisel, nexavar, sutent y axitinib, el uso de inmunoterapia que incluye interferón e interleucina-2 .[52][53][54] La inmunoterapia tiene éxito en 10 a 15% de las personas.[55] Sunitinib es el tratamiento de referencia actual en el entorno adyuvante junto con pazopanib; estos tratamientos suelen ir seguidos de everolimus, axitinib y sorafenib. Los inhibidores de puntos de control inmunitarios también se encuentran en ensayos para el cáncer de riñón y algunos han obtenido la aprobación para uso médico.[56]
En el entorno de segunda línea, nivolumab demostró una ventaja de supervivencia general en el carcinoma avanzado de células renales claras sobre everolimus en 2015 y fue aprobado por la FDA .[56][57] Cabozantinib también demostró un beneficio de supervivencia general sobre everolimus y fue aprobado por la FDA como tratamiento de segunda línea en 2016.[58][59] Lenvatinib en combinación con everolimus se aprobó en 2016 para pacientes que habían recibido exactamente una línea previa de terapia angiogénica.
En el tumor de Wilms, la quimioterapia, la radioterapia y la cirugía son los tratamientos aceptados, dependiendo del estadio de la enfermedad en el que se diagnostique.[60]
Niños[editar]
La mayoría de los cánceres de riñón registrados en niños son tumores de Wilms. Estos tumores pueden empezar a crecer cuando el feto aún se está desarrollando en el útero, y pueden no causar problemas hasta que el niño tiene algunos años. El tumor de Wilms es más frecuente en niños menores de 5 años, pero rara vez puede diagnosticarse en niños mayores o en adultos. Aún no está claro cuál es la causa de la mayoría de los tumores de Wilms. Los síntomas más frecuentes son hinchazón abdominal y sangre en la orina.[60]
Epidemiología[editar]
Cada año se diagnostican en el mundo unos 208.500 nuevos casos de cáncer de riñón, lo que representa algo menos del 2% de todos los cánceres.[61] Las tasas más altas se registran en Norteamérica y las más bajas en Asia y África.[62]
Factores de riesgo del estilo de vida
Ciertos factores del estilo de vida se han asociado con el desarrollo de cáncer renal, aunque no todos ellos pueden considerarse causas definitivas. Estos incluyen fumar, carcinógenos químicos, radiación, virus, dieta y obesidad, hipertensión, diuréticos,[14] y consumo de alcohol .[12] Solo un pequeño porcentaje de los casos de cáncer de riñón se han relacionado con factores genéticos.[12] Dado que la obesidad figura como uno de los factores de riesgo, se ha demostrado que la actividad física diaria y una dieta saludable reducen las tasas de cáncer de riñón en el futuro.[14]
Edad
La tasa de incidencia del cáncer renal aumenta con la edad de un individuo, siendo 75 años la edad aproximada de la tasa de incidencia máxima, a partir de 2018.[12] Sin embargo, casi la mitad de todos los casos se diagnostican antes de los 65 años.[12] Tanto en niños como en niñas, los tumores renales representan del 2% al 6% de los casos de cáncer de riñón, siendo el tumor de Wilms[14] el más común.
Sexo
La incidencia de cáncer de riñón es dos veces mayor en hombres que en mujeres, y se cree que esto se debe a diferencias biológicas. Las tasas de mortalidad suelen disminuir más rápidamente en las mujeres que en los hombres.[12]
Variaciones internacionales
Las tasas de incidencia del cáncer de riñón pueden variar en todo el mundo. A partir de 2018, la República Checa y Lituania tienen la tasa de incidencia más alta de cáncer de riñón en todo el mundo, con una tasa estandarizada por edad de 21,9/100 000 en hombres (República Checa) y 18,7/100 000 en hombres (Lituania). ) China, Tailandia y los países africanos (países de bajo riesgo) tienen una tasa de incidencia inferior a 2/100.000.[12]
Desde principios de la década de 2000, Austria y Polonia han sido los únicos países que informaron una disminución en las tasas de cáncer de riñón.[12] El sesgo de acceso al diagnóstico desempeña un papel importante en la epidemiología del cáncer de riñón. Es probable que las diferencias en el diagnóstico del cáncer de riñón entre regiones se deban a diferencias en el acceso a la asistencia sanitaria, más que a factores biológicos de la población. Las discrepancias en el diagnóstico del cáncer de riñón han conducido muy probablemente a la infrarrepresentación de la mortalidad y la incidencia en los países de renta baja.
Raza
La raza y la etnia pueden ser un factor en la distribución del cáncer de riñón en Estados Unidos. Existen tasas de incidencia más elevadas en hombres negros e hispanos, una tasa media en indios americanos y tasas bajas en asiáticos en Estados Unidos. Los negros con cáncer de riñón tienen tasas de mortalidad más bajas que los caucásicos en Estados Unidos[12]
Examen
La accesibilidad al cribado del cáncer no es muy común debido a los elevados gastos. La mejora de los registros de cáncer puede mejorar la atención a los enfermos de cáncer de riñón y reducir las tasas de incidencia y mortalidad. Un tratamiento seguro y fiable es clave para el cribado y el tratamiento, algo que no siempre ocurre en muchos países en vías de desarrollo.[63]
Estados Unidos[editar]
El NIH de Estados Unidos estimó para 2013 alrededor de 64.770 nuevos casos de cáncer de riñón y 13.570 muertes por la enfermedad.[64]
La incidencia de cáncer de riñón también está aumentando en los Estados Unidos. Se cree que esto es un aumento real, no solo debido a los cambios en la forma en que se diagnostica la enfermedad.[65]
Europa[editar]
Las estimaciones más recientes de incidencia de cáncer de riñón sugieren que hay 63.300 casos nuevos cada año en la UE25. En Europa, el cáncer de riñón representa casi el 3% de todos los casos de cáncer.[66] El cáncer de riñón es el octavo cáncer más común en el Reino Unido (alrededor de 10 100 personas fueron diagnosticadas con la enfermedad en 2011) y es la decimocuarta causa más común de muerte por cáncer (alrededor de 4300 personas murieron en 2012).[67]
Referencias[editar]
- ↑ a b c d e «Cancer of the Kidney and Renal Pelvis - Cancer Stat Facts». SEER. Consultado el 30 de mayo de 2019.
- ↑ a b c d e f «Renal Cell Cancer Treatment». National Cancer Institute. 2019. Consultado el 8 de junio de 2019.
- ↑ a b c d e f «Transitional Cell Cancer (Kidney/Ureter) Treatment». National Cancer Institute. 2019. Consultado el 8 de junio de 2019.
- ↑ a b c d e f «Wilms Tumor and Other Childhood Kidney Tumors Treatment». National Cancer Institute. 2019. Consultado el 8 de junio de 2019.
- ↑ Sommers, Marilyn S.; Fannin, Ehriel (2014). Diseases and Disorders: A Nursing Therapeutics Manual. F.A. Davis. p. 657. ISBN 9780803644878.
- ↑ «Kidney Cancer». National Cancer Institute. 2019. Consultado el 8 de junio de 2019.
- ↑ Mulders PF, Brouwers AH, Hulsbergen-van der Kaa CA, van Lin EN, Osanto S, de Mulder PH (February 2008). «[Guideline 'Renal cell carcinoma']». Ned Tijdschr Geneeskd (en neerlandés) 152 (7): 376-80. PMID 18380384.
- ↑ «Cancer today». IARC. Consultado el 30 de mayo de 2019.
- ↑ «Survival statistics for kidney cancer - Canadian Cancer Society». www.cancer.ca (en inglés). Consultado el 2 de diciembre de 2019.
- ↑ «European Network of Cancer Registeries».
- ↑ Zeng, Hongmei; Chen, Wanqing; Zheng, Rongshou; Zhang, Siwei; Ji, John S; Zou, Xiaonong; Xia, Changfa; Sun, Kexin et al. (2018). «Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries». The Lancet Global Health (en inglés) 6 (5): e555-e567. PMID 29653628. doi:10.1016/S2214-109X(18)30127-X.
- ↑ a b c d e f g h i Scelo, Ghislaine; Larose, Tricia L. (20 de diciembre de 2018). «Epidemiology and Risk Factors for Kidney Cancer». Journal of Clinical Oncology 36 (36): 3574-3581. ISSN 0732-183X. PMC 6299342. PMID 30372394. doi:10.1200/JCO.2018.79.1905.
- ↑ Padala, Sandeep Anand; Barsouk, Adam; Thandra, Krishna Chaitanya; Saginala, Kalyan; Mohammed, Azeem; Vakiti, Anusha; Rawla, Prashanth; Barsouk, Alexander (June 2020). «Epidemiology of Renal Cell Carcinoma». World Journal of Oncology 11 (3): 79-87. ISSN 1920-4531. PMC 7239575. PMID 32494314. doi:10.14740/wjon1279.
- ↑ a b c d Pascual, D.; Borque, A. (4 de noviembre de 2008). «Epidemiology of Kidney Cancer». Advances in Urology (en inglés) 2008: e782381. ISSN 1687-6369. PMC 2581742. PMID 19009036. doi:10.1155/2008/782381.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u Campbell MD, Ph.D, Steven C.; Lane MD, Ph.D, Brian R. (2012). «Malignant Renal Tumors». En Wein MD, Ph.D, Alan J.; Kavoussi MD, MBA, eds. Campbell-Walsh Urology. Elselvier. ISBN 978-1455775675.
- ↑ Hidayat, K; Du, X; Zou, SY; Shi, BM (July 2017). «Blood pressure and kidney cancer risk: meta-analysis of prospective studies.». Journal of Hypertension 35 (7): 1333-1344. PMID 28157813. doi:10.1097/HJH.0000000000001286.
- ↑ Professionals, Sumedia-Online. «EAU Guidelines: Renal Cell Carcinoma». Uroweb (en inglés estadounidense). Consultado el 3 de diciembre de 2019.
- ↑ Palapattu, Ganesh S.; Kristo, Blaine; Rajfer, Jacob (2002). «Paraneoplastic syndromes in urologic malignancy: the many faces of renal cell carcinoma». Reviews in Urology 4 (4): 163-170. ISSN 1523-6161. PMC 1475999. PMID 16985675.
- ↑ Tahbaz, Rana; Schmid, Marianne; Merseburger, Axel S. (2018). «Prevention of kidney cancer incidence and recurrence: lifestyle, medication and nutrition». Current Opinion in Urology 28 (1): 62-79. ISSN 1473-6586. PMID 29059103. doi:10.1097/MOU.0000000000000454.
- ↑ a b «Kidney Cancer - Risk Factors and Prevention». Cancer.Net (en inglés). 25 de junio de 2012. Consultado el 2 de diciembre de 2019.
- ↑ Cheungpasitporn, W; Thongprayoon C; O'Corragain OA; Edmonds PJ; Ungprasert P; Kittanamongkolchai W; Erickson SB (9 de septiembre de 2014). «The Risk of Kidney Cancer in Patients with Kidney Stones: A Systematic Review and Meta-analysis». QJM 108 (3): 205-12. PMID 25208892. doi:10.1093/qjmed/hcu195.
- ↑ «Risks and causes of kidney cancer». 30 de agosto de 2017.
- ↑ Hunt, Jay D.; van der Hel, Olga L.; McMillan, Garnett P.; Boffetta, Paolo; Brennan, Paul (10 de marzo de 2005). «Renal cell carcinoma in relation to cigarette smoking: meta-analysis of 24 studies». International Journal of Cancer 114 (1): 101-108. ISSN 0020-7136. PMID 15523697. doi:10.1002/ijc.20618.
- ↑ Sánchez-Martín, F. M.; Millán-Rodríguez, F.; Urdaneta-Pignalosa, G.; Rubio-Briones, J.; Villavicencio-Mavrich, H. (2008). «Small Renal Masses: Incidental Diagnosis, Clinical Symptoms, and Prognostic Factors». Advances in Urology 2008: 310694. ISSN 1687-6369. PMC 2629071. PMID 19165347. doi:10.1155/2008/310694.
- ↑ Motzer, Robert J.; Jonasch, Eric; Agarwal, Neeraj; Bhayani, Sam; Bro, William P.; Chang, Sam S.; Toni Choueiri; Costello, Brian A. et al. (1 de junio de 2017). «Kidney Cancer, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology». Journal of the National Comprehensive Cancer Network 15 (6): 804-834. ISSN 1540-1405. PMID 28596261. doi:10.6004/jnccn.2017.0100.
- ↑ Silverman, Stuart G.; Israel, Gary M.; Herts, Brian R.; Richie, Jerome P. (October 2008). «Management of the incidental renal mass». Radiology 249 (1): 16-31. ISSN 1527-1315. PMID 18796665. doi:10.1148/radiol.2491070783.
- ↑ «Cancer | Definition of Cancer by Lexico». Lexico Dictionaries | English. Archivado desde el original el 12 de noviembre de 2019. Consultado el 12 de noviembre de 2019.
- ↑ Israel, Gary M.; Bosniak, Morton A. (2005). «How I Do It: Evaluating Renal Masses». Radiology (en inglés) 236 (2): 441-450. ISSN 0033-8419. PMID 16040900. S2CID 1916092. doi:10.1148/radiol.2362040218.
- ↑ Silverman, Stuart G.; Pedrosa, Ivan; Ellis, James H.; Hindman, Nicole M.; Schieda, Nicola; Smith, Andrew D.; Remer, Erick M.; Shinagare, Atul B.; Curci, Nicole E.; Raman, Steven S.; Wells, Shane A. (18 de junio de 2019). «Bosniak Classification of Cystic Renal Masses, Version 2019: An Update Proposal and Needs Assessment». Radiology 292 (2): 475-488. ISSN 0033-8419. PMC 6677285. PMID 31210616. doi:10.1148/radiol.2019182646.
- ↑ a b c d e «Renal Cancer: Renal Mass & Localized Renal Cancer Guideline - American Urological Association». www.auanet.org. Archivado desde el original el 15 de febrero de 2020. Consultado el 29 de octubre de 2019.
- ↑ a b c d Motzer, Robert J.; Jonasch, Eric; Agarwal, Neeraj; Bhayani, Sam; Bro, William P.; Chang, Sam S.; Choueiri, Toni K.; Costello, Brian A. et al. (1 de junio de 2017). «Kidney Cancer, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology». Journal of the National Comprehensive Cancer Network 15 (6): 804-834. ISSN 1540-1405. PMID 28596261. doi:10.6004/jnccn.2017.0100.
- ↑ a b c d e «Renal Cancer: Renal Mass & Localized Renal Cancer Guideline - American Urological Association». www.auanet.org. Archivado desde el original el 15 de febrero de 2020. Consultado el 29 de octubre de 2019.
- ↑ a b Subramaniam, Rathan M.; Wilson, Renee F.; Turban, Sharon; Suarez-Cuervo, Catalina; Zhang, Allen; Sherrod, Cheryl; Aboagye, Jonathan; Eng, John et al. (2016). Contrast-Induced Nephropathy: Comparative Effectiveness of Preventive Measures. AHRQ Comparative Effectiveness Reviews. Rockville (MD): Agency for Healthcare Research and Quality (US). PMID 26866209.
- ↑ «Renal Cell Cancer Treatment (PDQ®)–Patient Version». National Cancer Institute. 20 de febrero de 2004. Consultado el 12 de noviembre de 2019.
- ↑ a b c «Transitional Cell Cancer of the Renal Pelvis and Ureter Treatment (PDQ®)–Patient Version». National Cancer Institute. 20 de febrero de 2004. Consultado el 12 de noviembre de 2019.
- ↑ Kuroda N, Katto K, Tamura M, Shiotsu T, Hes O, Michal M, Nagashima Y, Ohara M, Hirouchi T, Mizuno K, Hayashi Y, Lee GH (January 2008). «Carcinoid tumor of the renal pelvis: consideration on the histogenesis». Pathol. Int. 58 (1): 51-4. PMID 18067641. doi:10.1111/j.1440-1827.2007.02188.x.
- ↑ Chiu, KC; Lin, MC; Liang, YC; Chen, CY (2008). «Renal carcinosarcoma: case report and review of literature.». Renal Failure 30 (10): 1034-9. PMID 19016157. doi:10.1080/08860220802403192.
- ↑ Picozzi, Stefano; Casellato, Stefano; Bozzini, Giorgio; Ratti, Dario; Macchi, Alberto; Rubino, Barbara; Pace, Gianna; Carmignani, Luca (November 2013). «Inverted papilloma of the bladder: a review and an analysis of the recent literature of 365 patients». Urologic Oncology 31 (8): 1584-1590. ISSN 1873-2496. PMID 22520573. doi:10.1016/j.urolonc.2012.03.009.
- ↑ Lopez-Beltran, Antonio; Scarpelli, Marina; Montironi, Rodolfo; Kirkali, Ziya (May 2006). «2004 WHO classification of the renal tumors of the adults». European Urology 49 (5): 798-805. ISSN 0302-2838. PMID 16442207. doi:10.1016/j.eururo.2005.11.035.
- ↑ Thyavihally YB, Tongaonkar HB, Desai SB (September 2005). «Benign mixed epithelial stromal tumor of the renal pelvis with exophytic growth: case report». Int Semin Surg Oncol 2: 18. PMC 1215508. PMID 16150156. doi:10.1186/1477-7800-2-18.
- ↑ Mantilla JG, Antic T, Tretiakova M (2017). «GATA3 as a valuable marker to distinguish clear cell papillary renal cell carcinomas from morphologic mimics.». Hum Pathol 66: 152-158. PMID 28705707. doi:10.1016/j.humpath.2017.06.016.
- ↑ Behtash G. Nezami, M.D., Gregory MacLennan, M.D. «Kidney tumor - Adult renal cell carcinoma - common - Clear cell». Pathology Outlines. Topic Completed: 20 April 2021. Minor changes: 20 April 2021
- ↑ a b Motzer, Robert J.; Jonasch, Eric; Agarwal, Neeraj; Bhayani, Sam; Bro, William P.; Chang, Sam S.; Choueiri, Toni K.; Costello, Brian A. et al. (1 de junio de 2017). «Kidney Cancer, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology». Journal of the National Comprehensive Cancer Network 15 (6): 804-834. ISSN 1540-1405. PMID 28596261. doi:10.6004/jnccn.2017.0100.
- ↑ Patel, Hiten D.; Johnson, Michael H.; Pierorazio, Phillip M.; Sozio, Stephen M.; Sharma, Ritu; Iyoha, Emmanuel; Bass, Eric B.; Allaf, Mohamad E. (May 2016). «Diagnostic Accuracy and Risks of Biopsy in the Diagnosis of a Renal Mass Suspicious for Localized Renal Cell Carcinoma: Systematic Review of the Literature». The Journal of Urology 195 (5): 1340-1347. ISSN 1527-3792. PMC 5609078. PMID 26901507. doi:10.1016/j.juro.2015.11.029.
- ↑ «Kidney Cancer Stages | Renal Cell Carcinoma Staging». www.cancer.org. Consultado el 12 de noviembre de 2019.
- ↑ a b c d AJCC cancer staging manual. Edge, Stephen B., American Joint Committee on Cancer. (7th edición). New York: Springer. 2010. ISBN 9780387884400. OCLC 316431417.
- ↑ «Kidney Cancer Stages». cancer.org. Last Revised: February 1, 2020
- ↑ Swami, Umang; Nussenzveig, Roberto H.; Haaland, Benjamin; Agarwal, Neeraj (2019). «Revisiting AJCC TNM staging for renal cell carcinoma: quest for improvement». Annals of Translational Medicine 7 (S1): S18. ISSN 2305-5839. PMC 6462602. PMID 31032299. doi:10.21037/atm.2019.01.50.
- ↑ «Kidney Cancer (Adult) – Renal Cell Carcinoma». American Cancer Society. Archivado desde el original el 22 de febrero de 2017. Last Revised: May 16, 2016
- ↑ «Early stage and locally advanced kidney cancer treatment». 30 de agosto de 2017.
- ↑ «Advanced kidney cancer». 30 de agosto de 2017.
- ↑ «Renal cell carcinoma | HemOnc.org - A Hematology Oncology Wiki». hemonc.org.
- ↑ «National Comprehensive Cancer Network».
- ↑ «Biological therapy for kidney cancer». 30 de agosto de 2017.
- ↑ Jonasch, Eric (August 2012). «CancerCare Connect – Treatment Update: Kidney Cancer». Cancer Care, Inc. Archivado desde el original el 25 de septiembre de 2011. Consultado el 29 de agosto de 2012.
- ↑ a b Syn, Nicholas L; Teng, Michele W L; Mok, Tony S K; Soo, Ross A (2017). «De-novo and acquired resistance to immune checkpoint targeting». The Lancet Oncology 18 (12): e731-e741. PMID 29208439. doi:10.1016/s1470-2045(17)30607-1.
- ↑ «FDA approves Opdivo to treat advanced form of kidney cancer». Food and Drug Administration.
- ↑ Philips, GK; Atkins, MB (2014). «New agents and new targets for renal cell carcinoma.». American Society of Clinical Oncology Educational Book / ASCO. American Society of Clinical Oncology. Meeting 34 (34): e222-7. PMID 24857106. doi:10.14694/EdBook_AM.2014.34.e222.
- ↑ «Drugs@FDA: FDA Approved Drug Products».
- ↑ a b «Wilms' tumour (kidney cancer in children)». 30 de agosto de 2017. Archivado desde el original el 6 de abril de 2012.
- ↑ Lindblad, P. and Adami H.O, Kidney Cancer, in Textbook of Cancer.
- ↑ GLOBOCAN 2002, Cancer Incidence, Mortality and Prevalence Worldwide 2002 estimates. 2006.
- ↑ Klaassen, Zachary; Sayyid, Rashid K.; Wallis, Christopher J.D. (2019). «Lessons Learned from the Global Epidemiology of Kidney Cancer: A Refresher in Epidemiology 101». European Urology (en inglés) 75 (1): 85-87. PMID 30274700. doi:10.1016/j.eururo.2018.09.035.
- ↑ «Cancer of the Kidney and Renal Pelvis – SEER Stat Fact Sheets». National Cancer Institute, U.S. National Institutes of Health. Consultado el 7 de febrero de 2013.
- ↑ Lynch, Charles F.; West, Michele M.; Davila, Jessica A.; Platz, Charles E. (2007). «Chapter 24: Cancers of the Kidney and Renal Pelvic». En Ries, LAG; Young, JL, eds. SEER Survival Monograph: Cancer Survival Among Adults: US SEER Program, 1988–2001, Patient and Tumor Characteristics. SEER Program. NIH Pub. No. 07-6215. Bethesda, MD: National Cancer Institute. pp. 193-202. Archivado desde el original el 10 de octubre de 2013. Consultado el 7 de febrero de 2023.
- ↑ Ferlay J, etal (2007). «Estimates of the cancer incidence and mortality in Europe in 2006». Annals of Oncology 18 (3): 581-92. PMID 17287242. doi:10.1093/annonc/mdl498.
- ↑ «Kidney cancer statistics». Cancer Research UK. Consultado el 27 de octubre de 2014.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Kidney cancer» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.