Células B de memoria
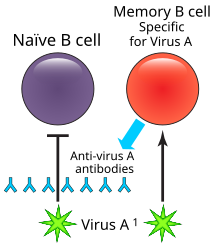
Las células B de memoria o linfocitos B de memoria son un subtipo de células B que se forman dentro de los centros germinales después de la infección primaria y son importantes para generar una respuesta inmunitaria mediada por anticuerpos más robusta y acelerada en el caso de reinfección (también conocida como respuesta inmunitaria secundaria).[1][2]
Respuesta primaria[editar]
Durante una infección inicial (o respuesta inmune primaria) que involucra un antígeno T-dependiente, las células B foliculares inexpertas se activan en presencia de células TFH dentro de los folículos de órganos linfoides secundarios (es decir, bazo y ganglios linfáticos ) y se someten a expansión clonal para producir Un foco de células B que son específicas para el antígeno. La mayoría de estos clones se diferencian en las células plasmáticas, también llamadas células efectoras B que producen una primera ola de anticuerpos protectores y ayudan a eliminar la infección, pero una fracción persiste como células de memoria latentes que sobreviven en el cuerpo a largo plazo después de tener Pasó por una reacción del centro germinal altamente mutativa y selectiva.[3] Las células B activadas que no logran someterse a una diferenciación del centro germinal no persisten como células B de memoria efectivas y se seleccionan negativamente de forma rápida.
Dentro de los centros germinales, las células B proliferan y mutan la región genética que codifica su anticuerpo de superficie (también conocida como inmunoglobulina). El proceso se denomina hipermutación somática y es responsable de introducir mutaciones espontáneas con una frecuencia de aproximadamente 1 en cada división de 1600 células (una frecuencia relativamente alta considerando la baja frecuencia de mutación de otras células del cuerpo siendo 1 en 106 divisiones celulares). Luego, después de obtener un número establecido de mutaciones, las células B del centro germinal se someten a una ronda de selección por parte de las células TFH. Los clones de células B que han mutado y ganado una inmunoglobulina de superficie de afinidad más alta que reconocen mejor el antígeno reciben señales de supervivencia dependientes del contacto celular al interactuar con sus células TFH cognadas[4] y continúan a uno de los tres destinos: (i) diferenciarse en células plasmáticas que han mejorado la afinidad hacia el antígeno (por lo tanto, son más eficientes que su generación anterior de células plasmáticas para eliminar la infección), (ii) las células B de memoria maduradas por afinidad o (iii) se retienen en el centro germinal para volver a ingresar a otra ronda de mutativas Replicación y selección dependiente de células TFH. Por lo tanto, a medida que avanza una infección, se encuentra que las células B de memoria seleccionadas en las etapas posteriores de la respuesta del centro germinal acumularon el mayor número de eventos de mutación de inmunoglobulina con afinidad superior hacia su antígeno específico. A la inversa, durante el curso de una reacción en el centro germinal, los clones de células del centro B germinal de afinidad baja o potencialmente reactivos, o aquellos que han adquirido mutaciones no funcionales son superados por los clones de afinidad más alta y eventualmente se someten a apoptosis celular.
Respuesta secundaria y memoria[editar]
Con cada exposición posterior al mismo antígeno, el número de diferentes clones de células B que responden aumenta para generar una respuesta policlonal y, de hecho, persiste un mayor número de células B de memoria. Por lo tanto, una respuesta de anticuerpos más fuerte (es decir, títulos más altos de moléculas de anticuerpos más diversas) que tienen afinidad mejorada hacia el antígeno se observa típicamente en la respuesta inmune secundaria. No está claro en qué etapa ese modelo alcanza la saturación para proporcionar un nivel óptimo de protección inmunitaria mediada por anticuerpos contra el mismo antígeno. Sin embargo, el hecho de que toda la acumulación de células de una sola población de clones exprese muchos de los mismos tipos de anticuerpos y que estas células B de memoria sobrevivan por largos períodos de tiempo en un cuerpo subraya su importancia funcional durante la vacunación y la administración de refuerzo disparados por medio de las vacunas
Habilidades de las células de memoria B[editar]
Una habilidad típica es la supervivencia duradera en la quiescencia; esto puede durar decenas de años en humanos.[5] Después de reencontrarse con el antígeno específico, pueden reactivarse muy rápidamente, propagarse a sí mismos, crear células plasmáticas y volver a entrar en los centros germinales para mejorar la afinidad de sus anticuerpos. Gracias a esto, cada respuesta inmune secundaria es más fuerte que la primaria.[6][7]
La capacidad de proliferar y crear una población de células B completa específica para el antígeno se denomina a veces como una entidad madre de células B de memoria. Parece que las células B de memoria IgM+ son las mejores en esto (no han cambiado de clase su BCR).[6]
La supervivencia prolongada depende de los cambios metabólicos y el bloqueo de la apoptosis. La presencia de células dendríticas foliculares (FDC) y la señalización tónica a través de BCR (estímulos básicos de BCR independientes sobre antígeno específico) son necesarias. Estos inducen la expresión de genes antiapoptóticos en las células B. El antígeno específico no tiene que estar presente para mantener las células B de memoria, ni las células T son necesarias.[6]
Una respuesta fuerte y rápida podría ser el resultado de un BCR conmutado. Algunos isotipos tienen una parte citoplásmica que puede indicar la presencia de células B, principalmente se estudió con IgG1. El dominio citoplasmático de IgG1 puede interactuar con los componentes de la cascada MAPK y así potenciar la señalización cuando se reconoce el antígeno. Además, el historial de estimulación de las células B de memoria es crítico, ya que la célula B ha cambiado los niveles de los factores de transcripción y el umbral de estimulación es más alto, más fácil de superar.[6]
La reactivación de la célula B de memoria depende de la interacción con su memoria cognitiva TFH. Ambos tipos de células están presentes en tejidos linfáticos secundarios en el folículo B y, por lo tanto, pueden interactuar rápidamente, cuando está presente un antígeno específico. La interacción funciona probablemente en ambos lados: primero, la célula B funciona como una célula presentadora de antígeno y activa la TFH, la segunda TFH activada activa la célula B de la memoria. El papel importante también tiene FDC, que rápidamente atrapa los antígenos entrantes y los almacena en su superficie para las células B, principalmente cuando el antígeno está en el complejo inmune.[6]
La reacción del centro germinal de reingreso es típica principalmente para las células B de memoria IgM+. Los centros germinales a veces permanecen funcionales incluso después del final de la respuesta inmune primaria, luego las células B de memoria pueden unirse nuevamente. Pueden pasar por el cambio de isotipo y la hipermutación somática y luego diferenciarse en células plasmáticas. Otro mecanismo que puede mejorar la afinidad de los anticuerpos de memoria es la necesidad de la ayuda de las TFH en el proceso de reactivación. Esto selecciona células B de memoria con BCR de alta afinidad.[6]
Marcadores de células B de memoria[editar]
Marcador de superficie típico en humanos es CD27. También se puede detectar el tipo de su BCR. El BCR generalmente se cambia en las células B de la memoria, lo que significa que no es IgD o IgM.[7][5] Pero también existen células B de memoria IgM+ y tienen habilidades especiales: son similares a las células B inexpertas, proliferan mucho después de re-encontrar el antígeno y generalmente vuelven a entrar en la reacción del centro germinal.[6] Las IgG+ y las células B de memoria IgA+ se pueden encontrar en los seres humanos.[6]
Por otro lado, las células B de memoria IgE+ no se han detectado in vivo. Si existen, entonces lo son en cantidades muy pequeñas. Los anticuerpos IgE de memoria son más probablemente producidos por las células B de memoria IgG+, que encuentran un cambio de isotipo nuevamente en la respuesta inmune secundaria.[6] Estos pueden producir IgE de alta afinidad, que es la esencia de las enfermedades alérgicas.[8]
Otros tipos de células B de memoria[editar]
No todas las células B de memoria se crean en la reacción del centro germinal. También podemos encontrar células B de memoria independientes en centros germinales y células B de memoria independientes en absoluto de ayuda de células T.
Células de memoria B independientes de los centros germinales[editar]
Estas células se diferencian de las células B activadas antes de que entren en la reacción del centro germinal. Su BCR tiene menor afinidad con el antígeno y, por lo tanto, la interacción con Tfh es más débil que en las células B de memoria clásica. Esto se debe a que Tfh interactúa con una célula B a través de su complejo de glicoproteína-péptido MHCII. El péptido proviene del antígeno capturado por BCR; por lo tanto, la afinidad más débil de BCR con el antígeno, los complejos menos péptido-MHCII en las células B, la ayuda menos Tfh (interacción CD40L y citoquinas). La falta de ayuda de Tfh no da lugar a la creación de un centro germinal por esta célula B.[9][6] Algunas veces pueden cambiar el isotipo del anticuerpo, pero nunca encuentran hipermutación somática. Como resultado, se mantienen con una baja afinidad con el antígeno, lo que puede ser realmente beneficioso: nuestro cuerpo los mantiene como una copia de seguridad de patógenos solo similares a los que provocaron la primera reacción inmunitaria.[10][6]
Células B de memoria T-independientes[editar]
Estas son en realidad células de memoria B1. Las células B1 son células B, que no necesitan ninguna ayuda de células T en la activación. Producen los llamados anticuerpos IgM innatos. Estos anticuerpos reconocen generalmente los azúcares, que tienen epítopos polivalentes y, por lo tanto, pueden reticular los BCR lo suficiente como para provocar una fuerte señal de activación en una célula B. Estos azúcares pueden tener origen no propio y propio. La auto-reconocimiento de IgM puede ser útil en la opsonización de células apoptóticas y su eliminación por fagocitosis.[11]
Las células de memoria B1 se mantienen en el peritoneo, aquí se pueden activar después del encuentro repetido del antígeno. Pero a diferencia de las células de memoria B2 clásicas, no tienen habilidades especiales para provocar una respuesta más fuerte y más rápida. La memoria se crea solo por un número inicial mayor de clones B1 específicos de antígeno.[6]
Véase también[editar]
Referencias[editar]
- ↑ Airoldi, I. (1 de enero de 2004). «Heterogeneous Expression of Interleukin-18 and Its Receptor in B-Cell Lymphoproliferative Disorders Deriving from Naive, Germinal Center, and Memory B Lymphocytes». Clinical Cancer Research (en inglés) 10 (1): 144-154. ISSN 1078-0432. doi:10.1158/1078-0432.CCR-1026-3.
- ↑ Lang, Mark L (2009-08). «How do natural killer T cells help B cells?». Expert Review of Vaccines (en inglés) 8 (8): 1109-1121. ISSN 1476-0584. doi:10.1586/erv.09.56.
- ↑ Gatto D.; Brink R. (Nov 2010). «The germinal center reaction.». Journal of Allergy and Clinical Immunology 126: 898-907; quiz 908-9. PMID 21050940. doi:10.1016/j.jaci.2010.09.007.
- ↑ Victora, Gabriel D.; Nussenzweig, Michel C. (23 de abril de 2012). «Germinal Centers». Annual Review of Immunology (en inglés) 30 (1): 429-457. ISSN 0732-0582. doi:10.1146/annurev-immunol-020711-075032.
- ↑ a b Hauser, Anja E.; Höpken, Uta E. (2015), «B Cell Localization and Migration in Health and Disease», Molecular Biology of B Cells (Elsevier): 187-214, ISBN 9780123979339, doi:10.1016/b978-0-12-397933-9.00012-6, consultado el 10 de junio de 2018.
- ↑ a b c d e f g h i j k l Kurosaki, Tomohiro; Kometani, Kohei; Ise, Wataru (13 de febrero de 2015). «Memory B cells». Nature Reviews Immunology (en inglés) 15 (3): 149-159. ISSN 1474-1733. doi:10.1038/nri3802.
- ↑ a b Murphy, Kenneth (Kenneth M.),. Janeway's immunobiology (Ninth edition edición). ISBN 978-0-8153-4505-3. OCLC 933586700. Consultado el 26 de agosto de 2020.
- ↑ Gould, Hannah J.; Sutton, Brian J. (March 2008). «IgE in allergy and asthma today». Nature Reviews Immunology (en inglés) 8 (3): 205-217. ISSN 1474-1733. doi:10.1038/nri2273.
- ↑ Shinnakasu, Ryo; Kurosaki, Tomohiro (April 2017). «Regulation of memory B and plasma cell differentiation». Current Opinion in Immunology 45: 126-131. ISSN 0952-7915. doi:10.1016/j.coi.2017.03.003.
- ↑ Pupovac, Aleta; Good-Jacobson, Kim L (April 2017). «An antigen to remember: regulation of B cell memory in health and disease». Current Opinion in Immunology 45: 89-96. ISSN 0952-7915. doi:10.1016/j.coi.2017.03.004.
- ↑ Montecino-Rodriguez, Encarnacion; Dorshkind, Kenneth (January 2012). «B-1 B Cell Development in the Fetus and Adult». Immunity 36 (1): 13-21. ISSN 1074-7613. PMC 3269035. PMID 22284417. doi:10.1016/j.immuni.2011.11.017.
