Canal de potasio

En biología celular, los canales de potasio son el tipo más común de canal iónico y están presentes en prácticamente todos los organismos vivos.[1] Forman poros que atraviesan las membranas celulares y son selectivos para los iones de potasio. Se encuentran en la mayoría de los tipos de células y controlan una amplia gama de funciones celulares.[2][3]
Función[editar]
Los canales de potasio permiten el paso rápido y selectivo de iones de potasio según un gradiente electroquímico. Desde el punto de vista biológico, estos canales tienen la función de mantener o restaurar el potencial de reposo en muchas células. En las células excitables, como las neuronas, la salida de iones de potasio da forma al potencial de acción.[4]
Dado que contribuyen a la regulación del potencial de acción del músculo cardíaco, el mal funcionamiento de los canales de potasio puede provocar arritmias. Los canales de potasio también participan en el mantenimiento del tono vascular y regulan los procesos celulares, como la secreción de hormonas (por ejemplo, la liberación de insulina de las células beta del páncreas); por esta razón, su mal funcionamiento puede conducir a enfermedades como la diabetes.
Tipos[editar]
Hay cuatro clases principales de canales de potasio:
- Canales de potasio activados por calcio, que se abren en presencia de iones de calcio u otras moléculas señal.
- Canales de potasio rectificadores entrantes, en los que la corriente (carga positiva) pasa con mayor facilidad al interior de la celda.
- Canales de potasio en tándem, que son constitutivamente abiertos y responsables del potencial de reposo de las células.
- Canales de potasio activados por voltaje, que son canales iónicos activados por voltaje que se abren o cierran en respuesta a cambios en el voltaje transmembrana.
| Clase | Subclases | Función | Bloqueadores | Activadores |
|---|---|---|---|---|
| Canales activados por el calcio 6TM & 1P |
|
|
|
|
| Canales rectificadores entrantes 2TM & 1P |
|
|
|
|
|
|
|
| |
|
|
| ||
| Canales en tándem 4TM & 2P |
|
|||
| Canales activados por voltaje 6TM & 1P |
|
|
|
|
Estructura[editar]

Los canales de potasio tienen una estructura tetramérica en la que cuatro subunidades de proteínas idénticas se combinan para formar un complejo dispuesto alrededor de un poro iónico central (un homotetrámero). Alternativamente, cuatro subunidades de proteínas similares pero no idénticas pueden asociarse para formar complejos heterotetraméricos. Todas las subunidades del canal de potasio tienen una estructura distintiva (P-loop) que se encuentra en la parte superior del poro y es responsable de la permeabilidad selectiva al potasio.
Más de 80 genes codifican subunidades del canal de potasio en mamíferos. Sin embargo, los canales de potasio más estudiados para la estructura molecular son los de las bacterias. Mediante cristalografía de rayos X, se obtuvo información sobre cómo los iones de potasio pasan a través de estos canales y por qué no lo hacen los iones de sodio.[24][25][26] El Premio Nobel de Química de 2003 fue otorgado a Rod MacKinnon por su trabajo pionero en esta área.[27]
Filtro de selectividad[editar]
Los canales de iones de potasio eliminan la capa de hidratación del ión cuando ingresa al filtro de selectividad. El filtro de selectividad está formado por una secuencia de cinco residuos, TVGYG, dentro del P-loop de cada subunidad. Esta secuencia está muy conservada, con la excepción de que un residuo de isoleucina de los canales iónicos eucariotas a menudo se reemplaza con un residuo de valina en los procariotas. La secuencia en el P-loop adopta una estructura única, con los átomos de oxígeno del carbonilo electronegativo alineados hacia el centro del poro del filtro para formar un antiprisma cuadrado que solvata agua alrededor de cada punto de unión de potasio.[28]
Región hidrofóbica[editar]
Esta región se utiliza para neutralizar el entorno alrededor del ión potasio para que no sea atraído por otras cargas. Además, acelera la reacción.
Cavidad central[editar]
Un poro central, de 10 Å de ancho, está ubicado cerca del centro del canal transmembranal, donde la barrera de energía es más alta para el ion transversal debido a la hidrofobia de la pared del canal. La cavidad llena de agua y el extremo C-terminal polar de las hélices de los poros facilitan la barrera energética para el ion. Se cree que la repulsión por preceder a múltiples iones de potasio ayuda al rendimiento de los iones. La presencia de la cavidad puede entenderse intuitivamente como uno de los mecanismos del canal para superar la barrera dieléctrica, o la repulsión por la membrana de bajo dieléctrico, manteniendo el ion K+ en un ambiente acuoso y altamente dieléctrico.
Regulación[editar]
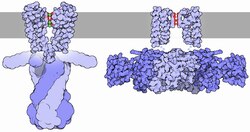
El flujo de iones a través del poro del canal de potasio está regulado por dos procesos: activación e inactivación. La activación es la apertura o cierre del canal en respuesta a estímulos, mientras que la inactivación es el cese del flujo de corriente desde el canal de potasio abierto, junto con la pérdida de la capacidad del canal para reanudar la conducción. Estos procesos sirven para regular la conductancia del canal, y cada uno de ellos puede estar mediado por diferentes mecanismos.
Generalmente, la activación está mediada por dominios estructurales adicionales que detectan estímulos y abren el poro del canal. Estos dominios responden a los estímulos abriendo físicamente la puerta intracelular del poro, permitiendo que los iones de potasio atraviesen la membrana. Algunos canales tienen múltiples dominios reguladores o proteínas accesorias, que pueden modular la respuesta al estímulo. Los mecanismos son todavía un tema de debate, pero se conocen estructuras para varios de estos dominios reguladores, por ejemplo, los sectores RCK de canales procarióticos[29][30][31] y eucarióticos.[32][33][34]
La inactivación se produce con el mecanismo conocido como modelo "bola y cadena".[35] La inactivación implica la interacción del extremo N del canal, o una proteína asociada, con el poro y da como resultado su oclusión. Alternativamente, se piensa que la inactivación puede ocurrir dentro del propio filtro de selectividad, donde los cambios estructurales lo harían no conductor.
Farmacología[editar]
Bloqueadores[editar]
Los bloqueadores de los canales de potasio inhiben el flujo de iones de potasio a través del canal. Compiten con el potasio en el filtro de selectividad o se unen fuera del filtro ocluyendo la conducción de iones. Un ejemplo de bloqueadores son los cationes de amonio cuaternario, que se unen en el lado extracelular o en la cavidad central del canal.[36][37][38] Dado que los iones de amonio cuaternario bloquean la cavidad central, también se conocen como bloqueadores de canales abiertos, porque el bloqueo requiere la apertura previa de la puerta citoplasmática.[39]
Los iones bario pueden bloquear las corrientes del canal de potasio,[40][41] uniéndose con alta afinidad dentro del filtro de selectividad.[42][43][44][45] Se cree que de este vínculo estrecho subyace a la toxicidad del bario, que inhibe la actividad del canal de potasio en las células excitables.
En terapia, los bloqueadores de los canales de potasio, como la 4-Aminopiridina y la 3,4-diaminopiridina se han estudiado para el tratamiento de afecciones como la esclerosis múltiple.[46] Al actuar sobre los canales de potasio del corazón, estas moléculas pueden producir efectos secundarios que conducen a Síndrome del QT largo, una afección potencialmente mortal. Como resultado, todos los medicamentos nuevos se prueban preclínicamente para determinar la seguridad cardíaca.
Activadores[editar]
Existen diversos medicamentos que facilitan la transmisión de iones a través de los canales de potasio. Algunos ejemplos son: Diazóxido, un vasodilatador utilizado para la hipertensión, relajación del músculo liso; el Minoxidil un vasodilatador usado para tratar la hipertensión y la caída del cabello; el Pinacidil; la Retigabina, un anticonvulsivo; o la Flupirtina, un analgésico y relajante muscular con propiedades anticonvulsivas.
Véase también[editar]
Referencias[editar]
- ↑ Littleton JT, Ganetzky B (April 2000). «Ion channels and synaptic organization: analysis of the Drosophila genome». Neuron 26 (1): 35-43. PMID 10798390. S2CID 5694563. doi:10.1016/S0896-6273(00)81135-6.
- ↑ Hille, Bertil (2001). «Chapter 5: Potassium Channels and Chloride Channels». Ion channels of excitable membranes. Sunderland, Mass: Sinauer. pp. 131–168. ISBN 978-0-87893-321-1.
- ↑ Jessell, Thomas M.; Kandel, Eric R.; Schwartz, James H. (2000). «Chapter 6: Ion Channels». Principles of Neural Science (4ª edición). New York: McGraw-Hill. pp. 105–124. ISBN 978-0-8385-7701-1.
- ↑ Lim, Carmay; Dudev, Todor (2016). «Chapter 10. Potassium Versus Sodium Selectivity in Monovalent Ion Channel Selectivity Filters». En Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel, eds. The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences 16. Springer. pp. 325-347. PMID 26860305. doi:10.1007/978-3-319-21756-7_9.
- ↑ Rang, HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. p. 60. ISBN 0-443-07145-4.
- ↑ Kobayashi T, Washiyama K, Ikeda K (Mar 2006). «Inhibition of G protein-activated inwardly rectifying K+ channels by ifenprodil». Neuropsychopharmacology 31 (3). pp. 516-24. PMID 16123769.
- ↑ a b c d e f Enyedi P, Czirják G (Apr 2010). «Molecular background of leak K+ currents: two-pore domain potassium channels». Physiological Reviews 90 (2): 559-605. PMID 20393194.
- ↑ a b c d e f Lotshaw DP (2007). «Biophysical, pharmacological, and functional characteristics of cloned and native mammalian two-pore domain K+ channels». Cell Biochemistry and Biophysics 47 (2): 209-56. PMID 17652773.
- ↑ Fink M, Lesage F, Duprat F, Heurteaux C, Reyes R, Fosset M, Lazdunski M (Jun 1998). «A neuronal two P domain K+ channel stimulated by arachidonic acid and polyunsaturated fatty acids». The EMBO Journal 17 (12): 3297-308. PMC 1170668. PMID 9628867.
- ↑ Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N (Mar 2001). «Potassium leak channels and the KCNK family of two-P-domain subunits». Nature Reviews. Neuroscience 2 (3): 175-84. PMID 11256078.
- ↑ Sano Y, Inamura K, Miyake A, Mochizuki S, Kitada C, Yokoi H, Nozawa K, Okada H, Matsushime H, Furuichi K (Jul 2003). «A novel two-pore domain K+ channel, TRESK, is localized in the spinal cord». The Journal of Biological Chemistry 278 (30): 27406-12. PMID 12754259.
- ↑ Czirják G, Tóth ZE, Enyedi P (Apr 2004). «The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin». The Journal of Biological Chemistry 279 (18): 18550-8. PMID 14981085.
- ↑ Kindler CH, Yost CS, Gray AT (Abril 1999). «Local anesthetic inhibition of baseline potassium channels with two pore domains in tandem». Anesthesiology 90 (4): 1092-102. PMID 10201682.
- ↑ a b c Meadows HJ, Randall AD (Mar 2001). «Functional characterisation of human TASK-3, an acid-sensitive two-pore domain potassium channel». Neuropharmacology 40 (4): 551-9. PMID 11249964.
- ↑ Kindler CH, Paul M, Zou H, Liu C, Winegar BD, Gray AT, Yost CS (Jul 2003). «Amide local anesthetics potently inhibit the human tandem pore domain background K+ channel TASK-2 (KCNK5)». The Journal of Pharmacology and Experimental Therapeutics 306 (1): 84-92. PMID 12660311.
- ↑ Punke MA, Licher T, Pongs O, Friederich P (Jun 2003). «Inhibition of human TREK-1 channels by bupivacaine». Anesthesia and Analgesia 96 (6): 1665-73. PMID 12760993.
- ↑ Lesage F, Guillemare E, Fink M, Duprat F, Lazdunski M, Romey G, Barhanin J (Mar 1996). «TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure». The EMBO Journal 15 (5): 1004-11. PMC 449995. PMID 8605869.
- ↑ Duprat F, Lesage F, Fink M, Reyes R, Heurteaux C, Lazdunski M (Sep 1997). «TASK, a human background K+ channel to sense external pH variations near physiological pH». The EMBO Journal 16 (17): 5464-71. PMC 1170177. PMID 9312005.
- ↑ Reyes R, Duprat F, Lesage F, Fink M, Salinas M, Farman N, Lazdunski M (Nov 1998). «Cloning and expression of a novel pH-sensitive two pore domain K+ channel from human kidney». The Journal of Biological Chemistry 273 (47): 30863-9. PMID 9812978.
- ↑ Meadows HJ, Benham CD, Cairns W, Gloger I, Jennings C, Medhurst AD, Murdock P, Chapman CG (Abr 2000). «Cloning, localisation and functional expression of the human orthologue of the TREK-1 potassium channel». Pflügers Archiv 439 (6): 714-22. PMID 10784345.
- ↑ Patel AJ, Honoré E, Lesage F, Fink M, Romey G, Lazdunski M (May 1999). «Inhalational anesthetics activate two-pore-domain background K+ channels». Nature Neuroscience 2 (5): 422-6. PMID 10321245.
- ↑ Gray AT, Zhao BB, Kindler CH, Winegar BD, Mazurek MJ, Xu J, Chavez RA, Forsayeth JR, Yost CS (Jun 2000). «Volatile anesthetics activate the human tandem pore domain baseline K+ channel KCNK5». Anesthesiology 92 (6): 1722-30. PMID 10839924.
- ↑ Rogawski MA, Bazil CW (Jul 2008). «New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels». Current Neurology and Neuroscience Reports 8 (4): 345-52. PMC 2587091. PMID 18590620.
- ↑ Doyle, D. A.; Morais Cabral, J.; Pfuetzner, R. A. (3 de abril de 1998). «The structure of the potassium channel: molecular basis of K+ conduction and selectivity». Science (New York, N.Y.) 280 (5360): 69-77.
- ↑ MacKinnon, R.; Cohen, S. L.; Kuo, A. (3 de abril de 1998). «Structural conservation in prokaryotic and eukaryotic potassium channels». Science (New York, N.Y.) 280 (5360): 106-109.
- ↑ Armstrong, C. (3 de abril de 1998). «The vision of the pore». Science (New York, N.Y.) 280 (5360): 56-57.
- ↑ «The Nobel Prize in Chemistry 2003».
- ↑ Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (1 de marzo de 2006). «A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study». Biophysical Chemistry 120 (1): 1-9.
- ↑ Jiang, Youxing; Lee, Alice; Chen, Jiayun (30 de mayo de 2002). «Crystal structure and mechanism of a calcium-gated potassium channel». Nature 417 (6888): 515-522.
- ↑ Kong, Chunguang; Zeng, Weizhong; Ye, Sheng (13 de diciembre de 2012). «Distinct gating mechanisms revealed by the structures of a multi-ligand gated K(+) channel». eLife 1: e00184.
- ↑ Cao, Yu; Jin, Xiangshu; Huang, Hua (17 de marzo de 2011). «Crystal structure of a potassium ion transporter, TrkH». Nature 471 (7338): 336-340.
- ↑ Pico, Peng; Leonetti, Manuel D. (9 de julio de 2010). «Structure of the Human BK Channel Ca2+-Activation Apparatus at 3.0 Å Resolution». Science (New York, N.Y.) 329 (5988): 182-186.
- ↑ Wu, Yunkun; Yang, Yi; Ye, Sheng. «Structure of the gating ring from the human large-conductance Ca2+-gated K+ channel». Nature 466 (7304): 393-397.
- ↑ Jiang, Y.; Pico, A.; Cadene, M. (1 de marzo de 2001). «Structure of the RCK domain from the E. coli K+ channel and demonstration of its presence in the human BK channel». Neuron 29 (3): 593-601.
- ↑ Antz, Christoph; Fakler, Bernd (1 de agosto de 1998). «Fast Inactivation of Voltage-Gated K(+) Channels: From Cartoon to Structure». News in Physiological Sciences: An International Journal of Physiology Produced Jointly by the International Union of Physiological Sciences and the American Physiological Society 13: 177-182.
- ↑ Luzhkov, V. B.; Åqvist, J. (14 de febrero de 2005). «Ions and blockers in potassium channels: insights from free energy simulations». Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1747 (1): 109-120.
- ↑ Luzhkov, Victor B.; Osterberg, Fredrik; Aqvist, Johan (6 de noviembre de 2003). «Structure-activity relationship for extracellular block of K+ channels by tetraalkylammonium ions». FEBS letters 554 (1-2): 159-164.
- ↑ Posson, David J.; McCoy, Jason G.; Nimigean, Crina M. (1 de febrero de 2013). «The voltage-dependent gate in MthK potassium channels is located at the selectivity filter». Nature Structural & Molecular Biology 20 (2): 159-166.
- ↑ Choi, K. L.; Mossman, C.; Aubé, J. (1 de marzo de 1993). «The internal quaternary ammonium receptor site of Shaker potassium channels». Neuron 10 (3): 533-541.
- ↑ Piasta, Kene N.; Theobald, Douglas L.; Miller, Christopher (1 de octubre de 2011). «Potassium-selective block of barium permeation through single KcsA channels». The Journal of General Physiology 138 (4): 421-436.
- ↑ Neyton, J.; Miller, C. (1 de noviembre de 1988). «Potassium blocks barium permeation through a calcium-activated potassium channel». The Journal of General Physiology 92 (5): 549-567.
- ↑ Lockless, Steve W.; Zhou, Ming; MacKinnon, Roderick (1 de mayo de 2007). «Structural and thermodynamic properties of selective ion binding in a K+ channel». PLoS biology 5 (5): e121.
- ↑ Jiang, Y.; MacKinnon, R. (1 de marzo de 2000). «The barium site in a potassium channel by x-ray crystallography». The Journal of General Physiology 115 (3): 269-272.
- ↑ Lam, Yee Ling; Zeng, Weizhong; Sauer, David Bryant (25 de mayo de 2017). «The conserved potassium channel filter can have distinct ion binding profiles: Structural analysis of rubidium, cesium, and barium binding in NaK2K». The Journal of General Physiology 144 (2): 181-192.
- ↑ Guo, Rui; Zeng, Weizhong; Cui, Hengjun (25 de mayo de 2017). «Ionic interactions of Ba2+ blockades in the MthK K+ channel». The Journal of General Physiology 144 (2): 193-200.
- ↑ Judge, Susan I. V.; Bever Jr., Christopher T. (1 de julio de 2006). «Potassium channel blockers in multiple sclerosis: Neuronal Kv channels and effects of symptomatic treatment». Pharmacology & Therapeutics 111 (1): 224-259.
