Difenilamina
| Difenilamina | ||
|---|---|---|
 | ||
| Archivo:Diphenylamine-3D-balls.png y Diphenylamine 3D spacefill.png | ||
| General | ||
| Fórmula estructural |
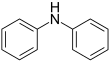 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 122-39-4[1] | |
| Número RTECS | JJ7800000 | |
| ChEBI | 4640 | |
| ChEMBL | CHEMBL38688 | |
| ChemSpider | 11003 | |
| PubChem | 11487 | |
| UNII | 9N3CBB0BIQ | |
| KEGG | C11016 | |
| Propiedades físicas | ||
| Masa molar | 169,089 g/mol | |
La difenilamina es un compuesto orgánico con la fórmula (C6H5) 2NH. El compuesto es un derivado de la anilina, que consiste en una amina unida a dos grupos fenilo. El compuesto es un sólido incoloro, pero las muestras comerciales a menudo son amarillas debido a las impurezas oxidadas. La difenilamina se disuelve bien en muchos solventes orgánicos comunes y es moderadamente soluble en agua. Se utiliza principalmente por sus propiedades antioxidantes. La difenilamina se usa ampliamente como antioxidante industrial, tinte mordiente y reactivo y también se emplea en la agricultura como fungicida y antihelmíntico.
Preparación y reactividad[editar]
La difenilamina se fabrica mediante la desaminación térmica de anilina sobre catalizadores de óxido:
2 C6H5NH2 → (C6H5) 2NH + NH3
Es una base débil, con un Kb de 10-14. Con ácidos fuertes forma sales. Por ejemplo, el tratamiento con ácido sulfúrico da el bisulfato [(C6H5) 2NH2] + [HSO4] - como un polvo blanco o amarillento con p.f. 123-125 °C.[2]
La difenilamina sufre diversas reacciones de ciclación. Con azufre, da fenotiazina, un precursor de los productos farmacéuticos.[3]
(C6H5) 2NH + 2 S → S (C6H4) 2NH + H2S
Con yodo, se deshidrogena para dar carbazol, con liberación de yoduro de hidrógeno:
(C6H5) 2NH + I2 → (C6H4) 2NH + 2 HI
La arilación con yodobenceno da trifenilamina.[4] también se utiliza como reactivo de prueba en la prueba de Dische.
Aplicaciones[editar]
Inhibidor de escaldado de manzana[editar]
La difenilamina se utiliza como inhibidor del escaldado de las manzanas antes o después de la cosecha, aplicado como tratamiento de mojado en interiores. Su actividad antiquemaduras es el resultado de sus propiedades antioxidantes, que protegen la piel de la manzana de los productos de oxidación del α-farneseno durante el almacenamiento.[5] El escaldado de la manzana es una lesión física que se manifiesta en manchas marrones después de que la fruta se retire del almacenamiento en frío.
Estabilizador para pólvora sin humo[editar]
En la fabricación de pólvora sin humo, la difenilamina se usa comúnmente como estabilizador,[6] de modo que el análisis de residuos de armas de fuego busca cuantificar trazas de difenilamina.[7] La difenilamina funciona uniendo los productos de degradación de la nitrocelulosa (p. Ej., NO, NO2 y ácido nítrico), lo que evita que estos productos de degradación aceleren una mayor degradación.[8]
Antioxidante[editar]
Las difenilaminas alquiladas funcionan como antioxidantes en lubricantes,[9] aprobados para su uso en máquinas, en las que no se descarta el contacto con alimentos.[10] Las difenilaminas alquiladas y otros derivados se utilizan como anti-ozonantes en la fabricación de productos de caucho, lo que refleja la naturaleza antioxidante de los derivados de anilina.[11]
Indicador redox[editar]
Muchos derivados de difenilamina se utilizan como indicadores redox que son particularmente útiles en valoraciones alcalinas redox.[12] El ácido difenilaminesulfónico es un prototipo de indicador redox simple, debido a su solubilidad acuosa mejorada en comparación con la difenilamina.[13] Se ha intentado explicar los cambios de color asociados con la oxidación de la difenilamina.[14][15]
En una aplicación relacionada, la difenilamina es oxidada por nitrato para dar una coloración azul similar en la prueba de difenilamina para nitratos.
Tintes[editar]
Varios colorantes azoicos como Metanil Yellow, Disperse Orange 1 y Acid orange 5 son derivados de la difenilamina.
Referencias[editar]
- ↑ Número CAS
- ↑ The Merck Index, 10th Ed., (1983), p.485, Rahway: Merck & Co.
- ↑ T. Kahl, K.-W. Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh, "Aniline" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim. doi 10.1002/14356007.a02_303
- ↑ F. D. Hager (1941). "Triphenylamine". Org. Synth.; Coll. Vol. 1: 544.
- ↑ Ingle, M; M. C. D'Souza (1989). «Physiology and control of superficial scald of apples: a review». HortScience 24 (28): 31.
- ↑ Cook, Stanley G (1935). «Determination of Diphenylamine in Smokeless Powders». Industrial & Engineering Chemistry Analytical Edition 7 (4): 250-255. doi:10.1021/ac50096a019.
- ↑ Leggett, Lana S; Lott, Peter F (1989). «Gunshot residue analysis via organic stabilizers and nitrocellulose». Microchemical Journal 39: 76-85. doi:10.1016/0026-265X(89)90012-X.
- ↑ Drzyzga, Oliver (2003). «Diphenylamine and derivatives in the environment: A review». Chemosphere 53 (8): 809-818. Bibcode:2003Chmsp..53..809D. PMID 14505701. doi:10.1016/S0045-6535(03)00613-1.
- ↑ Jun Dong; Cyril A. Migdal (2009). «1. Antioxidants». En Leslie R. Rudnick, ed. Lubricant Additives: Chemistry and Applications (2nd edición). CRC Press. pp. 3–50. ISBN 978-1420059656.
- ↑ Canady, Richard; Richard Lane; Greg Paoli; Margaret Wilson; Heidi Bialk; Steven Hermansky; Brent Kobielush; Ji-Eun Lee; Craig Llewellyn; Joseph Scimeca (Oct 2013). «Determining the Applicability of Threshold of Toxicological Concern Approaches to Substances Found in Foods». Crit Rev Food Sci Nutr 53 (12): 1239-1249. PMC 3809586. PMID 24090142. doi:10.1080/10408398.2012.752341.
- ↑ P. F. Vogt, J. J. Gerulis, "Amines, Aromatic" in Ullmann’s Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a02_037
- ↑ Willard, H. H; Manalo, G. D (1947). «Derivatives of Diphenylamine as Oxidation-Reduction Indicators in Alkaline Solution». Analytical Chemistry 19 (3): 167-170. doi:10.1021/ac60003a011.
- ↑ Sarver, L. A; Kolthoff, I. M (1931). «Diphenylamine Sulfonic Acid as a New Oxidation-Reduction Indicator». Journal of the American Chemical Society 53 (8): 2902-2905. doi:10.1021/ja01359a010.
- ↑ Sriramam, K (1977). «Mechanistic interpretation of the redox behaviour of diphenylamine». Talanta 24 (1): 31-36. PMID 18962017. doi:10.1016/0039-9140(77)80181-1.
- ↑ Sarver, L. A; Kolthoff, I. M (1937). «Electrochemical Properties of Diphenylbenzidine Sulfonic Acid». Journal of the American Chemical Society 59: 23-25. doi:10.1021/ja01280a007.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Diphenylamine» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
