Electroforesis capilar
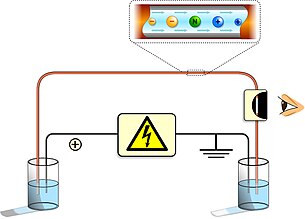
La electroforesis capilar (EC) (o CE por sus siglas en inglés Capillary electrophoresis), es un grupo de técnicas de separación electrocinética, que se realiza en el interior de tubos capilares, generalmente con diámetros inferiores a las 100 μm y longitudes de 40 a 100 cm. También recibe este nombre la separación electrocinética realizada en canales de micro y nanofluidos. La técnica se basa en la diferente movilidad de los iones a través de una disolución cuando esta se somete a un campo eléctrico. la técnica tiene un gran poder de resolución, habiéndose desarrollado métodos que permiten separar incluso moléculas neutras.[1]
Con cierta frecuencia a esta técnica técnica también se la denomina como electroforesis capilar de zona (ZCE por sus siglas en inglés), por ser esta técnica la más habitual. Sin embargo existen otras modalidades electroforéticas que también permiten la separación electrocinética en el interior de tubos capilares, como la electroforesis capilar en gel (CGE), el enfoque isoeléctrico capilar (CIEF), la isotacoforesis capilar y la cromatografía electrocinética micelar (MEKC),[2] que también pertenecen a esta clase de métodos. En todas estas técnicas, los analitos migran a través de soluciones electrolíticas bajo la influencia de un campo eléctrico. Dependiendo de su movilidad iónico, pueden llegar a separarse. También se pueden concentrar o "focalizar" mediante gradientes de conductividad y pH.
Fundamentos de la técnica[editar]
La técnica de la electroforesis capilar tiene sus orígenes en la técnica desarrollada para muestras muestras macroscópicas por el químico sueco Arne Tiselius en la década de 1930. Originariamente, las separación electroforética se realizaba en medios planos estabilizados, como papel o en geles semiporosos, sistema con los que se conseguían excelentes separaciones de determinadas macromoléculas, pero que era un proceso lento y muy tedioso, que requería una considerable habilidad del operador. Hacia la década de 1980 los científicos comenzaron a explorar la posibilidad de realizar este mismo tipo de separaciones en cantidades microscópicas de muestra, utilizando tubos capilares de sílice fundida, obteniendo resultados muy prometedor en lo que a tiempo de análisis y resolución de los analitos se refiere, iniciándose así, el desarrollo de la electroforesis capilar (CE).[3]
Independientemente de que se trate de electroforesis clásica o capilar, para llevar a cabo la separación de las especies cargadas, es necesario aplicar un campo eléctrico entre los extremos del lecho a través del cual se van a mover dichas especies. Como consecuencia de este campo eléctrico, se produce lo que se denomina movilidad electroforética, que hace las moléculas catiónicas migren hacia el polo negativo y las aniónicas hacia el polo positivo. La velocidad a la que se produce esta migración, expresada en cm/s, depende del campo eléctrico (E), que tiene unidades de V/cm y de un coeficiente denominado movilidad iónica o más correctamente, en el caso de la electroforesis, movilidad electroforética, que se representa como μe, con unidades cm2/ V.s:
El coeficiente de movilidad electroforética μe, depende de la carga eléctrica del analito así como de otros factores como el retardo por fricción. Si dos iones difieren en la carga o en las fuerzas de fricción, se desplazan a diferente velocidad a través del lecho electroforético, llegando a separarse entre sí. Esta fuerza de fricción es mayor cuanto mayor es el tamaño del ion, por lo que, a igual carga, los iones grandes se mueven más lentamente que los pequeños.
Dentro del capilar de separación se encuentra la disolución que contiene los analitos o las moléculas a separar y el tampón o medio electrolítico que es el encargado de conducir la corriente. El interior se encuentra formado por grupos silanol (Si-OH), los cuales al ser desprotonados (Si-O), elevan considerablemente pH y favorecen la presencia de analitos específicos.
Como se ha dicho, la separación se lleva a cabo según la relación masa/carga de las distintas moléculas. Para que esto sea posible es necesario aplicar una diferencia de potencial (de 100 a 500 V/cm) entre los dos extremos del capilar que hará que las moléculas se muevan hacia un extremo u otro del capilar (movilidad electroforética: las moléculas catiónicas hacia el polo negativo y las aniónicas hacia el polo positivo) y que se vayan separando entre sí.
Además, existe dentro del capilar otro fenómeno denominado flujo electroosmotico que se da debido a que la superficie interna del capilar está cargada. El flujo electroosmótico es el mismo dentro de todo el capilar y afecta de igual forma a todas las moléculas arrastrándolas hacia uno de los extremos. Así, la separación se verá afectada por el flujo electroosmótico y por la movilidad electroforética de cada una de las moléculas.
Ventajas[editar]
La inducción del alto potencial eléctrico permite: 1) que la separación sea más sensible entre las diferentes moléculas (aumento de la resolución) y 2) que el tiempo de análisis sea más corto.
La eficacia y la velocidad de la separación se pueden mejorar mediante la optimización de diferentes factores como son la temperatura, el voltaje aplicado, el medio de separación, el disolvente en el que se encuentra disuelta la muestra, etc.
Generalmente se obtienen tiempos de análisis bastante bajos si se compara con otras técnicas separativas como la cromatografía de gases o la de líquidos. Además el consumo de muestra y reactivos es muchísimo menor por lo que se la puede considerar una técnica más limpia.
Es muy versátil ya que se puede emplear para separar cualquier tipo de compuesto eligiendo bien el detector; se puede acoplar a un detector UV, de fluorescencia, un espectrómetro de masas, etc.
Todas estas características convierten a la EC en un método eficiente y económico, capaz de separar cientos de componentes de forma simultánea, empleando cantidades mínimas de muestras y reactivos.
Separación de ácidos nucleicos (ADN/ARN)[editar]
Para el caso del ADN, los fragmentos a analizar se encuentran unidos a marcas fluorescentes, siendo detectadas por un láser de argón, que las excita a distintas longitudes de onda, lográndose así el análisis de múltiples fragmentos al mismo tiempo, que se van a mover hacia el polo positivo y se separarán de acuerdo a la longitud del campo eléctrico: los de menor peso molecular viajarán más rápido a través del capilar, los de mayor peso molecular lo harán más lentamente.
En los últimos años, la EC ha contribuido al fortalecimiento de la ciencia y la medicina moderna. Gracias a las ventajas que provee la EC, la secuenciación del ADN ha podido automatizarse, permitiendo, hoy día, poder conocer las secuencias genómicas de los humanos y otras especies con mayor velocidad y especificidad (15 mil millones de nucleótidos de secuencia en menos de un año).
Además, la información acumulada por la EC comienza a vislumbrar las causas genéticas de muchas enfermedades, fortaleciendo el diagnóstico en contraposición de las metodologías clásicas usadas para el estudio de la medicina genómica. Las pruebas de diagnóstico genético emplean normalmente un gran número de marcadores polimórficos (variaciones específicas en la secuencia del genoma), como los "microsatélites o STR" (Short Tandem Repeat), los "minisatélites o VNTR" (Variable Number of Tandem Repeat) y los SNP (Single Nucleotide Polymorphism), además de la determinación de mutaciones asociadas a muchas enfermedades.
Así, el uso de marcadores polimórficos y mutacionales para el diagnóstico requiere de una tecnología automatizada, como la EC, que contribuye, principalmente, en dos áreas del diagnóstico genético: secuenciación y análisis de fragmentos en los cuales se puede determinar la dosis génica de forma cuantitativa (como para pruebas prenatales: trisomías, monosomías, duplicaciones, deleciones e inserciones). Técnicas como la electroforesis en geles de agarosa y poliacrilamida consumen más tiempo y recursos, son menos específicas y reproducibles, y suelen requerir mayor cantidad de muestra (actualmente se encuentran casi en desuso).
Anomalías en aplicaciones de diagnóstico[editar]
Los resultados obtenidos en electroforesis capilar con fines diagnósticos pueden presentar ciertas anomalías que dificultan su interpretación.
Allele drop-out (ADO)[editar]
Este fenómeno ocurre, tal y como indica su nombre (pérdida de alelo) cuando sólo una copia de ADN del par correspondiente ha sido amplificada. Como consecuencia, se puede observar un diminuto pico que se identifica con dicha copia.
Pico n-A[editar]
En ocasiones, la ADN polimerasa sintetiza el producto de PCR con un nucleótido menos del que debería (normalmente cuando la hebra molde acaba en adenina). Esto resulta en la aparición de un pico ligeramente más pequeño pegado a otro mayor.
Pull-ups[editar]
Tiene lugar cuando muestras de ADN con un fluróforo determinado aparece en forma de pico en los resultados del análisis de otro fluoróforo (es decir, el láser de argón no emite la longitud de onda óptima para su detección, pero aun así reacciona ante éste). Esto es debido a la gran cantidad de ADN con dicho fluróforo determinado.
Electroforesis capilar sensible a la conformación (CSCE)[editar]
La CSCE se utiliza para detectar la presencia de heterodúplex mediante la tecnología de fluorescencia. Es más rápida y consigue mejores resultados que la DHPLC, ya que los productos de la PCR pueden multiplexarse utilizando colorantes fluorescentes múltiples. Una alteración en la secuencia del DNA puede producir una conformación distinta, con diferente movilidad electroforética, y puede emplearse un polímero adecuado para la identificación.
Referencias[editar]
- ↑ Rubinson, Kenneth A.; Rubinson, Judith F. (2000). «Cap. 16.6 Electroforesis capilar». Análisis instrumental. Prentice Hall. ISBN 84-205-2988-5.
- ↑ Kemp, Graham (1998-02). «Capillary Electrophoresis: A Versatile Family of Analytical Techniques». Biotechnology and Applied Biochemistry (en inglés) 27 (1): 9-17. ISSN 0885-4513. doi:10.1111/j.1470-8744.1998.tb01369.x. Consultado el 1 de mayo de 2024.
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap. 34.C Electroforesis capilar». Fundamentos de química analítica. Cengage Learning. ISBN 978-607-519-937-6.

