Epilepsia del lóbulo temporal
| Epilepsia del lóbulo temporal | ||
|---|---|---|
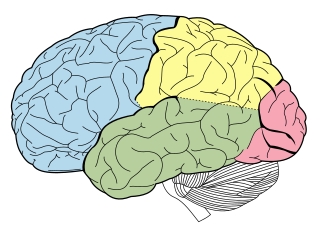 Lóbulos del cerebro. Lóbulo temporal en verde | ||
| Especialidad | Neurología, psiquiatría | |
En el campo de la neurología, la epilepsia del lóbulo temporal[1] es un trastorno cerebral duradero que provoca crisis no provocadas en el lóbulo temporal. La epilepsia del lóbulo temporal es el tipo más común de epilepsia de inicio focal entre los adultos.[2] Los síntomas de las crisis y el comportamiento distinguen las crisis que surgen del lóbulo temporal medial de las crisis que surgen del lóbulo temporal lateral (neocortical).[3] Pueden aparecer comorbilidades psiquiátricas y de memoria. El diagnóstico se basa en estudios electroencefalográficos (EEG) y de neuroimagen.[4][5] Los medicamentos anticonvulsivos, la cirugía de la epilepsia y los tratamientos dietéticos pueden mejorar el control de las crisis.[6][7][8][9]
Tipos[editar]
Según la clasificación de las epilepsias de 2017 de la Liga Internacional contra la Epilepsia (ILAE), la epilepsia de inicio focal se produce por crisis que surgen de una red neuronal biológica dentro de un único hemisferio cerebral.[10][11] La epilepsia del lóbulo temporal se produce por crisis que surgen dentro del lóbulo temporal.[11] La epilepsia del lóbulo temporal es la epilepsia de inicio focal más común, y el 80% de la epilepsia del lóbulo temporal es epilepsia del lóbulo temporal mesial (medial), epilepsia del lóbulo temporal que surge de la parte interna (medial) del lóbulo temporal que puede implicar al hipocampo, la circunvolución parahipocampal o la amígdala.[3][12] Las convulsiones menos comunes del lóbulo temporal lateral o neocorticales surgen del lóbulo temporal externo (lateral).[3] La clasificación ILAE 2017 distingue las convulsiones focales conscientes de las convulsiones focales alteradas.[11] Una convulsión focal consciente del lóbulo temporal se produce si una persona permanece consciente de lo que ocurre durante toda la convulsión; la conciencia puede mantenerse incluso si se produce una alteración de la capacidad de respuesta durante la convulsión.[11] Una convulsión focal con alteración de la conciencia del lóbulo temporal se produce si una persona pierde la conciencia durante cualquier parte de la convulsión.[11]
Síntomas y comportamiento[editar]
Epilepsia del lóbulo temporal medial[editar]
Durante una convulsión del lóbulo temporal, una persona puede experimentar un aura convulsiva; un aura es una experiencia autonómica, cognitiva, emocional o sensorial que suele producirse durante la parte inicial de una convulsión.[11][3] Las auras comunes de las convulsiones del lóbulo temporal mesial incluyen una sensación epigástrica ascendente, malestar abdominal, gusto (gustativo), olfato (olfativo), hormigueo (somatosensorial), miedo, déjà vu, jamais vu, rubor o frecuencia cardiaca acelerada (taquicardia).[3] A continuación, la persona puede quedarse con la mirada perdida, parecer inmóvil (detención conductual) y perder la consciencia.[3] Pueden producirse comportamientos motores estereotipados repetidos (automatismos), como tragar repetidamente, chasquearse los labios, hurgar, buscar a tientas, dar palmaditas o vocalizar.[3] La postura distónica es una rigidez antinatural de un brazo que se produce durante una convulsión.[13] Una postura distónica en un lado del cuerpo suele indicar la aparición de una convulsión en el lado opuesto del cerebro, por ejemplo, una postura distónica del brazo derecho que surge de una convulsión del lóbulo temporal izquierdo.[13] Es más probable que se produzca un deterioro de la función del lenguaje (disfasia) durante o poco después de una convulsión cuando las convulsiones surgen del lado del cerebro dominante del lenguaje.[13]
Epilepsia del lóbulo temporal lateral[editar]
Las auras comunes de las convulsiones que surgen de la corteza auditiva primaria incluyen vértigo, zumbido, timbre, oír una canción, oír voces o sensación auditiva alterada.[13] Las convulsiones del lóbulo temporal lateral que surgen de la unión del lóbulo temporal-parietal pueden causar alucinaciones visuales complejas.[3] En comparación con las convulsiones del lóbulo temporal mesial, las convulsiones del lóbulo temporal lateral son convulsiones de duración más breve, se producen con una pérdida de conciencia más temprana y es más probable que se conviertan en convulsiones tónico-clónicas focales a bilaterales.[3] Es más probable que se produzca una alteración de la función del lenguaje (disfasia) durante o poco después de una convulsión cuando las convulsiones surgen del lado del cerebro dominante del lenguaje.[13]
Comorbilidades[editar]
Memoria[editar]
El principal deterioro cognitivo en la epilepsia del lóbulo temporal mesial es un deterioro progresivo de la memoria.[14] Se trata de un deterioro de la memoria declarativa, incluida la memoria episódica y la memoria semántica, que empeora cuando la medicación no consigue controlar las crisis.[14][15][16] La epilepsia del lóbulo temporal mesial que surge del hemisferio dominante del lenguaje deteriora la memoria verbal, y la epilepsia del lóbulo temporal mesial que surge del hemisferio no dominante del lenguaje deteriora la memoria no verbal.[14][16]
Comorbilidades psiquiátricas[editar]
Los trastornos psiquiátricos son más frecuentes entre las personas con epilepsia, y la mayor prevalencia se da entre las que padecen epilepsia del lóbulo temporal.[17] La comorbilidad psiquiátrica más frecuente es el trastorno depresivo mayor.[17] Otros trastornos incluyen el trastorno de estrés postraumático, el trastorno de ansiedad generalizada, la psicosis, el trastorno obsesivo-compulsivo, la esquizofrenia, el trastorno bipolar, el trastorno por uso de sustancias y una prevalencia de suicidio de ~9%.[17]
Personalidad[editar]
Artículo principal: Síndrome de Geschwind
El síndrome de Geschwind es un síndrome de sexualidad alterada (con mayor frecuencia hiposexualidad), religiosidad y escritura y dibujo compulsivos o extensivos que se da en personas con epilepsia del lóbulo temporal.[18] Sin embargo, estudios posteriores no apoyaron la asociación de estos rasgos conductuales con la epilepsia del lóbulo temporal.[18] Hay informes de comportamientos religiosos que ocurren en personas con epilepsia del lóbulo temporal.[19][20][21][22][23]
Causas[editar]
La esclerosis del hipocampo, los tumores cerebrales, las lesiones cerebrales traumáticas, las malformaciones vasculares cerebrales, los trastornos de la migración neuronal, las infecciones como la encefalitis y la meningitis, las enfermedades autoinmunes (encefalitis límbica) y los trastornos genéticos pueden causar epilepsia del lóbulo temporal.[24]
Factores de riesgo[editar]
Muchas personas con epilepsia del lóbulo temporal no controlada tuvieron convulsiones febriles en la infancia.[25] Una convulsión febril breve sólo aumenta ligeramente el riesgo de desarrollar convulsiones afebriles.[26] Sin embargo, la convulsión prolongada del estado epiléptico febril conlleva un riesgo del 9% de desarrollar epilepsia.[26] No existe una relación clara entre las convulsiones febriles y el desarrollo de esclerosis del hipocampo.[26]
Mecanismos[editar]
Pérdida neuronal[editar]

La esclerosis del hipocampo se produce con una pérdida neuronal grave en CA1 y menos grave en CA3 y CA4.[27] La investigación experimental ha demostrado que la activación del receptor de N-metil-D-aspartato (NMDA) provoca la pérdida de células neuronales, y los modelos animales de epilepsia del lóbulo temporal inducidos por estimulación eléctrica duplican el patrón de pérdida de células de la epilepsia del lóbulo temporal en humanos.[27] Las convulsiones repetitivas dañan irreversiblemente las interneuronas, lo que provoca una pérdida persistente de la inhibición recurrente.[27] El daño de las interneuronas GABAérgicas conduce a la pérdida de inhibición y al disparo incontrolado de las neuronas, lo que provoca convulsiones.[27] La hipótesis de la epileptogénesis secundaria es que los ataques repetitivos conducen a la pérdida de interneuronas, pérdida de neuronas principales glutamatérgicas, brotación axonal y formación de nuevos circuitos excitatorios glutamatérgicos recurrentes que conducen a una epilepsia más grave.[28] Los mecanismos relacionados con la pérdida neuronal no explican por completo la epilepsia del lóbulo temporal, ya que ésta puede producirse con una pérdida mínima de células neuronales.[27]
Mutación del cotransportador de K+/Cl- (KCC2) de tipo 2 específica de las neuronas[editar]
Esta mutación de KCC2 impide que las neuronas subiculares extruyan iones de potasio y cloruro, lo que provoca la acumulación intracelular de cloruro y corrientes positivas mediadas por ácido γ-aminobutírico (GABA).[27] El eflujo de cloruro acumulado a través de los receptores GABA provoca despolarización neuronal, aumento de la excitabilidad neuronal y, en última instancia, convulsiones.[27] Las personas con esta mutación padecen epilepsia del lóbulo temporal mesial con esclerosis del hipocampo.[27]
Dispersión de células granulares[editar]
La dispersión de las células granulares del giro dentado se refiere a una capa de células granulares ensanchada, mal delimitada o acompañada de células granulares fuera de la capa (células granulares ectópicas).[29] En el cerebro normal, las células granulares dentadas bloquean la propagación de convulsiones desde la corteza entorrinal hasta el hipocampo.[27] Una hipótesis es que la dispersión de células granulares puede interrumpir la vía normal de fibras musgosas que conecta las células granulares y las células piramidales CA3, lo que da lugar a brotes de fibras musgosas y a nuevas redes excitatorias capaces de generar convulsiones.[27] Sin embargo, un estudio ha demostrado que puede darse un patrón similar de dispersión de células granulares en personas sin epilepsia.[30]

Malformaciones del desarrollo cortical[editar]
La displasia cortical focal es una malformación cerebral que puede causar epilepsia del lóbulo temporal.[27] Esta malformación puede causar capas corticales anormales (dislaminación ), cursar con neuronas anormales (neuronas dismórficas, células globosas) y puede ocurrir con un tumor cerebral o una malformación vascular.[27] Una anomalía de la vía MTOR conduce a neuronas hiperexcitables mediadas por glutamato que provocan convulsiones.[27]
Diagnóstico[editar]
Electroencefalograma[editar]

La descarga epileptiforme del lóbulo temporal es un patrón que se observa en el electroencefalograma (EEG); las descargas epileptiformes del lóbulo temporal se producen entre las crisis y confirman el diagnóstico de epilepsia del lóbulo temporal.[4] La monitorización de vídeo-EEG a largo plazo puede registrar el comportamiento y el EEG durante una crisis.[4] La magnetoencefalografía puede diagnosticar la epilepsia del lóbulo temporal mediante el registro de descargas epileptiformes o patrones de crisis que surgen de los campos magnéticos de las corrientes eléctricas neuronales.[4]
Neuroimágenes[editar]
Las pruebas de neuroimagen pueden identificar la causa de las crisis y el foco de las crisis, es decir, el lugar del cerebro donde comienzan las crisis.[5] En la epilepsia recién diagnosticada, la resonancia magnética (RM) puede detectar lesiones cerebrales en hasta el 12-14% de las personas con epilepsia.[31] Sin embargo, en las personas con epilepsia crónica, la RM puede detectar lesiones cerebrales en el 80% de las personas con epilepsia.[31] La RM de 3-Tesla se recomienda para aquellos con evidencia de epilepsia focal, como la epilepsia del lóbulo temporal.[5] Las anomalías identificadas mediante RM incluyen esclerosis hipocampal, displasia cortical focal, otras malformaciones cerebrales corticales del desarrollo, tumores del desarrollo y de bajo grado, hemangioma cavernoso, lesión cerebral hipóxico-isquémica, lesión cerebral traumática y encefalitis.[5]

La tomografía por emisión de positrones (PET) cerebral con 18F-fluorodeoxiglucosa (18F-FDG) puede mostrar una región cerebral de disminución del metabolismo de la glucosa en un momento entre convulsiones; esta región hipometabólica puede corresponder al foco convulsivo, y la PET es más sensible para la localización del foco convulsivo del lóbulo temporal en comparación con la epilepsia que surge de otros lóbulos cerebrales.[5] La tomografía computarizada de emisión monofotónica (SPECT) puede mostrar una región de disminución del flujo sanguíneo entre 40 y 60 segundos después de la inyección durante la crisis; esta región de flujo sanguíneo reducido puede corresponder al foco de la crisis.[5]

La tomografía computarizada (TC) es menos sensible que la RM para identificar tumores pequeños, malformaciones vasculares, malformaciones cerebrales del desarrollo cortical y anomalías en el lóbulo temporal medio.[31] La TC se aconseja en casos de urgencia cuando se sospecha que la causa de la epilepsia puede ser una hemorragia intracerebral, un absceso cerebral, un infarto cerebral de gran tamaño o un empiema subdural.[5][31] Una persona que necesite una neuroimagen pero no pueda someterse a una RM debido a la implantación de dispositivos como un marcapasos cardíaco, un desfibrilador o un implante coclear puede someterse a una TC. La TC puede demostrar mejor las anomalías cerebrales que contienen calcio y causan epilepsia, como en la esclerosis tuberosa y el síndrome de Sturge-Weber.[5][31]
Tratamiento[editar]
Tratamiento médico[editar]

Los medicamentos anticonvulsivantes orales controlan las crisis en aproximadamente dos tercios de las personas con epilepsia, y el control suele producirse con uno o dos medicamentos.[32]
Tratamiento quirúrgico[editar]
Aquellos con crisis no controladas a pesar del tratamiento con múltiples medicamentos anticonvulsivantes tienen epilepsia farmacorresistente, y pueden requerir cirugía de la epilepsia para lograr el control de las crisis.[10][32]

Penfield y Flanigan describieron por primera vez la lobectomía temporal anterior, extirpación quirúrgica parcial del lóbulo temporal, para el tratamiento de la epilepsia del lóbulo temporal mesial en 1950.[33] En un ensayo prospectivo aleatorizado y controlado que comparaba la lobectomía temporal anterior con el tratamiento médico para la epilepsia del lóbulo temporal farmacorresistente, la cirugía fue más eficaz que el tratamiento médico, con un resultado libre de convulsiones a 1 año en el 58% de las personas con lobectomía temporal anterior en comparación con el 8% de las personas con tratamiento farmacológico.[6] Entre las personas con epilepsia intratable del lóbulo temporal mesial y esclerosis del hipocampo, aproximadamente el 70% se liberan de las crisis tras la cirugía de la epilepsia.[34] Los estudios demuestran que la lobectomía temporal anterior dominante del lenguaje puede provocar un deterioro de la memoria verbal.[16] Sin embargo, los resultados de los estudios son más variables en la lobectomía temporal anterior no dominante del lenguaje que provoca un deterioro de la memoria no verbal.[16]
La terapia térmica intersticial con láser guiada por resonancia magnética, la radiocirugía estereotáctica y la ablación estereotáctica por radiofrecuencia son métodos quirúrgicos que tratan la epilepsia destruyendo el tejido cerebral anormal que provoca las crisis.[35][36][37]
La neuroestimulación también puede mejorar el control de las convulsiones.[7] El estimulador del nervio vago (ENV) se implanta quirúrgicamente en el pecho y administra estimulación eléctrica programada al nervio vago del cuello.[38]
El dispositivo de neuroestimulación sensible se implanta en el cráneo, monitoriza la actividad eléctrica cerebral para detectar convulsiones y responde a las convulsiones con estimulación eléctrica programada en una o dos áreas cerebrales.[39] La estimulación cerebral profunda programada del núcleo talámico anterior puede tratar convulsiones originadas en más de 2 áreas cerebrales.[7]
Tratamiento alimenticio[editar]
La dieta cetogénica y la dieta Atkins modificada son otras opciones de tratamiento de la epilepsia del lóbulo temporal.[8][9]
Remisión[editar]
Entre aquellos que desarrollan epilepsia del lóbulo temporal infantil, la epilepsia remite en aproximadamente un tercio de los niños.[40] La remisión era más probable entre los que no tenían esclerosis del hipocampo, tumor cerebral o displasia cortical focal en la resonancia magnética.[40]
Referencias[editar]
- ↑ «Epilepsia del lóbulo temporal». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud. OMS,OPS, BIREME.
- ↑ Muhlhofer, Wolfgang; Tan, Yee‐Leng; Mueller, Susanne G.; Knowlton, Robert (2017-05). «MRI ‐negative temporal lobe epilepsy—What do we know?». Epilepsia (en inglés) 58 (5): 727-742. ISSN 0013-9580. doi:10.1111/epi.13699. Consultado el 21 de julio de 2023.
- ↑ a b c d e f g h i Chowdhury, Fahmida A.; Silva, Rui; Whatley, Benjamin; Walker, Matthew C. (1 de diciembre de 2021). «Localisation in focal epilepsy: a practical guide». Practical Neurology (en inglés) 21 (6): 481-491. ISSN 1474-7758. PMID 34404748. doi:10.1136/practneurol-2019-002341. Consultado el 21 de julio de 2023.
- ↑ a b c d Javidan, Manouchehr (2012). «Electroencephalography in Mesial Temporal Lobe Epilepsy: A Review». Epilepsy Research and Treatment (en inglés). PMC 3420622. PMID 22957235. doi:10.1155/2012/637430.
- ↑ a b c d e f g h Duncan, John S. (1 de octubre de 2019). «Brain imaging in epilepsy». Practical Neurology (en inglés) 19 (5): 438-443. ISSN 1474-7758. PMID 31420416. doi:10.1136/practneurol-2018-002180. Consultado el 22 de julio de 2023.
- ↑ a b Wiebe, Samuel; Blume, Warren T.; Girvin, John P.; Eliasziw, Michael (2 de agosto de 2001). «A Randomized, Controlled Trial of Surgery for Temporal-Lobe Epilepsy». New England Journal of Medicine (en inglés) 345 (5): 311-318. ISSN 0028-4793. doi:10.1056/NEJM200108023450501. Consultado el 22 de julio de 2023.
- ↑ a b c Touma, Lahoud; Dansereau, Bénédicte; Chan, Alvin Y.; Jetté, Nathalie; Kwon, Churl-Su; Braun, Kees P. J.; Friedman, Daniel; Jehi, Lara et al. (2022-06). «Neurostimulation in people with drug-resistant epilepsy: Systematic review and meta-analysis from the ILAE Surgical Therapies Commission». Epilepsia 63 (6): 1314-1329. ISSN 1528-1167. PMID 35352349. doi:10.1111/epi.17243. Consultado el 22 de julio de 2023.
- ↑ a b Freeman, JM;; Kossoff, EH;; Hartman, AL. «"The ketogenic diet: one decade later"». semanticscholar.org (en inglés). Pediatrics. pp. 535-43. Consultado el 22 de julio de 2023.
- ↑ a b Rezaei, Shahabeddin; Abdurahman, Ahmed Abdulahi; Saghazadeh, Amene; Badv, Reza Shervin; Mahmoudi, Maryam (4 de mayo de 2019). «Short-term and long-term efficacy of classical ketogenic diet and modified Atkins diet in children and adolescents with epilepsy: A systematic review and meta-analysis». Nutritional Neuroscience (en inglés) 22 (5): 317-334. ISSN 1028-415X. doi:10.1080/1028415X.2017.1387721. Consultado el 22 de julio de 2023.
- ↑ a b Scheffer, Ingrid E.; Berkovic, Samuel; Capovilla, Giuseppe; Connolly, Mary B.; et al. (2017). «ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology». Epilepsia (en inglés): 512-521. PMC 5386840. PMID 28276062. doi:10.1111/epi.13709.
- ↑ a b c d e f Fisher, Robert S.; Cross, J. Helen; French, Jacqueline A.; Higurashi, Norimichi; Hirsch, Edouard; Jansen, Floor E.; Lagae, Lieven; Moshé, Solomon L. et al. (2017-04). «Operational classification of seizure types by the International League Against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology». Epilepsia (en inglés) 58 (4): 522-530. ISSN 0013-9580. doi:10.1111/epi.13670. Consultado el 22 de julio de 2023.
- ↑ Tatum, William O. (2012-10). «Mesial temporal lobe epilepsy». Journal of Clinical Neurophysiology: Official Publication of the American Electroencephalographic Society 29 (5): 356-365. ISSN 1537-1603. PMID 23027091. doi:10.1097/WNP.0b013e31826b3ab7. Consultado el 22 de julio de 2023.
- ↑ a b c d e Rusu, V.; Chassoux, F.; Landré, E.; Bouilleret, V.; Nataf, F.; Devaux, B. C.; Turak, B.; Semah, F. (22 de noviembre de 2005). «Dystonic posturing in seizures of mesial temporal origin: Electroclinical and metabolic patterns». Neurology (en inglés) 65 (10): 1612-1619. ISSN 0028-3878. PMID 16301490. doi:10.1212/01.wnl.0000184510.44808.50. Consultado el 22 de julio de 2023.
- ↑ a b c Zeman, Adam; Kapur, Narinder; Jones-Gotman, Marilyn (28 de junio de 2012). Epilepsy and Memory (en inglés). Oxford University Press. ISBN 978-0-19-162563-3. Consultado el 22 de julio de 2023.
- ↑ Quiroga, Rodrigo Quian (2012-08). «Concept cells: the building blocks of declarative memory functions». Nature Reviews Neuroscience (en inglés) 13 (8): 587-597. ISSN 1471-0048. doi:10.1038/nrn3251. Consultado el 22 de julio de 2023.
- ↑ a b c d Bauman, Kristie; Devinsky, Orrin; Liu, Anli A. (2019). «Temporal lobe surgery and memory: Lessons, risks, and opportunities». Epilepsy & Behavior (en inglés). PMC 6885125. PMID 31711868. doi:10.1016/j.yebeh.2019.106596.
- ↑ a b c Lu, Elaine; Pyatka, Nataliya; Burant, Christopher J; Sajatovic, Martha (2021). «Systematic Literature Review of Psychiatric Comorbidities in Adults with Epilepsy». Journal of Clinical Neurology (en inglés): 176-186. PMC 8053555. PMID 33835737. doi:10.3988/jcn.2021.17.2.176.
- ↑ a b David, Daniel; Fleminger, Simon; Kopelman, Michael; Lovestone, Simon; Mellers, John (2 de abril de 2012). Lishman's Organic Psychiatry: A Textbook of Neuropsychiatry (en inglés). John Wiley & Sons. ISBN 978-0-470-67507-6. Consultado el 22 de julio de 2023.
- ↑ Tedrus, Glória Maria Almeida Souza; Fonseca, Lineu Corrêa; Fagundes, Tatiane Mariani; da Silva, Gabriela Leopoldino (1 de septiembre de 2015). «Religiosity aspects in patients with epilepsy». Epilepsy & Behavior (en inglés) 50: 67-70. ISSN 1525-5050. doi:10.1016/j.yebeh.2015.06.003. Consultado el 22 de julio de 2023.
- ↑ d’Orsi, Giuseppe; Tinuper, Paolo (1 de agosto de 2006). «“I heard voices…”: From semiology, a historical review, and a new hypothesis on the presumed epilepsy of Joan of Arc». Epilepsy & Behavior (en inglés) 9 (1): 152-157. ISSN 1525-5050. doi:10.1016/j.yebeh.2006.04.020. Consultado el 22 de julio de 2023.
- ↑ Sirven, Joseph I.; Drazkowski, Joseph F.; Noe, Katherine H. (2007-12). «Seizures Among Public Figures: Lessons Learned From the Epilepsy of Pope Pius IX». Mayo Clinic Proceedings 82 (12): 1535-1540. ISSN 0025-6196. doi:10.1016/s0025-6196(11)61100-2. Consultado el 22 de julio de 2023.
- ↑ Arzy, S; Schurr, R (2016). «God has sent me to you":Right temporal epilepsy, left prefrontal psychosis». Epilepsy & Behavior (en inglés): 7-10. PMID 27176877. doi:10.1016/j.yebeh.2016.04.022.
- ↑ Tedrus, Glória Maria Almeida Souza; Fonseca, Lineu Corrêa; Höehr, Gabriela Chaves (2014-01). «Spirituality aspects in patients with epilepsy». Seizure 23 (1): 25-28. ISSN 1059-1311. doi:10.1016/j.seizure.2013.09.005. Consultado el 22 de julio de 2023.
- ↑ Vadlamudi, L.; Scheffer, I.E.; Berkovic, S. F. (1 de octubre de 2003). «Genetics of temporal lobe epilepsy». Journal of Neurology, Neurosurgery & Psychiatry (en inglés) 74 (10): 1359-1361. ISSN 0022-3050. PMID 14570824. doi:10.1136/jnnp.74.10.1359. Consultado el 22 de julio de 2023.
- ↑ Patterson, Katelin P.; Baram, Tallie Z.; Shinnar, Shlomo (2014). «Origins of Temporal Lobe Epilepsy: Febrile Seizures and Febrile Status Epilepticus». Neurotherapeutics (en inglés): 242-250. PMC 3996115. PMID 24604424. doi:10.1007/s13311-014-0263-4.
- ↑ a b c Mewasingh, Leena D.; Chin, Richard F.M.; Scott, Rod C. (2020-11). «Current understanding of febrile seizures and their long‐term outcomes». Developmental Medicine & Child Neurology (en inglés) 62 (11): 1245-1249. ISSN 0012-1622. doi:10.1111/dmcn.14642. Consultado el 22 de julio de 2023.
- ↑ a b c d e f g h i j k l m Ong, Leong Tung (2019). «Temporal Lobe Epilepsy – Pathophysiology and Mechanisms». European Neurological Review (en inglés): 66. doi:10.17925/ENR.2019.14.2.66.
- ↑ Ben-Ari, Yehezkel; Dudek, F. Edward (2010). «Primary and Secondary Mechanisms of Epileptogenesis in the Temporal Lobe: There is a before and an After». Epilepsy Currents (en inglés): 118-125. PMC 2951692. PMID 20944823. doi:10.1111/j.1535-7511.2010.01376.
- ↑ Blümcke, Ingmar; Thom, Maria; Aronica, Eleonora; Armstrong, Dawna D.; Bartolomei, Fabrice; Bernasconi, Andrea; Bernasconi, Neda; Bien, Christian G. et al. (2013-07). «International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: A Task Force report from the ILAE Commission on Diagnostic Methods». Epilepsia (en inglés) 54 (7): 1315-1329. doi:10.1111/epi.12220. Consultado el 24 de julio de 2023.
- ↑ Roy, Achira; Millen, Kathleen J.; Kapur, Raj P. (2020). «Hippocampal granule cell dispersion: a non-specific finding in pediatric patients with no history of seizures». Acta Neuropathologica Communications (en inglés): 54. PMC 7171777. PMID 32317027. doi:10.1186/s40478-020-00928-3.
- ↑ a b c d e Salmenpera, T. M.; Duncan, J. S. (1 de septiembre de 2005). «Imaging in epilepsy». Journal of Neurology, Neurosurgery & Psychiatry (en inglés) 76 (suppl 3): iii2-iii10. ISSN 0022-3050. PMID 16107387. doi:10.1136/jnnp.2005.075135. Consultado el 24 de julio de 2023.
- ↑ a b Kwan, Patrick; Brodie, Martin J. (3 de febrero de 2000). «Early Identification of Refractory Epilepsy». New England Journal of Medicine (en inglés) 342 (5): 314-319. ISSN 0028-4793. doi:10.1056/NEJM200002033420503. Consultado el 24 de julio de 2023.
- ↑ PENFIELD, WILDER; FLANIGIN, HERMAN (1 de octubre de 1950). «SURGICAL THERAPY OF TEMPORAL LOBE SEIZURES». A.M.A. Archives of Neurology & Psychiatry 64 (4): 491-500. ISSN 0096-6886. doi:10.1001/archneurpsyc.1950.02310280003001. Consultado el 24 de julio de 2023.
- ↑ Lamberink, Herm J; Otte, Willem M; Blümcke, Ingmar; Braun, Kees P J; et al. (2020). «Seizure outcome and use of antiepileptic drugs after epilepsy surgery according to histopathological diagnosis: a retrospective multicentre cohort study». The Lancet Neurology (en inglés): 748-757. PMID 32822635. doi:10.1016/S1474-4422(20)30220-9.
- ↑ Chen, Jia‐Shu; Lamoureux, Audrey‐Anne; Shlobin, Nathan A.; Elkaim, Lior M.; Wang, Andrew; Ibrahim, George M.; Obaid, Sami; Harroud, Adil et al. (8 de junio de 2023). «Magnetic resonance‐guided laser interstitial thermal therapy for drug‐resistant epilepsy: A systematic review and individual participant data meta‐analysis». Epilepsia (en inglés). ISSN 0013-9580. doi:10.1111/epi.17560. Consultado el 25 de julio de 2023.
- ↑ Kerezoudis, Panagiotis; Tsayem, Idriss N.; Lundstrom, Brian N.; Van Gompel, Jamie J. (1 de noviembre de 2022). «Systematic review and patient-level meta-analysis of radiofrequency ablation for medically refractory epilepsy: Implications for clinical practice and research». Seizure (en inglés) 102: 113-119. ISSN 1059-1311. doi:10.1016/j.seizure.2022.10.003. Consultado el 25 de julio de 2023.
- ↑ Mustafa, Mohamed; Zaben, Malik (2022). «Minimal invasive brain surgery for epilepsy; can it be the future?». Journal of Neurology (en inglés): 6178-6180. PMC 9553844. PMID 36098841. doi:10.1007/s00415-022-11360-z.
- ↑ portlandpress.com https://portlandpress.com/clinsci/article/136/9/695/231280/Clinical-perspectives-on-vagus-nerve-stimulation
|url=sin título (ayuda). Consultado el 25 de julio de 2023. - ↑ Geller, Eric B. (2018-11). «Responsive neurostimulation: Review of clinical trials and insights into focal epilepsy». Epilepsy & Behavior: E&B. 88S: 11-20. ISSN 1525-5069. PMID 30243756. doi:10.1016/j.yebeh.2018.06.042. Consultado el 25 de julio de 2023.
- ↑ a b Spooner, C.G.; Berkovic, S.F.; Mitchell, L.A.; Wrennall, J.A.; et al. (2006). «New-onset temporal lobe epilepsy in children: Lesion on MRI predicts poor seizure outcome». Neurology (en inglés): 2147-2153. PMID 17082466. doi:10.1212/01.wnl.0000248189.93630.4f.
