Flindersina
Apariencia
| Flindersina | ||
|---|---|---|
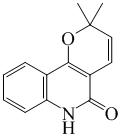 | ||
| Nombre IUPAC | ||
| 2,6-Dihidro-2,2-dimetil-5H-pirano[3,2-c]quinolin-5-ona | ||
| General | ||
| Fórmula estructural |
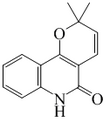 | |
| Fórmula molecular | C14H13NO2 | |
| Identificadores | ||
| Número CAS | 523-64-8[1] | |
| ChEBI | 5094 | |
| ChEMBL | CHEMBL1507844 | |
| ChemSpider | 61532 | |
| PubChem | 68230 | |
| UNII | 6A8PD12CKP | |
| KEGG | C10679 | |
| Propiedades físicas | ||
| Masa molar | 227,262 g/mol | |
| Punto de descomposición | 195 °C (468 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La flindersina es un alcaloide piranoquinolínico aislado de varias plantas de la familia Rutaceae, tales como Flindersia australis, Fagara holtziana, Fagara cholybea y Haplophyllum perforatum. Es un compuesto fitotóxico. UV: [neutro]λmax235;333;350;365 (MeOH).[2]
Biosíntesis[editar]
La flindersina pertenece a una familia de alcaloides característicos de la familia Rutaceae, los cuales son policétidos en donde el ácido antranílico es la unidad de iniciación. La flindersina es un dicétido que forma una 2,4-quinolinadiona. Ésta puede dar una reacción de Sustitución electrófila aromática con el pirofosfato de dimetilalilo (DMAPP). Este sustituyente al oxidarse puede formar un heterociclo de pirano con el enol de la posición 4[3]
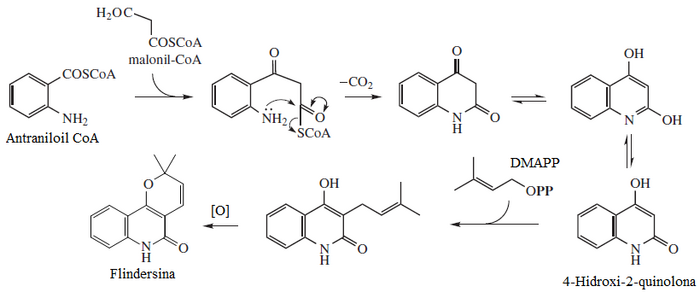
Derivados naturales[editar]
| Nombre | Estructura | Fórmula molecular | CAS | Masa molecular (g/mol) | Estado | Fuente natural | Otras propiedades |
|---|---|---|---|---|---|---|---|
| N-Metilflindersina | 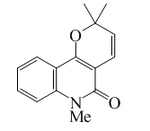 |
C15H15NO2 | 50333-13-6 | 241.289 | Sólido. PF = 83-85 °C | Aislado de varias especies de rutáceas: Fagara chalybea, Fagara holtziana, Melicope ptelefolia y Atalantia roxburghiana. | Presenta propiedades fitotóxicas, insecticidas y larvicidas. UV: [neutro]λmax226 (ε83176);274 (ε13800);318 (ε13490) (MeOH) |
| N-Hidroximetilflindersina |  |
C15H15NO3 | 96400-50-9 | 257.288 | Sólido amorfo | Aislado de Haplophyllum buxbaumii (Rutaceae) | |
| N-Acetoximetilflindersina |  |
C17H17NO4 | 149998-45-8 | 299.326 | Aceite | Aislado de Zanthoxylum simulans[4] | |
| 7-Metoxiflindersina | 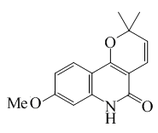 |
C15H15NO3 | 177857-27-1 | 257.288 | Sólido cristalino (Éter) PF = 194-196 °C | Aislado de las hojas de Vepris bilocularis[5] | |
| 8-Metoxiflindersina | 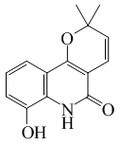 |
C15H15NO3 | 35989-00-5 | 257.288 | Sólido en forma de agujas (Éter). PF = 178 °C | Aislado de Myrtopsis macrocarpa[6] | |
| Haplofilina | 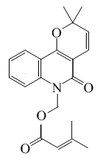 |
C20H21NO4 | 93710-20-4 | 339.390 | Sólido amorfo | Aislado de Haplophyllum suaveolens[7] | |
| Orixalona D | 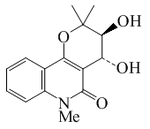 |
C15H17NO4 | 275.304 | Aceite | Aislado de Orixa japonica[8] | [α]24D +3.1 ( c, 0.06 en MeOH); UV: [neutro]λmax230;274;284;318;332 (MeOH) | |
| Ravesilona |  |
C15H17NO3 | 94935-96-3 | 259.304 | Sólido cristalino (EtOH) PF = 272 °C | Aislado de las hojas de Ravenia spectabilis[9] | |
| Haplofitina A | 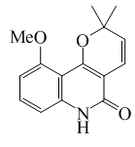 |
C15H15NO3 | 257.288 | Polvo PF = 209-210.5 °C | Aislado de Haplophyllum acutifolium[10] | UV: [neutro]λmax244 (log ε7.92) (Cloroformo) | |
| Haplamina | 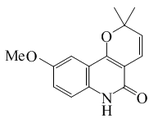 |
C15H15NO3 | 52617-31-9 | 257.288 | Sólido cristalino. PF = 201-202 °C | Aislado de las partes aéreas de Haplophyllum perforatum[11] | |
| N-Metilhaplamina | 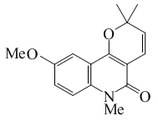 |
C16H17NO3 | 129225-33-8 | 271.315 | Escamas amarillas (Éter) PF = 136-138 °C | Aislado de las partes aéreas de plantas del género Agathosma sp.[12] | |
| Dihidrohaplamina | 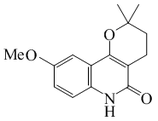 |
C15H17NO3 | 61929-96-2 | 259.304 | Sólido cristalino (Acetona) PF = 231-232 °C | Aislado de Haplophyllum perforatum[13] | |
| Zantobungeanina | 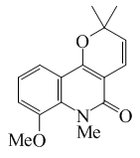 |
C16H17NO3 | 64190-94-9 | 271.315 | Sólido cristalino (Benceno) PF = 77-78 °C | Aislado de las raíces de Zanthoxylum bungeanum[14] | Poco soluble en hexano |
| Zantofilina | 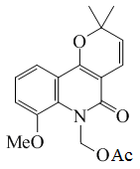 |
C18H19NO5 | 65560-23-8 | 329.352 | Sólido cristalino (Metanol) PF = 126-127 °C | Aislado de tallos de Zanthoxylum monophyllum[15] | |
| Desmetilzantofilina | 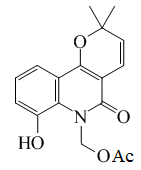 |
C17H17NO5 | 65560-24-9 | 315.325 | Sólido amorfo | Aislado a partir de tallos de Zanthoxylum monophyllum | |
| Zantodiolina | 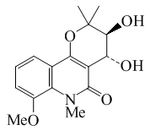 |
C16H19NO5 | 198336-59-3 | 305.330 | Sólido amorfo | Aislado de la corteza de Zanthoxylum simulans[16] | [α]23D = -20 (c, 0.05 en cloroformo); UV: [neutro]λmax218 (log ε4.14);234 (log ε4.21);254 (log ε4.11);270 (log ε3.56);280 (log ε3.59);327 (log ε3.23) (EtOH) |
| Oricina | 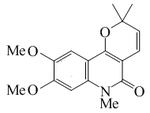 |
C17H19NO4 | 33798-66-2 | 301.341 | Sólido cristalino (Benceno). PF = 150-155 °C | Aislado de la madera y la corteza de Oricia suaveolens y Oricia renieri[17] | |
| Veprisina | 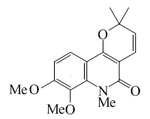 |
C17H19NO4 | 76525-26-3 | 301.341 | Sólido. Forma agujas (Benceno/hexano) PF = 89-90 °C | Aislado de Vepris louisii, Vepris stolzii y Oricia renieri[18] | |
| Araliopsinina | 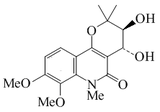 |
C17H21NO6 | 120481-37-0 | 335.356 | Aislado de la corteza de Araliopsis tabouensis[19] | ||
| 4′-Hidroxi-3′,4′-dihidroflindersina | 1′,2′-Dihidro, 1′ξ-hidroxi | C14H15NO3 | 100019-40-7 | 245.277 | Sólido en forma de prismas (EtOAc) PF = 208 °C | Aislado de las hojas de Geijera balansae | [α]20D = -6 (c, 1 en cloroformo) |
| 1′ξ-Hidroxi-N-metil-1′,2′-dihidroflindersina | 1′,2′-Dihidro, 1′ξ-hidroxi, N-Me | C15H17NO3 | 80357-90-0 | 259.304 | Agujas amarillas (MeOH). [α]20D = +5.45 | Aislado de la madera de Euxylophora paraënsis (Rutaceae) | |
| 2′ξ-hidroxi-N-metil-1′,2′-dihidroflindersina (2,3,4,6-Tetrahidro-3-hidroxi-2,2,6-trimetil-5H-pirano[3,2-c]quinolin-5-ona) | 1′,2′-Dihidro, 2′ξ-hidroxi, N-metil | C15H17NO3 | 928008-45-1 | 259.304 | Sólido amorfo | Aislado de Skimmia laureola[20] | [α]29D = -57 (c, 0.14 en MeOH). UV: [neutro]λmax265 (log ε2.67);304 (log ε3.84);318 (log ε3.86);325 (log ε3.74);330 (log ε3.76) (MeOH) |
| 3′,4′-Dihidroxi-3′,4′-dihidroflindersina | 1′,2′-Dihidro, 1′R*,2′S*-dihidroxi | C14H15NO4 | 99964-48-4 | 261.277 | Sólido. Forma prismas (Diclorometano). PF = 234-235 °C | Aislado de Geijera balansae | [α]20D = -2 (c, 0.5 en cloroformo) |
| 8-Hidroxi-6-metoxiflindersina | 6-Metoxi, 8-hidroxi | C15H15NO4 | 155474-84-3 | 273.288 | Sólido amorfo | Aislado de Haplophyllum telephioides | |
| 7-Metoxi-N-metilflindersina | 7-Metoxi, N-metil | C16H17NO3 | 271.315 | Aceite | Aislado de Oricia renieri | ||
| 7-Preniloxiflindersina | 7-(3-Metil-2-buteniloxi) | C19H21NO3 | 177857-28-2 | 311.380 | Sólido cristalino. PF = 165-167 °C | Aislado de las hojas Vepris bilocularis | |
| N-Metil-7-preniloxiflindersina | 7-(3-Metil-2-buteniloxi), N-metil | C20H23NO3 | 177857-29-3 | 325.407 | Aceite | Aislado de las hojas de Vepris bilocularis | |
| N-Metil-8-preniloxiflindersina | 8-(3-Metil-2-buteniloxi), N-metil | C20H23NO3 | 82504-12-9 | 325.407 | Aceite | Aislado de Vepris stolzii | |
| 7-Metoxi-N-metil-8-preniloxiflindersina | 8-(3-Metil-2-buteniloxi), 7-metoxi, N-metil | C21H25NO4 | 82504-13-0 | 355.433 | Aceite | Aislado de Vepris stolzii | |
| 8-(2,3-Epoxi-3,3-dimetilaliloxi)-7-metoxi-N-metilflindersina | 8-(2,3-Epoxi-3-metilbutoxi), 7-metoxi, N-metil | C21H25NO5 | 82504-14-1 | 371.432 | Aceite | Aislado de Vepris stolzii (Rutaceae) |
Referencias[editar]
- ↑ Número CAS
- ↑ Brown, R.F.C. et al., Aust. J. Chem., 1954, 7, 348
- ↑ David S. Seigler. "Plant Secondary Metabolism". Springer, 1998.
- ↑ Brader, G. et al., Annalen, 1993, 355
- ↑ Brader, G. et al., Phytochemistry, 1996, 42, 881-884
- ↑ Hifnawy, M.S. et al., Phytochemistry, 1977, 16, 1035-1039
- ↑ Ulubelen, A. et al., Phytochemistry, 1984, 23, 2123-2124
- ↑ Ito, C. et al., J. Nat. Prod., 2004, 67, 1800-1803
- ↑ Bhattacharyya, P. et al., Phytochemistry, 1984, 23, 1825-1826
- ↑ Ali, M.S. et al., Phytochemistry, 2001, 57, 1277-1280
- ↑ Akhmedzhanova, V.I. et al., Khim. Prir. Soedin., 1974, 10, 109; Chem. Nat. Compd. (Engl. Transl.), 121
- ↑ Campbell, W.E. et al., Phytochemistry, 1990, 29, 1303-1306
- ↑ Akhmedzhanova, V.I.Chem. Nat. Compd. (Engl. Transl.), 1999, 35, 552-553
- ↑ Ren, L. et al., Yaoxue Xuebao, 1981, 16, 672
- ↑ Stermitz, F.R. et al., Phytochemistry, 1977, 16, 2003-2006
- ↑ Chen, I.S. et al., Phytochemistry, 1997, 46, 525-529
- ↑ Abe, M.O. et al., Phytochemistry, 1971, 10, 1167-1169
- ↑ Khalid, S.A. et al., Phytochemistry, 1981, 20, 2761-2763
- ↑ Grundon, M.F. et al., Nat. Prod. Rep., 1990, 7, 131
- ↑ Jurd, L. et al., Aust. J. Chem., 1981, 34, 1625
