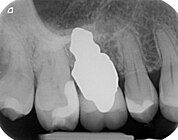
Implante dental análoga a la raíz
Un implante dental anatómico radicular (RAI) - también conocido como implante dental verdaderamente anatómico, o implante anatómico/personalizado - es un dispositivo médico para sustituir una o más raíces de un solo diente inmediatamente después de la extracción. A diferencia de los implantes dentales comunes de tipo tornillo de titanio, estos implantes se fabrican a medida para adaptarse exactamente a la cavidad de extracción del paciente concreto. Por lo tanto, no suele ser necesaria una intervención quirúrgica.
Dado que el implante dental análogo a la raíz coincide con el hueco del diente (alvéolo dental), sólo puede colocarse junto con la extracción del diente. Si el diente ya se ha perdido y los tejidos blandos y duros ya están curados, ya no se puede colocar un RAI.
El principio básico de los implantes endóseos es un proceso biológico descrito como osteointegración, en el que materiales como el titanio o la cerámica forman una unión íntima con el hueso. No existen diferencias particulares entre la osteointegración de un implante análogo a la raíz y un implante convencional de tipo tornillo.
Desventajas de los implantes convencionales[editar]
A medida que la tecnología ha mejorado, también lo ha hecho la tasa de éxito de los implantes. Sin embargo, esto no resuelve un problema fundamental de la tecnología de implantes convencional: hay que modificar al paciente para que se adapte al implante de tornillo o cilindro, y no al revés.
Los tornillos de titanio son propensos a la periimplantitis y a la acumulación de placa, lo que conduce a nuevas intervenciones. El color gris del titanio tiende a mostrarse a través de las encías y,[1] en caso de recesión gingival y ósea, el resultado estético suele ser muy imprevisible.
Implantes análogos a la raíz[editar]

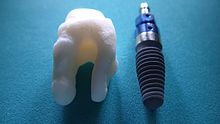
Los RAI se fabrican a medida para que se adapten perfectamente a la cavidad dental de un paciente concreto inmediatamente después de la extracción del diente. Por lo tanto, cada implante es único. Como forma de raíz optimizada, es mucho más que una simple réplica 1:1 de un diente. Dado que rellena exactamente el hueco que queda tras la extracción del diente, rara vez se necesita una intervención quirúrgica. El implante puede fabricarse a partir de una copia del diente extraído, de una impresión de la cavidad dental o de un escáner CT o CBCT.[2] La ventaja de un escáner CBCT es que el implante puede fabricarse antes de la extracción. Con los métodos anteriores, se tarda uno o dos días en fabricar un implante.
Un implante análogo a la raíz puede fabricarse con dióxido de zirconio (zirconia) o con titanio. El zirconio es el material preferido, porque tiene un color más estético, sin decoloración gris visible a través de las encías.[3] El dióxido de zirconio está dopado con pequeñas cantidades de itria, lo que da lugar a un material con propiedades térmicas, mecánicas y eléctricas superiores y una mayor resistencia a la fractura, ideal para los implantes quirúrgicos.[4][5] El circonio no contiene metales y es biocompatible.
Una técnica alternativa utiliza una raíz de titanio fusionada a un pilar de zirconio mediante un proceso de sinterización que elimina cualquier posible microespacio (que podría causar periimplantitis, lo que provocaría una pérdida de hueso alrededor del implante).[6]
En el pasado se han intentado realizar verdaderos implantes dentales "análogos a la raíz" o "anatómicos". Esos primeros intentos fracasaron debido al insuficiente conocimiento de la curación del hueso cortical y esponjoso, el método, el material, el utillaje y la tecnología. El principio de la osteointegración diferenciada, junto con el material y la tecnología adecuados, ha permitido el primer éxito en este campo.[7][8][9]
Osteointegración diferenciada[editar]
La osteointegración diferenciada[10] describe el equilibrio guiado de la distancia, el contacto y la compresión entre el hueso y el implante, teniendo en cuenta el hueso esponjoso o cortical, para lograr una osteointegración segura de los implantes dentales anatómicos individuales.
El diseño de la superficie del implante es crucial para integrar los tres posibles escenarios de contacto primario hueso-implante:
- Contacto en la zona de la réplica radicular exacta, para un inicio inmediato de la osteointegración primaria sin traumatismo óseo;
- Distancia en las delgadas placas corticales bucales y linguales, para evitar con seguridad la fractura y la reabsorción por presión de este hueso sensible;
- Compresión con macro-retenciones sólo en las zonas de hueso esponjoso para mantener una estabilidad primaria segura durante toda la fase de osteointegración.
La combinación de todos estos factores es la condición más importante para la osteointegración de los implantes dentales con forma anatómica.
Técnica[editar]

El tratamiento consta de tres pasos:
- Obtener la forma 3D del diente a sustituir. Esto se hace mediante la extracción cuidadosa del diente y el escaneo de la raíz, la toma de una impresión del hueco del diente o un escaneo CBCT preoperatorio. El implante análogo a la raíz se fabrica mediante la moderna tecnología CAD/CAM, basada en el principio de osteointegración diferenciada;
- Extracción atraumática del diente malo;
- Colocación del implante mediante un golpeteo. En general, no es necesaria ninguna intervención quirúrgica. En particular, no es necesaria ninguna elevación de seno o cirugía invasiva. El implante se coloca inmediatamente si se ha elaborado previamente a partir de un escáner CBCT, o al día siguiente si hay que escanear la raíz o se utiliza una impresión del alveolo. Se coloca una férula protectora para proteger el implante durante el periodo de cicatrización.
El tiempo de recuperación es muy rápido, ya que no se traumatizan los tejidos blandos ni los duros. Normalmente, incluso el día después de la colocación del implante no hay hinchazón, hematomas ni dolor. Tras un periodo de cicatrización de 8 a 12 semanas, el dentista de cabecera puede colocar la corona definitiva.
Ventajas[editar]
Algunas de las ventajas del procedimiento se listan a continuacóin:[9][11][12]
- Puede ser colocado por cualquier dentista de cabecera, sin necesidad de conocimientos quirúrgicos específicos; no existen directrices además de las indicaciones y contraindicaciones. El implante se coloca con herramientas sencillas, normalmente en menos de un minuto.
- Forma natural: un implante anatómico fresado a medida reproduce la forma natural de un diente, por lo que simplemente encaja en la cavidad dental. Al igual que el diente original, un implante anatómico radicular puede tener formas uni o multirradiculares.
- Estética: un RAI de cerámica se asemeja mucho al color de un diente natural. Por tanto, no hay decoloración a través de las encías, como suele ocurrir con los implantes de titanio.
- No es necesario perforar ni operar, ni aumentar el hueso. El paciente nunca necesita una elevación de seno. No hay pérdida de hueso adicional, a diferencia de un implante convencional en el que hay que perforar el hueso. No se necesitan antibióticos.
- Riesgo extremadamente bajo de periimplantitis: un implante convencional tiene una rosca de tornillo que es propensa a la periimplantitis si se expone al entorno bucal. Un RAI no tiene ninguno de estos problemas. Asimismo, al tratarse de un implante de una sola pieza, no existen huecos que puedan infectarse.
- Inmediato: un RAI se coloca en el alveolo dental inmediatamente o al día siguiente de la extracción del diente. Es imposible dañar las raíces vecinas, los nervios o los senos paranasales.
- Ampliamente aplicable: Los RAI pueden utilizarse en aproximadamente el 30% de los casos, frente al 5% de los implantes convencionales. La tecnología está completamente abierta a todos los métodos habituales de reconstrucción de coronas.
- Las consecuencias en caso de fracaso del implante son mínimas: la anatomía del paciente no se ha alterado (el alveolo del diente no ha cambiado), por lo que sigue existiendo la opción de cambiar a un tratamiento convencional.
Riesgos y complicaciones[editar]
Las alteraciones de la forma de la RAI, teniendo en cuenta la patología del paciente, sólo pueden ser realizadas por un profesional con los conocimientos, la experiencia y las habilidades necesarias.[6][13] Una tasa de fracasos del 10% parece elevada debido a las amplias indicaciones de esta solución de implante; casi todos los fracasos se producen en las primeras 4 semanas. Después de este periodo, es raro que falle un implante.
Historia[editar]
El primer implante dental conocido, descubierto en Honduras y que data del año 600 d. C., es el de una mujer maya a la que se le implantaron varios incisivos tallados en conchas marinas. Al menos uno de estos implantes se había osteointegrado.[14]
En tiempos modernos, Hodosh y sus colegas informaron de un implante de réplica de diente en babuinos ya en 1969, pero el análogo de diente de polimetacrilato estaba encapsulado por tejido blando en lugar de osteointegrado.[15][16]
En 1992, Lundgren y sus colegas utilizaron implantes de titanio análogos a la raíz en un modelo experimental de colocación inmediata de implantes en perros, con una integración ósea en el 88% de los casos.[17] Se consideró que un buen ajuste entre el implante y el hueso era un factor importante para el éxito del implante.
Por este motivo, Kohal et al. perfeccionaron en 1997 el enfoque de los implantes de titanio análogos a la raíz en monos, utilizando implantes ligeramente más grandes para compensar la pérdida del ligamento periodontal. Esto proporcionó un mejor ajuste entre el implante y el alveolo de extracción. En varios casos, la inserción del implante provocó fracturas en la fina pared bucal del hueso alveolar.[18]
Un estudio clínico posterior realizado en humanos en 2002 con implantes de titanio idénticos a la raíz mostró una excelente estabilidad primaria, pero, decepcionantemente, casi la mitad de los implantes fallaron después de 9 meses. Este sistema de implantes en particular no se recomendó para su uso clínico, y los ensayos clínicos se interrumpieron.[19][20]
Un nuevo intento fue realizado por Pirker et al 2004 en un ensayo en humanos con implantes de zirconio análogo a la raíz, pero esta vez aplicando osteointegración diferenciada en la superficie. En 2011 informó del 90% de éxito con este método en un ensayo en humanos de 2,5 años.[9]
Mangano et al, en Italia, informaron en 2012 del uso clínico con éxito de un implante análogo a la raíz hecho a medida mediante formación directa de metal por láser (DLMF) a partir de un escáner CBCT. Esto demostró que es posible combinar los datos 3D de la CBCT y la tecnología CAD/CAM para fabricar implantes análogos a la raíz con suficiente precisión.[21]
En 2012, Moin et al, en los Países Bajos, investigaron la precisión de la tecnología CBCT y CAD/CAM en implantes análogos a la raíz individuales, y concluyeron que esta técnica podría proporcionar potencialmente implantes dentales precisos para su colocación inmediata.[22]
Pour et al en Alemania informaron de una sustitución de un solo diente con un implante híbrido raíz-análogo en 2017, utilizando un implante de titanio fusionado con una cubierta de cerámica en la zona estética.[23]
Investigación actual y éxito comercial[editar]
Los RAI de éxito son una tecnología relativamente joven. A diferencia de los implantes geométricos convencionales, sólo unos pocos grupos científicos han realizado trabajos en este campo desde 1964. Se están realizando esfuerzos para combinar los escaneos CBCT con la tecnología CAD/CAM, lo que llevaría a nuevos avances en este campo.[21][22]
En la implantología existe una creciente preocupación por la estética, la biocompatibilidad y el comportamiento corrosivo de los materiales.[6] Aunque los implantes de zirconia análogos a la raíz hechos a medida ofrecen ventajas significativas con respecto a los implantes de titanio convencionales,[11][13] y los estudios de seguimiento con pacientes muestran altas tasas de éxito y resultados estéticos satisfactorios, se necesitan más estudios para evaluar las interacciones entre la superficie y el hueso y el comportamiento mecánico de la zirconia.[6][11][12]
Se han comercializado varios sistemas de implantes dentales análogos a la raíz, con distintos grados de éxito.[6] Sin embargo, hasta ahora ningún sistema de implante dental análogo a la raíz ha recibido la aprobación reglamentaria.
Referencias[editar]
- ↑ Cai, H; Chen, J; Li, C; Wang, J; Wan, Q; Liang, X (2018). «Quantitative discoloration assessment of peri-implant soft tissue around zirconia and other abutments with different colours: A systematic review and meta-analysis.». Journal of Dentistry 70 (Mar): 110-117. PMID 29371043. doi:10.1016/j.jdent.2018.01.003.
- ↑ Evans, Zachary P.; Renne, Walter G.; Bacro, Thierry R.; Mennito, Anthony S.; Ludlow, Mark E.; Lecholop, Michael K. (2018). «Anatomic Customization of Root-Analog Dental Implants With Cone-Beam CT and CAD/CAM Fabrication: A Cadaver-Based Pilot Evaluation». Journal of Oral Implantology 44 (1): 15-25. PMID 29064779. doi:10.1563/aaid-joi-D-17-00090.
- ↑ Happe, Arndt; Schulte-Mattler, Verena; Strassert, Christian; Naumann, Michael; Stimmelmayr, Michael; Zoller, Joachim; Rothamel, Daniel (2013). «In Vitro Color Changes of Soft Tissues Caused by Dyed Fluorescent Zirconia and Nondyed, Nonfluorescent Zirconia in Thin Mucosa». The International Journal of Periodontics & Restorative Dentistry 33 (1): e1-8. PMID 23342353. doi:10.11607/prd.1303.
- ↑ Gautam, C; Joyner, Jarin; Gautam, Amarendra; Rao, Jitendra; Vajtai, Robert (2016). «Zirconia Based Dental Ceramics: Structure, Mechanical Properties, Biocompatibility and Applications». Dalton Transactions 45 (11): 19194-19215. PMID 27892564. doi:10.1039/C6DT03484E.
- ↑ El-Ghany, Ossama Saleh Abd; Sherief, Ashraf Husein (2016). «Zirconia based ceramics, some clinical and biological aspects: Review». Future Dental Journal 2 (2): 55-64. doi:10.1016/j.fdj.2016.10.002.
- ↑ a b c d e Saeidi Pour, R.; Freitas Rafael, C.; Engler, M.L.P.D.; Edelhoff, D.; Klaus, G.; Prandtner, O.; Berthold, M.; Liebermann, A. (2019). «Historical development of root analogue implants: a review of published papers». British Journal of Oral and Maxillofacial Surgery 57 (6): 496-504. PMID 31085016. S2CID 155089688. doi:10.1016/j.bjoms.2019.01.021.
- ↑ Pirker, W; Kocher, A (2008). «Immediate, non-submerged, root-analogue zirconia implant in single tooth replacement.». International Journal of Oral and Maxillofacial Surgery 37 (3): 293-5. PMID 18272340. doi:10.1016/j.ijom.2007.11.008.
- ↑ Pirker, W; Kocher, A (2009). «Immediate, non-submerged, root-analogue zirconia implants placed into single-rooted extraction sockets: 2-year follow-up of a clinical study.». International Journal of Oral and Maxillofacial Surgery 38 (11): 1127-32. PMID 19665354. doi:10.1016/j.ijom.2009.07.008.
- ↑ a b c Pirker, W; Wiedemann, D; Lidauer, A; Kocher, A (2011). «Immediate, single stage, truly anatomic zirconia implant in lower molar replacement: a case report with 2.5 years follow-up.». International Journal of Oral and Maxillofacial Surgery 40 (2): 212-6. PMID 20833511. doi:10.1016/j.ijom.2010.08.003.
- ↑ Pirker, W; Kocher, A (2009). «True Anatomic Immediate Dental Implant Method: A Clinical Case». International Magazine of Oral Implantology (4): 10-14.
- ↑ a b c Chong, Chin Chen; Pfaff, Jacqueline A (2020). «Clinical Outcome of Root Analog Dental Zirconia Implants: A Systematic Literature Review». Online Journal of Dentistry & Oral Health 3 (3). doi:10.33552/OJDOH.2020.03.000564.
- ↑ a b Pessanha-Andrade, M; Sordi, MB; Henriques, B; Silva, FS; Teughels, W; Souza, JCM (2018). «Custom-made root-analogue zirconia implants: A scoping review on mechanical and biological benefits.». Journal of Biomedical Materials Research Part B: Applied Biomaterials 8 (106): 2888-2900. PMID 30070423. doi:10.1002/jbm.b.34147.
- ↑ a b Böse, MWH; Hildebrand, D; Beuer, F; Wesemann, C; Schwerdtner, P; Pieralli, S; Spies, BC (2020). «Clinical Outcomes of Root-Analogue Implants Restored with Single Crowns or Fixed Dental Prostheses: A Retrospective Case Series.». Journal of Clinical Medicine 9 (8): 2346. PMC 7465378. PMID 32717843. doi:10.3390/jcm9082346.
- ↑ Misch, Carl E (2015). «Chapter 2: Generic Root Form Component Terminology». Dental Implant Prosthetics (2nd edición). Mosby. pp. 26-45. ISBN 9780323078450.
- ↑ Hodosh, M; Povar, M; Shklar, G (1969). «The dental polymer implant concept». The Journal of Prosthetic Dentistry 22 (3): 371-380. PMID 4979523. doi:10.1016/0022-3913(69)90200-5.
- ↑ Hodosh, M; Shklar, G; Povar, M (1974). «The porous vitreous carbon/polymethacrylate tooth implant: Preliminary studies». The Journal of Prosthetic Dentistry 32 (3): 326-334. PMID 4612143. doi:10.1016/0022-3913(74)90037-7.
- ↑ Lundgren, D; Rylander, H; Andersson, M; Johansson, M; Albrektsson, T (1992). «Healing-in of root analogue titanium implants placed in extraction sockets. An experimental study in the beagle dog.». Clinical Oral Implants Research 3 (3): 136-43. PMID 1290794. doi:10.1034/j.1600-0501.1992.030306.x.
- ↑ Kohal, RJ; Hürzeler, MB; Mota, LF; Klaus, G; Caffesse, RG; JR, Strub (1997). «Custom-made root analogue titanium implants placed into extraction sockets. An experimental study in monkeys.». Clinical Oral Implants Research 8 (5): 386-392. PMID 9612143. doi:10.1034/j.1600-0501.1997.080505.x.
- ↑ Heydecke, G; Kohal, R; Gläser, R (1999). «Optimal Esthetics in Single-Tooth Replacement with the Re-Implant System: A Case Report». The International Journal of Prosthodontics 12 (2): 184-189. PMID 10371922.
- ↑ Kohal, R; Klaus, G; Strub, J (2002). «Clinical investigation of a new dental immediate implant system. The ReImplant-System.». Deutsche Zahnärztliche Zeitschrift 57 (8): 495-497.
- ↑ a b Mangano, F; Cirotti, B; Sammons, R; Mangano, C (2012). «Custom-made, root-analogue direct laser metal forming implant: a case report». Lasers in Medical Science 27 (6): 1241-1245. PMID 22699801. S2CID 9676516. doi:10.1007/s10103-012-1134-z.
- ↑ a b Anssari Moin, D; Hassan, B; Mercelis, P; Wismeijer, D (2013). «Designing a novel dental root analogue implant using cone beam computed tomography and CAD/CAM technology». Clinical Oral Implants Research 24: 25-27. PMID 22092354. doi:10.1111/j.1600-0501.2011.02359.x.
- ↑ Pour, RS; Randelzhofer, P; Edelhoff, D; Prandtner, O; Rafael, CF; Liebermann, A (2017). «Innovative Single-Tooth Replacement with an Individual Root-Analog Hybrid Implant in the Esthetic Zone: Case Report». The International Journal of Oral & Maxillofacial Implants 32 (3): e153-e160. PMID 28494041. doi:10.11607/jomi.5562.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Root_analogue_dental_implant» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.