Química bioortogonal
El término química bioortogonal se refiere a cualquier reacción química que puede ocurrir dentro de los sistemas vivos sin interferir con los procesos bioquímicos nativos.[1][2][3] El término fue acuñado por Carolyn R. Bertozzi en 2003.[4][5] Desde su introducción, el concepto de reacción bioortogonal ha permitido el estudio de biomoléculas como glicanos, proteínas[6] y lípidos[7] en tiempo real en sistemas vivos sin toxicidad celular. Se han desarrollado varias estrategias de ligación química que cumplen con los requisitos de bioortogonalidad, incluida la cicloadición 1,3-dipolar entre azidas y ciclooctinas (también denominada química click sin cobre),[8] entre nitronas y ciclooctinas,[9] oxima / formación de hidrazona a partir de aldehídos y cetonas,[10] la ligadura de tetrazina,[11] la reacción click basada en isocianuro,[12] y, más recientemente, la ligadura de cuadriciclano.[13]

El uso de la química bioortogonal suele realizarse en dos pasos. En primer lugar, se modifica un sustrato celular con un grupo funcional bioortogonal (informador químico) y se introduce en la célula; los sustratos incluyen metabolitos, inhibidores enzimáticos, etc. El reportero químico no debe alterar drásticamente la estructura del sustrato para no afectar a su bioactividad. En segundo lugar, se introduce una sonda que contiene el grupo funcional complementario para que reaccione y etiquete el sustrato.
Aunque se han desarrollado reacciones bioortogonales eficaces, como la química click sin cobre, el desarrollo de nuevas reacciones sigue generando métodos ortogonales de etiquetado que permitan utilizar varios métodos de etiquetado en los mismos biosistemas. Bertozzi recibió el Premio Nobel de Química en 2022 por su desarrollo de la química click y la química bioortogonal.[14]
Etimología[editar]
La palabra bioortogonal procede del griego bio- "vivo" y orthogōnios "en ángulo recto". Por tanto, es literalmente una reacción que va perpendicular a un sistema vivo, por lo que no lo perturba.
Requisitos para la bioortogonalidad[editar]
Para ser considerada bioortogonal, una reacción debe cumplir una serie de requisitos: [cita requerida]
- Selectividad: La reacción debe ser selectiva entre grupos funcionales endógenos para evitar reacciones secundarias con compuestos biológicos.
- Inercia biológica: Los agentes reactivos y el enlace resultante no deben poseer ningún modo de reactividad capaz de alterar la funcionalidad química nativa del organismo estudiado.
- Inercia química: el enlace covalente debe ser fuerte e inerte a las reacciones biológicas.
- Cinética: la reacción debe ser rápida para que se logre la ligadura covalente antes del metabolismo y la eliminación de la sonda. La reacción debe ser rápida, en la escala de tiempo de los procesos celulares (minutos) para evitar la competencia en reacciones que pueden disminuir las pequeñas señales de especies menos abundantes. Las reacciones rápidas también ofrecen una respuesta rápida, necesaria para realizar un seguimiento preciso de los procesos dinámicos.
- Biocompatibilidad de la reacción: las reacciones deben ser no tóxicas y deben funcionar en condiciones biológicas teniendo en cuenta el pH, los ambientes acuosos y la temperatura. La farmacocinética es una preocupación creciente a medida que la química bioortogonal se expande a modelos animales vivos.
- Ingeniería accesible: el reportero químico debe ser capaz de incorporarse en biomoléculas a través de alguna forma de ingeniería metabólica o de proteínas. Óptimamente, uno de los grupos funcionales también es muy pequeño para que no perturbe el comportamiento nativo.
Ligación de Staudinger[editar]
La ligación de Staudinger es una reacción desarrollada por el grupo Bertozzi en el año 2000 que se basa en la clásica reacción de Staudinger de azidas con triarilfosfinas.[15] Inauguró el campo de la química bioortogonal como la primera reacción con grupos funcionales completamente abióticos, aunque ya no se usa tanto. La ligadura de Staudinger se ha utilizado tanto en células vivas como en ratones vivos.[5]
Bioortogonalidad[editar]
La azida puede actuar como un electrófilo suave que prefiere nucleófilos suaves como las fosfinas. Esto contrasta con la mayoría de los nucleófilos biológicos que son típicamente nucleófilos duros. La reacción procede selectivamente en condiciones tolerantes al agua para producir un producto estable.
Las fosfinas están completamente ausentes de los sistemas vivos y no reducen los enlaces disulfuro a pesar del leve potencial de reducción. Se ha demostrado que las azidas son biocompatibles en medicamentos aprobados por la FDA, como la azidotimidina, y mediante otros usos como reticuladores. Además, su pequeño tamaño les permite incorporarse fácilmente a biomoléculas a través de rutas metabólicas celulares.
Mecanismo[editar]
Reacción clásica de Staudinger[editar]
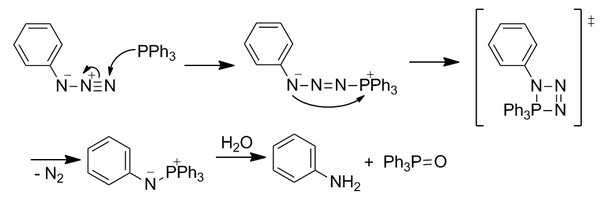
La fosfina nucleófila ataca a la azida en el nitrógeno terminal electrofílico. A través de un estado de transición de cuatro miembros, el N 2 se pierde para formar una aza-ilida. El iluro inestable se hidroliza para formar óxido de fosfina y una amina primaria. Sin embargo, esta reacción no es inmediatamente bioortogonal porque la hidrólisis rompe el enlace covalente en la aza-ilida.
Ligación de Staudinger[editar]

La reacción se modificó para incluir un grupo éster orto al átomo de fósforo en uno de los anillos de arilo para dirigir la aza-ilida a través de una nueva vía de reactividad con el fin de superar la hidrólisis inmediata posicionando el éster para aumentar la concentración local. El ataque nucleofílico inicial sobre la azida es el paso que limita la velocidad. La ilida reacciona con la trampa electrofílica del éster mediante ciclización intramolecular para formar un anillo de cinco miembros. Este anillo sufre hidrólisis para formar un enlace amida estable.
Limitaciones[editar]
Los reactivos de fosfina se oxidan lentamente con el aire en los sistemas vivos. Además, es probable que sean metabolizados in vitro por las enzimas citocromo P450.
La cinética de las reacciones es lenta con constantes de velocidad de segundo orden alrededor de 0.0020 m−1 •s −1 . Los intentos de aumentar las tasas de ataque nucleofílico agregando grupos donantes de electrones a las fosfinas mejoraron la cinética, pero también aumentaron la tasa de oxidación del aire.
La escasa cinética requiere que se utilicen altas concentraciones de fosfina, lo que conlleva problemas de elevada señal de fondo en aplicaciones de imagen. Se han hecho intentos para combatir el problema del alto fondo mediante el desarrollo de reactivos fluorogénicos de fosfina basados en fluoresceína y luciferina, pero la cinética intrínseca sigue siendo una limitación.[16]
Química click sin cobre[editar]
La química click sin cobre es una reacción bioortogonal desarrollada por primera vez por Carolyn Bertozzi como una variante activada de una cicloadición de azida alquino Huisgen, basada en el trabajo de Karl Barry Sharpless et al. A diferencia de la CuAAC, la química de clic sin Cu se ha modificado para que sea bioortogonal mediante la eliminación de un catalizador de cobre citotóxico, lo que permite que la reacción se produzca rápidamente y sin toxicidad para las células vivas. En lugar de cobre, la reacción es una cicloadición alquino-azida promovida por cepa (SPAAC). Se desarrolló como una alternativa más rápida a la ligadura de Staudinger, con las primeras generaciones reaccionando más de sesenta veces más rápido. La bioortogonalidad de la reacción ha permitido aplicar la reacción de clic sin Cu en células cultivadas, peces cebra vivos y ratones.

Toxicidad del cobre[editar]
La clásica cicloadición de azida-alquino catalizada por cobre ha sido una reacción click extremadamente rápida y eficaz para la bioconjugación, pero no es adecuada para su uso en células vivas debido a la toxicidad de los iones Cu(I). La toxicidad se debe al daño oxidativo de las especies reactivas de oxígeno formadas por los catalizadores de cobre. También se ha descubierto que los complejos de cobre inducen cambios en el metabolismo celular y son absorbidos por las células.
Se han desarrollado ligandos para prevenir el daño a las biomoléculas y facilitar su eliminación en aplicaciones in vitro. Sin embargo, se ha descubierto que los diferentes entornos de ligandos de los complejos pueden seguir afectando al metabolismo y la captación, introduciendo una perturbación no deseada en la función celular.[17]
Bioortogonalidad[editar]
El grupo azida es especialmente bioortogonal porque es extremadamente pequeño (favorable para la permeabilidad celular y evita perturbaciones), metabólicamente estable y no existe de forma natural en las células, por lo que no tiene reacciones secundarias biológicas competidoras. Aunque las azidas no son los 1,3-dipolos más reactivos disponibles para la reacción, se prefieren por su relativa falta de reacciones secundarias y su estabilidad en condiciones sintéticas típicas.[18] El alquino no es tan pequeño, pero todavía tiene la estabilidad y la ortogonalidad necesarias para el marcaje in vivo . Los ciclooctinos son tradicionalmente los cicloalquinos más comunes para los estudios de marcado, ya que son el anillo de alquino estable más pequeño.

Mecanismo[editar]
La reacción procede como una cicloadición dipolar 1,3 estándar, un tipo de desplazamiento pericíclico concertado asíncrono. La naturaleza ambivalente del dipolo 1,3 debería hacer imposible la identificación de un centro electrofílico o nucleofílico en la azida, de modo que la dirección del flujo cíclico de electrones no tiene sentido. Sin embargo, los cálculos han demostrado que la distribución de electrones entre los nitrógenos hace que el átomo de nitrógeno más interno tenga la mayor carga negativa.[19]
Regioselectividad[editar]
Aunque la reacción produce una mezcla regioisomérica de triazoles, la falta de regioselectividad en la reacción no es una preocupación importante para la mayoría de las aplicaciones actuales. Los requisitos más regioespecíficos y menos bioortogonales se satisfacen mejor con la cicloadición de Huisgen catalizada por cobre, especialmente dada la dificultad sintética (en comparación con la adición de un alquino terminal) de sintetizar un ciclooctino tenso.
Desarrollo de ciclooctinos[editar]
| Ciclooctino | Constante de velocidad de segundo orden (m−1·s−1 ) |
|---|---|
| OCT | 0.0024 |
| ALO | 0.0013 |
| MOFO | 0.0043 |
| DIFO | 0.076 |
| DIBO | 0.057 |
| BARAC | 0,96 |
| DIBAC (ADIBO) | 0.31 |
| DIMAC | 0.0030 |

El OCT fue el primer ciclooctino desarrollado para la química click libre de Cu. Mientras que los alquinos lineales no reaccionan a temperaturas fisiológicas, el OCT pudo reaccionar fácilmente con azidas en condiciones biológicas sin mostrar toxicidad. Sin embargo, era poco soluble en agua y la cinética apenas mejoró con respecto a la ligadura de Staudinger. El ALO (octino sin arilo) se desarrolló para mejorar la solubilidad en agua, pero aún tenía una cinética deficiente.
Se crearon ciclooctinos monofluorados (MOFO) y difluorados (DIFO) para aumentar la velocidad mediante la adición de sustituyentes de flúor atrayentes de electrones en la posición propargílica. El flúor es un buen grupo atractor de electrones en términos de accesibilidad sintética e inercia biológica. En particular, no puede formar un aceptor electrofílico de Michael que pueda reaccionar de forma secundaria con nucleófilos biológicos.[8] El DIBO (dibenzociclooctino) se desarrolló como una fusión de dos anillos de arilo, lo que resultó en una tensión muy alta y una disminución en las energías de distorsión. Se propuso que la sustitución de biarilo aumenta la tensión del anillo y proporciona conjugación con el alquino para mejorar la reactividad. Aunque los cálculos han predicho que la sustitución de monoarilo proporcionaría un equilibrio óptimo entre el choque estérico (con la molécula de azida) y la tensión,[20] se ha demostrado que los productos monoarilados son inestables.
La BARAC (biarilazaciclooctinona) añadió un enlace amida que agrega un centro similar a sp2 para aumentar la velocidad por distorsión. La resonancia de amida contribuye a una tensión adicional sin crear una insaturación adicional que daría lugar a una molécula inestable. Además, la adición de un heteroátomo en el anillo de ciclooctino mejora tanto la solubilidad como la farmacocinética de la molécula. La BARAC tiene suficiente velocidad (y sensibilidad) en la medida en que no es necesario lavar el exceso de sonda para reducir el fondo. Esto lo hace extremadamente útil en situaciones en las que el lavado es imposible, como en imágenes en tiempo real o imágenes de animales completos. Aunque la BARAC es extremadamente útil, su baja estabilidad requiere que se almacene a 0 °C, protegido de la luz y el oxígeno.[21]
Se realizaron más variaciones de ajustes en BARAC para producir DIBAC/ADIBO para agregar tensión en el anillo distal y reducir la carga estérica alrededor del alquino para aumentar aún más la reactividad. Keto-DIBO, en el que el grupo hidroxilo se ha convertido en una cetona, tiene un aumento de tres veces en la velocidad debido a un cambio en la conformación del anillo. Los intentos de fabricar un difluorobenzociclooctino ( DIFBO ) no tuvieron éxito debido a la inestabilidad.
Los problemas con DIFO con estudios en ratones in vivo ilustran la dificultad de producir reacciones bioortogonales. Aunque DIFO fue extremadamente reactivo en el marcaje de células, se desempeñó deficientemente en estudios con ratones debido a la unión con la albúmina sérica. La hidrofobicidad del ciclooctino promueve el secuestro por membranas y proteínas séricas, reduciendo las concentraciones biodisponibles. En respuesta, se desarrolló DIMAC (dimethoxyazacyclooctyne) para aumentar la solubilidad en agua, la polaridad y la farmacocinética,[22] aunque los esfuerzos en el etiquetado bioortogonal de modelos de ratón aún están en desarrollo.
Reactividad[editar]
Los esfuerzos computacionales han sido vitales para explicar la termodinámica y la cinética de estas reacciones de cicloadición, lo que ha desempeñado un papel vital para continuar mejorando la reacción. Hay dos métodos para activar alquinos sin sacrificar la estabilidad: disminuir la energía del estado de transición o disminuir la estabilidad de los reactivos.

Disminución de la estabilidad de los reactivos[editar]
Houk[23] ha propuesto que las diferencias en la energía (Ed ‡ ) requerida para distorsionar la azida y el alquino en las geometrías del estado de transición controlan las alturas de barrera para la reacción. La energía de activación (E ‡ ) es la suma de las distorsiones desestabilizadoras y las interacciones estabilizadoras (Ei ‡ ). La distorsión más significativa está en el grupo funcional azida con menor contribución de la distorsión alquino. Sin embargo, solo el ciclooctino puede modificarse fácilmente para una mayor reactividad. Las barreras de reacción calculadas para fenilazida y acetileno (16,2 kcal/mol) frente a ciclooctino (8,0 kcal/mol) dan como resultado un aumento de velocidad previsto de 106 . El ciclooctino requiere menos energía de distorsión (1,4 kcal/mol frente a 4,6 kcal/mol), lo que da como resultado una energía de activación más baja a pesar de una energía de interacción más pequeña.
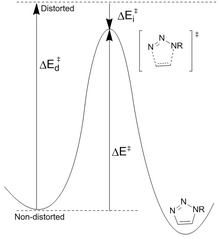
Disminución de la energía del estado de transición[editar]
Los grupos atractores de electrones, como el flúor, aumentan la velocidad al disminuir la energía LUMO y la brecha HOMO-LUMO. Esto conduce a una mayor transferencia de carga de la azida al ciclooctino fluorado en el estado de transición, aumentando la energía de interacción (menor valor negativo) y la energía de activación general.[24] La disminución de LUMO es el resultado de la hiperconjugación entre los orbitales donantes de alquino π y los aceptores de CF σ*. Estas interacciones proporcionan estabilización principalmente en el estado de transición como resultado del aumento de las capacidades de donante/aceptor de los enlaces a medida que se distorsionan. Los cálculos de NBO han demostrado que la distorsión del estado de transición aumenta la energía de interacción en 2,8 kcal/mol.
La hiperconjugación entre enlaces π fuera del plano es mayor porque los enlaces π dentro del plano están mal alineados. Sin embargo, la flexión del estado de transición permite que los enlaces π en el plano tengan una disposición más antiperiplanar que facilita la interacción. La estabilización adicional de la energía de interacción hiperconjugativa se consigue mediante un aumento de la población electrónica de la σ* debido a la formación del enlace CN. La hiperconjugación negativa con los enlaces σ* CF potencia esta interacción estabilizadora.[19]
Regioselectividad[editar]

Aunque la regioselectividad no es un gran problema en las actuales aplicaciones de imagen de la química click sin cobre, es un problema que impide futuras aplicaciones en campos como el diseño de fármacos o la peptidomimética.[25]
Actualmente, la mayoría de los ciclooctinos reaccionan para formar mezclas regioisoméricas. El análisis computacional ha encontrado que mientras la regioselectividad en fase gaseosa se calcula para favorecer la adición 1,5 sobre la adición 1,4 por hasta 2.9 kcal/mol en energía de activación, las correcciones de solvatación resultan en las mismas barreras de energía para ambos regioisómeros. Mientras que el isómero 1,4 en la cicloadición de DIFO se ve desfavorecido por su mayor momento dipolar, la solvatación lo estabiliza más fuertemente que el isómero 1,5, erosionando la regioselectividad.[24]
Los ciclooctinos simétricos como BCN (biciclo[6.1.0]nonyne) forman un solo regioisómero tras la cicloadición[26] y pueden servir para abordar este problema en el futuro.
Aplicaciones[editar]
La aplicación más extendida de la química click sin cobre es la obtención de imágenes biológicas en células vivas o animales que utilizan una biomolécula etiquetada con azida y una ciclooctina que lleva un agente de formación de imágenes.
Las variantes fluorescentes de ceto y oxima de DIBO se utilizan en reacciones click de interruptor fluorado en las que la fluorescencia de la ciclooctina se extingue por el triazol que se forma en la reacción.[27] Por otro lado, se han desarrollado ciclooctinos conjugados con cumarina, como coumBARAC, de modo que el alquino suprime la fluorescencia mientras que la formación de triazol aumenta diez veces el rendimiento cuántico de fluorescencia.[28]
Se ha investigado el control espacial y temporal del etiquetado del sustrato utilizando ciclooctinos fotoactivables. Esto permite equilibrar el alquino antes de la reacción para reducir los artefactos como resultado de los gradientes de concentración. Los ciclooctinos enmascarados no pueden reaccionar con azidas en la oscuridad, pero se vuelven alquinos reactivos tras la irradiación con luz.[29]

Se está explorando la química click sin cobre para su uso en la síntesis de agentes de formación de imágenes PET que deben fabricarse rápidamente con alta pureza y rendimiento para minimizar la descomposición isotópica antes de que se puedan administrar los compuestos. Tanto las constantes de alta velocidad como la bioortogonalidad de SPAAC son susceptibles de la química PET.[30]
Una empresa llamada Shasqi está aplicando la química click a la terapia contra el cáncer y está evaluando al candidato principal en pacientes con cáncer en un ensayo de fase 2.[31][32]
Otras reacciones bioortogonales[editar]
Cicloadición de dipolo de nitrona[editar]
La química click sin cobre se ha adaptado para usar nitronas como dipolo 1,3 en lugar de azidas y se ha usado en la modificación de péptidos.[9]
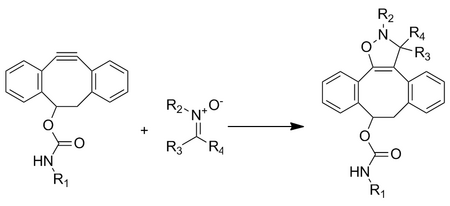
Esta cicloadición entre una nitrona y un ciclooctino forma isoxazolinas N-alquiladas. La velocidad de reacción aumenta con el agua y es extremadamente rápida con constantes de velocidad de segundo orden que van de 12 a 32 m−1 •s −1, dependiendo de la sustitución de la nitrona. Aunque la reacción es extremadamente rápida, enfrenta problemas para incorporar la nitrona en biomoléculas a través del marcaje metabólico. El etiquetado solo se ha logrado mediante la modificación de péptidos postraduccionales.
Cicloadición de norborneno[editar]

Las cicloadiciones dipolares 1,3 se han desarrollado como una reacción bioortogonal utilizando un óxido de nitrilo como dipolo 1,3 y un norborneno como dipolarófilo. Su uso principal ha sido el etiquetado de ADN y ARN en sintetizadores automatizados de oligonucleótidos,[33] y la reticulación de polímeros en presencia de células vivas.[34]
Los norbornenos se seleccionaron como dipolarófilos debido a su equilibrio entre la reactividad y la estabilidad promovidas por cepas. Los inconvenientes de esta reacción incluyen la reactividad cruzada del óxido de nitrilo debido a la fuerte electrofilia y la cinética de reacción lenta.
Cicloadición de oxanorbornadieno[editar]

La cicloadición de oxanorbornadieno es una cicloadición 1,3-dipolar seguida de una reacción retro-Diels Alder para generar un conjugado ligado a triazol con la eliminación de una molécula de furano .[35] El trabajo preliminar ha establecido su utilidad en experimentos de marcaje de péptidos y también se ha utilizado en la generación de compuestos de imágenes SPECT.[36] Más recientemente, se describió el uso de un oxanorbornadieno en una reacción "iClick" a temperatura ambiente sin catalizador, en la que un aminoácido modelo se une a la fracción metálica, en un enfoque novedoso de las reacciones bioortogonales.[37]
La deformación del anillo y la deficiencia de electrones en el oxanorbornadieno aumentan la reactividad hacia el paso limitante de la velocidad de la cicloadición. La reacción retro-Diels Alder se produce rápidamente después para formar el 1,2,3 triazol estable. Los problemas incluyen la escasa tolerancia a los sustituyentes que pueden cambiar la electrónica del oxanorbornadieno y las bajas velocidades (constantes de velocidad de segundo orden del orden de 10-4).
Ligación de tetrazina[editar]

La ligación de tetrazina es la reacción de un trans-cicloocteno y una s-tetrazina en una reacción de Diels Alder de demanda inversa seguida de una reacción de retro-Diels Alder para eliminar gas nitrógeno.[38] La reacción es extremadamente rápida con una constante de velocidad de segundo orden de 2000 m −1 –s −1 (en metanol/agua 9:1) que permite modificaciones de biomoléculas en concentraciones extremadamente bajas.
Según el trabajo computacional de Bach, la energía de deformación de los ciclooctenos Z es de 7,0 kcal/mol, frente a las 12,4 kcal/mol del ciclooctano, debido a la pérdida de dos interacciones transanulares. El E-cicloocteno tiene un doble enlace muy retorcido, lo que resulta en una energía de deformación de 17,9 kcal/mol.[39] Como tal, el trans-cicloocteno altamente tenso se usa como dienófilo reactivo. El dieno es una 3,6-diaril-s-tetrazina que ha sido sustituida para resistir la reacción inmediata con agua. La reacción procede a través de una cicloadición inicial seguida de un Diels Alder inverso para eliminar el N 2 y evitar la reversibilidad de la reacción.[11]
La reacción no sólo es tolerante al agua, sino que se ha descubierto que la velocidad aumenta en medios acuosos. También se han llevado a cabo reacciones utilizando norbornenos como dienófilos a velocidades de segundo orden del orden de 1 m-1 •s-1 en medio acuoso. La reacción se ha aplicado en el etiquetado de células vivas[40] y en el acoplamiento de polímeros.[41]
[4+1] Cicloadición[editar]

Esta reacción click de isocianuro es una cicloadición [4+1] seguida de una eliminación retro-Diels Alder de N2.[12]
La reacción procede con una cicloadición inicial [4+1] seguida de una reversión para eliminar un sumidero termodinámico y evitar la reversibilidad. Este producto es estable si se utiliza una amina terciaria o un isocianopropanoato. Si se utiliza un isocianuro secundario o primario, el producto formará una imina que se hidroliza rápidamente.
El isocianuro es un reportero químico favorecido debido a su pequeño tamaño, estabilidad, no toxicidad y ausencia en sistemas de mamíferos. Sin embargo, la reacción es lenta, con constantes de velocidad de segundo orden del orden de10 −2 m−1 •s−1.
Química fotoclick de tetrazol[editar]

La química fotoclick utiliza una cicloeliminación fotoinducida para liberar N2. Esto genera un intermediario de imina de nitrilo 1,3 de vida corta a través de la pérdida de gas nitrógeno, que se somete a una cicloadición 1,3-dipolar con un alqueno para generar cicloaductos de pirazolina.[12]
La fotoinducción tiene lugar con una breve exposición a la luz (la longitud de onda depende del tetrazol) para minimizar el fotodaño de las células. La reacción se potencia en condiciones acuosas y genera un único regioisómero.
La imina de nitrilo transitoria es altamente reactiva para la cicloadición 1,3-dipolar debido a una estructura doblada que reduce la energía de distorsión. La sustitución con grupos donadores de electrones en anillos de fenilo aumenta la energía HOMO, cuando se coloca en la imina de nitrilo 1,3 y aumenta la velocidad de reacción.
Las ventajas de este enfoque incluyen la capacidad de controlar espacial o temporalmente la reacción y la capacidad de incorporar tanto alquenos como tetrazoles en biomoléculas utilizando métodos biológicos sencillos como la codificación genética.[42] Además, el tetrazol puede diseñarse para ser fluorogénico con el fin de controlar el progreso de la reacción.[43]
Ligadura de cuadriciclanos[editar]
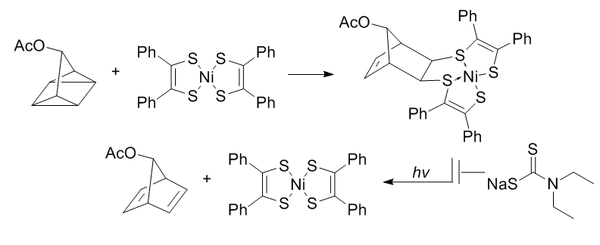
La ligadura de cuadriciclanos utiliza un cuadriciclano altamente deformado para someterse a una cicloadición [2+2+2] con sistemas π.[13]

El cuadriciclano es abiótico, no reactivo con biomoléculas (debido a su completa saturación), relativamente pequeño y altamente tenso (~80 kcal/mol). Sin embargo, es muy estable a temperatura ambiente y en condiciones acuosas a pH fisiológico. Es capaz de reaccionar selectivamente con sistemas π pobres en electrones, pero no con alquenos simples, alquinos o ciclooctinos.
Se eligió bis(ditiobencil)níquel(II) como compañero de reacción de una selección de candidatos basada en la reactividad. Para evitar la reversión a norbornadieno inducida por la luz, se añade dietilditiocarbamato para quelar el níquel del producto.
Estas reacciones se ven reforzadas por condiciones acuosas con una constante de velocidad de segundo orden de 0,25 m−1 •s −1 . De particular interés es que se ha demostrado que es bioortogonal tanto para la formación de oximas como para la química de clics sin cobre.
Usos[editar]
La química bioortogonal es una herramienta atractiva para experimentos de orientación previa en imágenes nucleares y radioterapia.[44]
Referencias[editar]
- ↑ Sletten, Ellen M.; Bertozzi, Carolyn R. (2009). «Bioorthogonal chemistry: fishing for selectivity in a sea of functionality». Angewandte Chemie (International Ed. in English) 48 (38): 6974-6998. ISSN 1521-3773. PMC 2864149. PMID 19714693. doi:10.1002/anie.200900942. Consultado el 25 de enero de 2023.
- ↑ Prescher, Jennifer A.; Dube, Danielle H.; Bertozzi, Carolyn R. (19 de agosto de 2004). «Chemical remodelling of cell surfaces in living animals». Nature 430 (7002): 873-877. ISSN 1476-4687. PMID 15318217. doi:10.1038/nature02791. Consultado el 25 de enero de 2023.
- ↑ Prescher, Jennifer A.; Bertozzi, Carolyn R. (2005-06). «Chemistry in living systems». Nature Chemical Biology 1 (1): 13-21. ISSN 1552-4450. PMID 16407987. doi:10.1038/nchembio0605-13. Consultado el 25 de enero de 2023.
- ↑ Hang, Howard C.; Yu, Chong; Kato, Darryl L.; Bertozzi, Carolyn R. (9 de diciembre de 2003). «A metabolic labeling approach toward proteomic analysis of mucin-type O-linked glycosylation». Proceedings of the National Academy of Sciences of the United States of America 100 (25): 14846-14851. ISSN 0027-8424. PMC 299823. PMID 14657396. doi:10.1073/pnas.2335201100. Consultado el 25 de enero de 2023.
- ↑ a b Sletten, Ellen M.; Bertozzi, Carolyn R. (20 de septiembre de 2011). «From mechanism to mouse: a tale of two bioorthogonal reactions». Accounts of Chemical Research 44 (9): 666-676. ISSN 1520-4898. PMC 3184615. PMID 21838330. doi:10.1021/ar200148z. Consultado el 25 de enero de 2023.
- ↑ Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. (18 de abril de 2011). «Genetically encoded copper-free click chemistry». Angewandte Chemie (International Ed. in English) 50 (17): 3878-3881. ISSN 1521-3773. PMC 3210829. PMID 21433234. doi:10.1002/anie.201008178. Consultado el 25 de enero de 2023.
- ↑ Neef, Anne B.; Schultz, Carsten (2009). «Selective fluorescence labeling of lipids in living cells». Angewandte Chemie (International Ed. in English) 48 (8): 1498-1500. ISSN 1521-3773. PMID 19145623. doi:10.1002/anie.200805507. Consultado el 25 de enero de 2023.
- ↑ a b Baskin, Jeremy M.; Prescher, Jennifer A.; Laughlin, Scott T.; Agard, Nicholas J.; Chang, Pamela V.; Miller, Isaac A.; Lo, Anderson; Codelli, Julian A. et al. (23 de octubre de 2007). «Copper-free click chemistry for dynamic in vivo imaging». Proceedings of the National Academy of Sciences of the United States of America 104 (43): 16793-16797. ISSN 0027-8424. PMC 2040404. PMID 17942682. doi:10.1073/pnas.0707090104. Consultado el 25 de enero de 2023.
- ↑ a b Ning, Xinghai; Temming, Rinske P.; Dommerholt, Jan; Guo, Jun; Ania, Daniel B.; Debets, Marjoke F.; Wolfert, Margreet A.; Boons, Geert-Jan et al. (12 de abril de 2010). «Protein modification by strain-promoted alkyne-nitrone cycloaddition». Angewandte Chemie (International Ed. in English) 49 (17): 3065-3068. ISSN 1521-3773. PMC 2871956. PMID 20333639. doi:10.1002/anie.201000408. Consultado el 25 de enero de 2023.
- ↑ Yarema, K. J.; Mahal, L. K.; Bruehl, R. E.; Rodriguez, E. C.; Bertozzi, C. R. (20 de noviembre de 1998). «Metabolic delivery of ketone groups to sialic acid residues. Application To cell surface glycoform engineering». The Journal of Biological Chemistry 273 (47): 31168-31179. ISSN 0021-9258. PMID 9813021. doi:10.1074/jbc.273.47.31168. Consultado el 25 de enero de 2023.
- ↑ a b Blackman, Melissa L.; Royzen, Maksim; Fox, Joseph M. (15 de octubre de 2008). «Tetrazine ligation: fast bioconjugation based on inverse-electron-demand Diels-Alder reactivity». Journal of the American Chemical Society 130 (41): 13518-13519. ISSN 1520-5126. PMC 2653060. PMID 18798613. doi:10.1021/ja8053805. Consultado el 25 de enero de 2023.
- ↑ a b c Stöckmann, Henning; Neves, André A.; Stairs, Shaun; Brindle, Kevin M.; Leeper, Finian J. (7 de noviembre de 2011). «Exploring isonitrile-based click chemistry for ligation with biomolecules». Organic & Biomolecular Chemistry 9 (21): 7303-7305. ISSN 1477-0539. PMID 21915395. doi:10.1039/c1ob06424j. Consultado el 25 de enero de 2023.
- ↑ a b Sletten, Ellen M.; Bertozzi, Carolyn R. (9 de noviembre de 2011). «A bioorthogonal quadricyclane ligation». Journal of the American Chemical Society 133 (44): 17570-17573. ISSN 1520-5126. PMC 3206493. PMID 21962173. doi:10.1021/ja2072934. Consultado el 25 de enero de 2023.
- ↑ «The Nobel Prize in Chemistry». The Nobel Prize (en inglés estadounidense). Consultado el 25 de enero de 2023.
- ↑ Saxon, E.; Bertozzi, CR (2000). «Cell Surface Engineering by a Modified Staudinger Reaction». Science 287 (5460): 2007-10. Bibcode:2000Sci...287.2007S. PMID 10720325. doi:10.1126/science.287.5460.2007.
- ↑ Pamela, Chang.; Prescher, Jennifer A.; Hangauer, Matthew J.; Bertozzi, Carolyn R. (2008). «Imaging Cell Surface Glycans with Bioorthogonal Chemical Reporters». J Am Chem Soc 129 (27): 8400-8401. PMC 2535820. PMID 17579403. doi:10.1021/ja070238o.
- ↑ Kennedy, David C.; McKay, Craig S.; Legault, Marc C. B.; Danielson, Dana C.; Blake, Jessie A.; Pegoraro, Adrian F.; Stolow, Albert; Mester, Zoltan et al. (2011). «Cellular Consequences of Copper Complexes Used to Catalyze Bioorthogonal Click Reactions». Journal of the American Chemical Society 133 (44): 17993-8001. PMID 21970470. doi:10.1021/ja2083027.
- ↑ Huisgen, Rolf. (1976). «1,3-Dipolar cycloadditions. 76. Concerted nature of 1,3-dipolar cycloadditions and the question of diradical intermediates». The Journal of Organic Chemistry 41 (3): 403-419. doi:10.1021/jo00865a001.
- ↑ a b Gold, Brian; Shevchenko, Nikolay E.; Bonus, Natalie; Dudley, Gregory B.; Alabugin, Igor V. (2011). «Selective Transition State Stabilization via Hyperconjugative and Conjugative Assistance: Stereoelectronic Concept for Copper-Free Click Chemistry». The Journal of Organic Chemistry 77 (1): 75-89. PMID 22077877. doi:10.1021/jo201434w.
- ↑ Chenoweth, Kimberly; Chenoweth, David; Goddard Iii, William A. (2009). «Cyclooctyne-based reagents for uncatalyzed click chemistry: A computational survey». Organic & Biomolecular Chemistry 7 (24): 5255-8. PMID 20024122. doi:10.1039/B911482C.
- ↑ Jewett, John C.; Sletten, Ellen M.; Bertozzi, Carolyn R. (2010). «Rapid Cu-Free Click Chemistry with Readily Synthesized Biarylazacyclooctynones». Journal of the American Chemical Society 132 (11): 3688-90. PMC 2840677. PMID 20187640. doi:10.1021/ja100014q.
- ↑ Sletten, Ellen M.; Bertozzi, Carolyn R. (2008). «A Hydrophilic Azacyclooctyne for Cu-Free Click Chemistry». Organic Letters 10 (14): 3097-9. PMC 2664610. PMID 18549231. doi:10.1021/ol801141k.
- ↑ Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. (2008). «Transition States of Strain-Promoted Metal-Free Click Chemistry: 1,3-Dipolar Cycloadditions of Phenyl Azide and Cyclooctynes». Organic Letters 10 (8): 1633-6. PMID 18363405. doi:10.1021/ol8003657.
- ↑ a b Schoenebeck, Franziska; Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. (2009). «Reactivity and Regioselectivity in 1,3-Dipolar Cycloadditions of Azides to Strained Alkynes and Alkenes: A Computational Study». Journal of the American Chemical Society 131 (23): 8121-33. PMID 19459632. doi:10.1021/ja9003624.
- ↑ Lutz, Jean-François (2008). «Copper-Free Azide Alkyne Cycloadditions: New Insights and Perspectives». Angewandte Chemie International Edition 47 (12): 2182-4. PMID 18264961. doi:10.1002/anie.200705365.
- ↑ Dommerholt, Jan; Schmidt, Samuel; Temming, Rinske; Hendriks, Linda J. A.; Rutjes, Floris P. J. T.; Van Hest, Jan C. M.; Lefeber, Dirk J.; Friedl, Peter et al. (2010). «Readily Accessible Bicyclononynes for Bioorthogonal Labeling and Three-Dimensional Imaging of Living Cells». Angewandte Chemie International Edition 49 (49): 9422-5. PMC 3021724. PMID 20857472. doi:10.1002/anie.201003761.
- ↑ Mbua, Ngalle Eric; Guo, Jun; Wolfert, Margreet A.; Steet, Richard; Boons, Geert-Jan (2011). «Strain-Promoted Alkyne-Azide Cycloadditions (SPAAC) Reveal New Features of Glycoconjugate Biosynthesis». ChemBioChem 12 (12): 1912-21. PMC 3151320. PMID 21661087. doi:10.1002/cbic.201100117.
- ↑ Jewett, John C.; Bertozzi, Carolyn R. (2011). «Synthesis of a fluorogenic cyclooctyne activated by Cu-free click chemistry». Organic Letters 13 (22): 5937-9. PMC 3219546. PMID 22029411. doi:10.1021/ol2025026.
- ↑ Poloukhtine, Andrei A.; Mbua, Ngalle Eric; Wolfert, Margreet A.; Boons, Geert-Jan; Popik, Vladimir V. (2009). «Selective Labeling of Living Cells by a Photo-Triggered Click Reaction». Journal of the American Chemical Society 131 (43): 15769-76. PMC 2776736. PMID 19860481. doi:10.1021/ja9054096.
- ↑ Carpenter, Richard D.; Hausner, Sven H.; Sutcliffe, Julie L. (2011). «Copper-Free Click for PET: Rapid 1,3-Dipolar Cycloadditions with a Fluorine-18 Cyclooctyne». ACS Medicinal Chemistry Letters 2 (12): 885-889. PMC 4018166. PMID 24900276. doi:10.1021/ml200187j.
- ↑ «Life Is Sweet». stanfordmag.org (en inglés). 15 de febrero de 2022. Consultado el 11 de noviembre de 2022.
- ↑ «‘Honeymoon-Phase’ Chemical Partners Deliver a Toxic Drug to Tumors». Discover Magazine (en inglés). Consultado el 11 de noviembre de 2022.
- ↑ Gutsmiedl, Katrin; Wirges, Christian T.; Ehmke, Veronika; Carell, Thomas (2009). «Copper-Free "Click" Modification of DNA via Nitrile Oxide Norbornene 1,3-Dipolar Cycloaddition». Organic Letters 11 (11): 2405-8. PMID 19405510. doi:10.1021/ol9005322.
- ↑ Truong, Vinh X.; Zhou, Kun; Simon P., George; Forsythe, John S. (2015). «Nitrile Oxide-Norbornene Cycloaddition as a Bioorthogonal Crosslinking Reaction for the Preparation of Hydrogels». Macromolecular Rapid Communications 36 (19): 1729-34. PMID 26250120. doi:10.1002/marc.201500314.
- ↑ Van Berkel, Sander S.; Dirks, A. (Ton) J.; Debets, Marjoke F.; Van Delft, Floris L.; Cornelissen, Jeroen J. L. M.; Nolte, Roeland J. M.; Rutjes, Floris P. J. T. (2007). «Metal-Free Triazole Formation as a Tool for Bioconjugation». ChemBioChem 8 (13): 1504-8. PMID 17631666. doi:10.1002/cbic.200700278.
- ↑ Van Berkel, Sander S.; Dirks, A. (Ton) J.; Meeuwissen, Silvie A.; Pingen, Dennis L. L.; Boerman, Otto C.; Laverman, Peter; Van Delft, Floris L.; Cornelissen, Jeroen J. L. M. et al. (2008). «Application of Metal Free Triazole Formation in the Synthesis of Cyclic RGD DTPA Conjugates». ChemBioChem 9 (11): 1805-15. PMID 18623291. doi:10.1002/cbic.200800074.
- ↑ Henry, Lucas; Schneider, Christopher; Mützel, Benedict; Simpson, Peter V.; Nagel, Christoph; Fucke, Katharina; Schatzschneider, Ulrich (2014). «Amino acid bioconjugation via iClick reaction of an oxanorbornadiene-masked alkyne with a MnI(bpy)(CO)3-coordinated azide». ChemComm 50 (99): 15692-95. PMID 25370120. doi:10.1039/C4CC07892F.
- ↑ Row, R. David; Prescher, Jennifer A. (2016). «Tetrazine Marks the Spot». ACS Central Science 2 (8): 493-494. PMC 4999966. PMID 27610408. doi:10.1021/acscentsci.6b00204.
- ↑ Bach, Robert D. (2009). «Ring Strain Energy in the Cyclooctyl System. The Effect of Strain Energy on [3 + 2] Cycloaddition Reactions with Azides». Journal of the American Chemical Society 131 (14): 5233-43. PMID 19301865. doi:10.1021/ja8094137.
- ↑ Devaraj, Neal K.; Weissleder, Ralph; Hilderbrand, Scott A. (2008). «Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging». Bioconjugate Chemistry 19 (12): 2297-9. PMC 2677645. PMID 19053305. doi:10.1021/bc8004446.
- ↑ Hansell, Claire F.; Espeel, Pieter; Stamenovic, Milan M.; Barker, Ian A.; Dove, Andrew P.; Du Prez, Filip E.; o Reilly, Rachel K. (2011). «Additive-Free Clicking for Polymer Functionalization and Coupling by Tetrazine Norbornene Chemistry». Journal of the American Chemical Society 133 (35): 13828-31. PMID 21819063. doi:10.1021/ja203957h.
- ↑ Lim, Reyna K. V.; Lin, Qing (2011). «Photoinducible Bioorthogonal Chemistry: A Spatiotemporally Controllable Tool to Visualize and Perturb Proteins in Live Cells». Accounts of Chemical Research 44 (9): 828-839. PMC 3175026. PMID 21609129. doi:10.1021/ar200021p.
- ↑ Song, Wenjiao; Wang, Yizhong; Qu, Jun; Lin, Qing (2008). «Selective Functionalization of a Genetically Encoded Alkene-Containing Protein via "Photoclick Chemistry" in Bacterial Cells». Journal of the American Chemical Society 130 (30): 9654-5. PMID 18593155. doi:10.1021/ja803598e.
- ↑ Knight, James C.; Cornelissen, Bart (2014). «Bioorthogonal chemistry: implications for pretargeted nuclear (PET/SPECT) imaging and therapy». American Journal of Nuclear Medicine and Molecular Imaging 4 (2): 96-113. ISSN 2160-8407. PMC 3992206. PMID 24753979.
